서론
내생균(endophytic fungi)은 균근과 같은 독특한 구조를 형성하지는 않으나 숙주식물의 뿌리, 줄기, 잎 등에 공생하는 균류이다[1]. 내생균은 숙주식물에게 병원성을 나타내지 않으며[2], 2차 대사산물을 분비하여 식물을 포식자 및 병원체로부터 보호한다[3]. 또한, 식물체의 가뭄에 대한 내성을 증가시켜준다[4]. 본 연구에서는 경상북도 울릉도와 전라남도 여수에 서식하는 목본식물 잎에서 내생균을 분리하여 연구하던 중 확보된 국내 미기록종 내생균 2종의 형태, 계통적 특성에 대해 보고하고자 한다.
재료 및 방법
연구에 사용된 식물 시료는 2019년 5월에서 7월 사이에 채집하였다. 경북 울릉군 서면 남서리(37°29'15.4"N, 130°49'24.7"E)에 자생하는 너도밤나무(Fagus engleriana Seemen.)와, 전남 여수시 돌산읍의 금오산(34°35'36.6"N, 127°47'27.5"E)에 자생하는 복분자딸기(Rubus coreanus Miq.)의 병징이 없는 잎을 채집하여 폴리에틸렌 백에 담아 24시간 이내에 실험실로 운반하였다. 잎은 증류수로 세척 후 1% NaOCl 용액에서 1분간, 70% EtOH에서 2분간 차례로 표면살균 하였다[5]. 표면살균된 잎을 멸균된 가위를 이용하여 적당한 크기로 자른 후 potato dextrose agar (PDA)배지에 치상하였다. 배지를 25℃° dark side에서 배양하면서 나온 균사를 새로운 PDA배지 및 malt extract agar (MEA)에 계대하여 순수 분리하였다. 순수 분리된 균주는 해부현미경 하에서 균총의 크기와 색, 모양, 균사의 형태 등을 관찰하였고(Table 1), 분생포자(conidium)를 관찰하기 위해 슬라이드 배양법을 이용하여 25℃에서 7일간 배양 후 광학현미경상에서 관찰하였다. 균주의 동정을 위해 DiastarTM 10X Direct Lysis Buffer (SolGent, Daejeon, Korea)의 protocol에 따라 균사로부터 genomic DNA를 추출하였다. 균류 특이적인 여러 프라이머(Table 2)를 이용하여 추출된 DNA를 PCR로 증폭하고 1.5% agarose gel에서 전기영동을 통해 DNA band를 확인한 후 염기서열 분석을 의뢰하였다(SolGent, Daejeon, Korea). 분석된 염기서열은 NCBI상에서 BLAST하여 similarity를 확인한 후 MEGA X 프로그램을 이용하여[6] 두 영역 혹은 세 영역의 염기서열을 이어 neighbor-joinning 방식으로 계통수를 완성하였다. 동정된 미기록종 균주는 국립생물자원관(NIBR)에 기탁하였고, DNA 염기서열은 NCBI에 등록하였다.
결과 및 논의
Neofusicoccum mangiferae (Syd. & P. Syd.) Crous, Slippers & A.J.L. Phillips, Studies in Mycology 55: 248 (2006) [MB#500878]
여수에 서식하는 복분자딸기의 잎에서 분리된 균주로, PDA에서 7일간 배양된 균총의 크기는 45 mm 정도로 매우 빠르게 자란다. 앞·뒷면 모두 전체적으로 매끈한 흰색을 띠나 균사가 성기게 자라는 부분이 있어 마치 회색 띠를 가진 것처럼 보인다(Figs. 1A and 1E). MEA 배지에서 7일간 배양된 균총의 크기는 35-40 mm 정도이다. 앞면은 전체적으로 짙은 회색을 띠며(Fig. 1B), 뒷면은 검정색으로 끝부분이 불규칙한 형태를 이룬다(Fig. 1F). 균사가 생장하는 방향으로 구형의 분생포자경(conidiophore)이 줄줄이 생기며 하나씩 탈락되어 타원형 혹은 계란형의 분생포자로 발달한다(Fig. 1I). 분생포자는 어두운 회색을 띠며, 단일 격막을 갖고 크기는 (5.09-)5.57(-5.91)×(10.01-)10.82(-11.19) μm 정도이다(Fig. 1J).
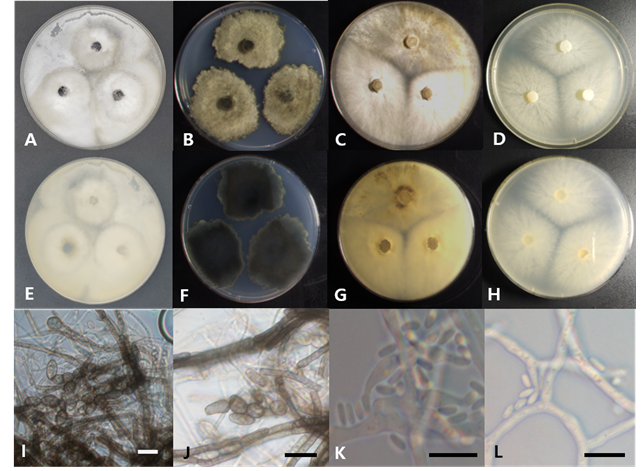
Fig. 1.Cultural and morphological characteristics of two endophytic fungal strains. Colonies of Neofusicoccum mangiferae 19E448 grown for 7 days on potato dextrose agar (PDA; A, E) and malt extract agar (MEA; B, F), conidia (I, J); Colonies of Thyronectria cucurbitula 19E298 grown for 7 days on PDA (C, G) and MEA (D, H), conidia (K, L) (Scale bars=10 μm).
Specimen examined. Keumosan mountain, Yeosu, Jeollanamdo, Korea, 34˚35´28.52˝N, 127˚47´57.13˝E, July 16, 2019, isolated from leaf of Rubus coreanus, strain 19E448, NIBRFG0000506605, GenBank No. MW192863 (ITS), MW192861 (LSU)
N. mangiferae는 인도의 망고(Mangifera indica)에서 분리된 것에서 종명이 유래하였으며, Dothiorella mangiferae로 최초 보고되었다가[7], Slippers & Phillips에 의해 현재의 속인 Neofusicoccum으로 재조합되었다[8]. N. mangiferae의 분생자는 Neofusicoccum속의 다른 종들이 갖는 분생포자에 비해 길이가 매우 짧은 것이 특징이다[9]. 본 연구에서 확인된 무격막(aseptate)의 타원형 분생포자는 원 기재문[8] 및 다른 연구[10]에서 확인된 N. mangiferae의 분생포자와 색깔, 형태 등이 일치하는 것을 확인하였다. ITS 염기서열은 N. mangiferae MK282738.1과 99.47%, LSU 염기서열은 N. mangiferae KF766370.1과 99.68%, β-tubulin 염기서열은 N. mangiferae KY608741.1과 99.28%의 일치도를 보였으며, 모두 같은 계통을 형성하였다(Fig. 2).
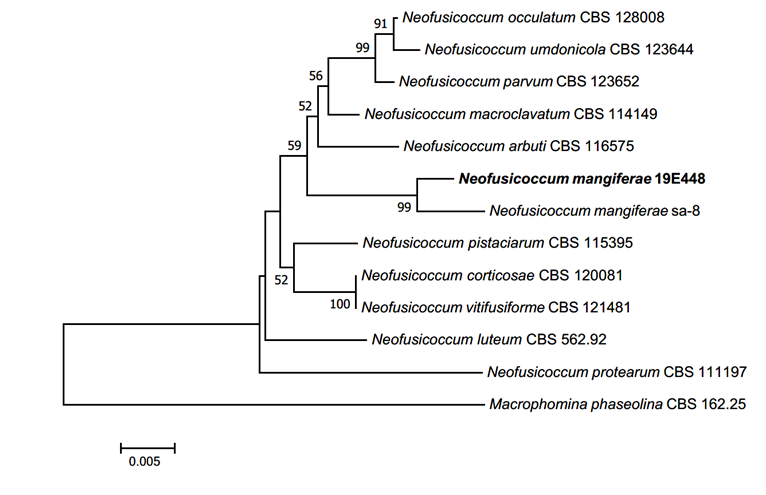
Fig. 2.Neighbor-joining phylogenetic tree of Neofusicoccum mangiferae based on a combined dataset of three DNA regions, internal transcribed spacer (ITS), large subunit (LSU) and β-tubulin (TUB) DNA sequences. Test of phylogeny was 1,000 replicated with bootstrap method. The fungal strain isolated in this study is in a bold.
Thyronectria cucurbitula (Tode) Fr., Summa vegetabilium Scandinaviae 2: 388 (1849) [MB#142532]
= Nectria cucurbitula
울릉도에 서식하는 너도밤나무의 잎에서 분리된 균주로, PDA에서 7일간 배양된 균총의 크기는 45 mm 정도로 매우 빠르게 자란다. 앞면은 옅은 갈색과 흰색이 뒤섞여 있으며, 전체적으로 솜털 같은 공중균사가 덮여있다(Fig. 1C). 뒷면은 어두운 노란색 혹은 황갈색을 띤다(Fig. 1G). MEA배지에서 7일간 배양된 균총의 크기는 38-45 mm 정도이다. 앞면은 연노란색의 공중균사가 균총의 전체 면적을 얊게 뒤덮고 있고(Fig. 1D), 뒷면은 전체적으로 연노란색을 띤다(Fig. 1H). 균총의 가장자리 부분은 불규칙하게 균사가 뻗어나와 있는 형태이다. 균사의 절간(internode) 부위에서 타원형의 분생포자가 퍼지듯이 형성되어 하나씩 탈락된다. 분생포자는 약간 어두운 회색이며 격막이 없는 것으로 보인다. 크기는 (0.42-)0.63(-0.72)×(2.94-)3.41(-3.94) μm 정도이다(Fig. 1I).
Specimen examined. Ulleungdo, Gyeongsangbukdo, Korea, 37˚31´11.36˝N, 130˚51´58.51˝E, May 1, 2019, isolated from leaf Fagus engleriana, strain 19E298, NIBRFG0000506599, GenBank No. MW192859 (ITS), MW192860 (LSU)
T. cucurbitula는 1791년에 Tode에 의해 Sphaeria cucurbitula로 최초 보고되었다가[11], 1849년에 Fries에 의해 자낭의 형태를 근거로 Nectria 속으로 재조합되었다[12]. Jaklitsch & Voglmayr (2014)는 rDNA의 LSU 영역 및 RNA polymerase subunit (RPB) 영역의 분자생물학적 계통을 증거로 이 종을 Thyronectria속에 위치시켰다[13]. 현재 Mycobank (https://www.mycobank.org/)에는 current name이 Nectria cucurbitula로 기록된 반면, NCBI와 Index Fungorum (http://indexfungorum.org/)에는 Thyronectria cucurbitula가 current name으로 기록되어 있다. Jaklitsch & Voglmayr의 연구에서는 형태적 특성의 비교는 기록되지 않았으나, 본 연구의 DNA 계통분석에서 Thyronectria에 속하는 종들은 Nectria 속의 종들과는 확실히 구분되는 계통을 보여주고 있다(Fig. 3). 따라서 본 연구에서는 이 종을 Thyronectria cucurbitula로 동정하였다. T. cucurbitula는 일반적으로 침엽에서만 분리된 기록이 있다고 보고되었지만[14], 본 연구에서는 낙엽 활엽수인 너도밤나무에서 내생균으로 분리되었다. 무격막의 투명한 장타원형 분생포자는 선행 연구에서 확인된 것[15]과 일치하였다. ITS 염기서열은 T. cucurbitula MH860919.1과 98.87%, LSU 염기서열은 T. cucurbitula MH 872657.1과 99.17%, β-tubulin 염기서열은 N. cucurbitula HM484592.1과 92.55% 일치하며, phylogenetic tree 상에서 같은 계통을 형성하였다(Fig. 3).
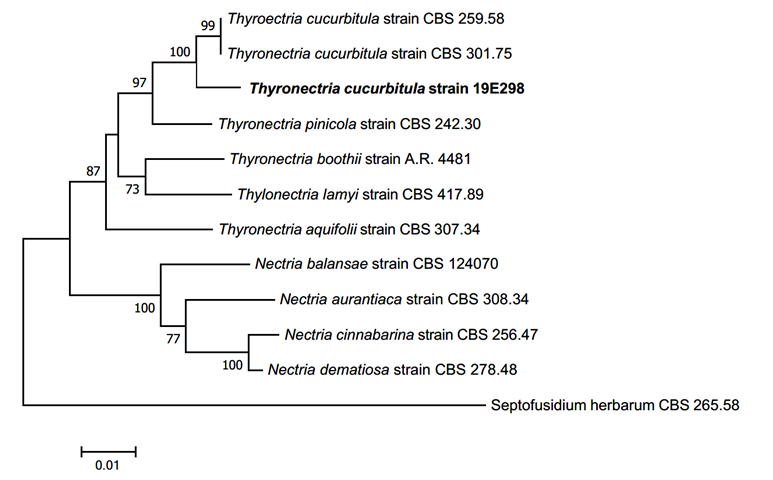
Fig. 3.Neighbor-joining phylogenetic tree of Thyronectria cucurbitula based on a combined dataset of three regions, internal transcribed spacer (ITS), large subunit of rDNA (LSU), and β-tubulin (TUB) DNA sequences. Test of phylogeny was 1,000 replicated with bootstrap method. The fungal strain isolated in this study is in a bold.
본 연구에서는 울릉도와 여수시에 서식하는 목본식물인 너도밤나무와 복분자딸기의 잎을 표면살균하여 두 종의 내생균을 분리하였으며, 각 균주의 형태적 특징과 분자계통학적 분석 결과 각각 Thyronectria cucurbitula와 Neofusicoccum mangiferae 로 동정하였다. 각 종은 현재까지 우리나라에서는 보고된 적이 없는 종으로 판단되어 형태학적 특징과 계통분석결과를 제시하였다.
적요
본 연구에서는 울릉도 및 여수에 서식하는 목본식물의 잎을 채취하고 내생균을 분리하였다. 분리된 균주는 배양 특성과 분생포자 등의 형태성 및 rDNA의 internal transcribed spacer 영역, large subunit 영역, 그리고 β-tubulin 영역의 DNA 염기서열을 분석하여 동정하였다. 연구 결과 국내 미기록 내생균 2종을 확인하였으며, 확인된 종은 Neofusicoccum mangiferae과 Thyronectria cucurbitula이다. 확인된 미기록종 균주의 형태적 특성 및 분자생물학적 계통분석의 결과에 대해 서술하였다.