우리나라에서 복령은 전통적인 한약재로 사용되었고[1], 식량이 부족할 때 구황식품으로도 이용되었다[2]. 복령은 중국의 전통 의약품 중 거의 10% 차지할 정도로 많이 사용되고 있다[3]. 복령은 이뇨[1], 폐선암[4], 조골세포 분화[5], 항암, 항산화 등 여러 가지 의약적 활성이 밝혀져[6], 한약재 자체 수요뿐만 아니라 타 수요 증가에 따라 수입량도 증가하고 있다. 2017년 국내 복령 생산량은 330톤, 수입량은 718톤이었다[unpublished data]. 국내의 복령 수요량은 최근 몇 년간 1,000톤 내외를 유지하고 있지만, 복령 가격이 중국산 수입량에 따라 크게 좌우되고 있다[7]. 국내 복령 생산은 채취에 의존하였으나, 1980년부터 인공재배가 시작되어 현재에 이르고 있다[7]. 현재 복령의 생산은 채취보다 재배 수확하는 방식으로 전환되어 가고 있다. 국가적 차원에서 산림청은 복령의 산림버섯 품목 지정과 더불어 생산을 촉진하고자 재료에 대한 보조금을 지급하고 있다[8].
국내의 복령 재배는 매몰재배(지하재배법)와 봉지재배(지상재배법)로 이루어지고 있다[7]. 재배품종으로는 1997년에 생산판매신고한 ‘복령1호’가 널리 재배되고 있다[9]. 그러나 아직까지 재배법에 적합하게 활용할 수 있는 품종의 다양성은 매우 낮은 상황이다. 국내의 채취 복령은 백복령과 적복령이 있고, 국내 전역에 분포하고 있는 것으로 알려져 있기 때문에[10] 다양한 복령 품종을 개발할 수 있는 유전자원은 풍부하다. 따라서 신품종 개발을 위해서는 이들 자원을 활용한 기초 연구가 필요한 실정이다. 본 연구는 신품종 복령을 개발하기 위한 선제 연구로서 국내 재배균주(백복령)와 야생균주(적복령, 백복령)의 교잡을 시도하였고, 실험실 내에서 복령의 균핵을 형성하는 균주를 선발하였으며 이에 대한 결과를 보고하고자 한다.
포자 분리
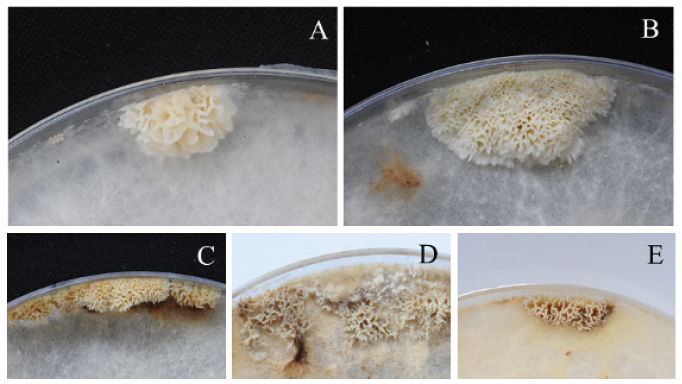
복령의 단포자 분리를 위해 사용한 균주는 국립산림과학원 균주보존실에 보존된 것을 이용하였다. 단포자 분리는 야생균주(적복령 1개와 백복령 2개)와 재배균주(2개) 총 5개 균주를 선택하였다. 자실체 발생은 potato dextrose agar (PDA; Difco, Detroit, MI, USA) 배지에 접종한 균을 30℃ 내외의 변온조건(22-35℃)을 유지하는 배양실에서 2달동안 배양하는 과정에서 이루어졌다(Fig. 1). 성숙한 자실체를 형성한 배지는 페트리 디쉬의 뚜껑을 교체한 다음 뒤집어서 2-3시간 놓았다. 뚜껑에 떨어진 포자는 멸균수를 이용하여 순차 희석한 후 각 포자액의 50 μL를 PDA 배지에 도말하였다. 배지는 25℃ 항온기에 3-4일동안 배양한 다음, 배지 표면에 발아된 단포자의 균사체는 새로운 PDA 배지에 30개씩 옮겼다. 각 균주별 단포자 분리균주는 25℃에서 10일정도 배양하면서 생장이 빠르고 균사체 모양이 다른 10개를 실험균주로 선발하였다. 실험에 사용한 단포자 균주는 NIFoS 3127 n1-n10, NIFoS 3128 n1-n10, NIFoS 5226 n1-n10, NIFoS 3050 n1-n10, NIFoS 5233 n1-n10으로 명명하였다.
Jo 등[11]은 10개 복령 균주 모두에서 자실체 발생과 포자분리가 이루어져 복령의 포자분리는 쉽게 이루어질 수 있음을 알 수 있다. 본 실험에서는 야생 복령 균주는 자실체 발생이 쉽게 이루어졌으나, 재배 복령 균주는 수차례 걸친 실험 결과 매우 드물게 이루어졌다. 따라서 야생 복령과 재배 복령은 자실체 발생에 있어 서로 다른 차이가 있음을 알 수 있다.
단포자 확인
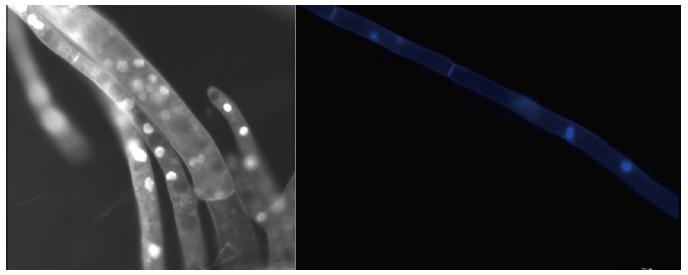
복령은 담자균류임에도 다핵균사에 꺽쇠 연결체(clamp connection)가 형성되지 않아 광학현미경을 통해 단핵균사를 확인하기 어렵다[12]. 이에 핵 개수 확인을 위해 핵을 염색시키는 4, 6-diamidino-2-phenylindole (DAPI, Sigma-Aldrich, Mannheim, Germany)와 세포벽을 염색시키는 Calcoflourwhite (CFW, Sigma-Aldrich, Mannheim, Germany)로 균사를 형광염색하였다. 농도는 DAPI 1,000X로 희석 후 3 μL/mL, CFW 200X로 희석 후 5 μL/mL로 맞추었으며 도립형광현미경(Leica, Wetzlar, Germany)을 이용하여 실험을 진행하였다. 자실체에서 받아낸 포자에서 분리한 균사를 PDA배지에서 5일가량 배양 후 균사를 형광현미경으로 관찰하였다. 균사 위에 시약을 혼합한 염색액을 5 μL 정도씩 분주한 후 2분가량 염색을 기다린 후 관찰 하였다[13]. 하지만 Fig. 2와 같이 한 세포 내에 1개 혹은 2개를 갖는 세포도 있으며 10개 이상의 다핵을 갖는 경우도 있었다[12]. 때문에 광학현미경과 형광현미경을 통해 단핵균사를 구분하기에는 어려움이 있었다. 단지 국가간 개체군 수준에서 homokaryons과 heterokaryons을 구분할 수 있는 SSR (Simple Sequence Repeat) 마커들이 개발되었다[13].
자실체에서 얻은 포자를 도말한 PDA 배지상에서 순수분리시킨 균사체의 모양이 다양하였다. 균사체를 크게 분류해 보았을 때 흰색의 낮게 자란 균사, 흰색의 밀도가 낮은 균사, 갈색의 낮게 자란 균사로 생장하였다. 이에 본 연구에서는 위에서 언급된 다양한 모양으로 자라는 균사체를 시험균주로 사용하여 교잡실험을 진행하였다.
교잡균주 육성
교잡균주 조합은 각각 10개 단포자 균주를 서로 붙여 대치배양 하여 총 100개씩 조합균주를 만들었다[14]. 교잡균주의 조합은 재배균주(NIFoS 3050, NIFoS 5233-백복령)와 야생균주(NIFoS 3127-적복령; NIFoS 3128, NIFoS 5226 백복령) 간 그리고 재배균주(NIFoS 3050, NIFoS 5233, 백복령) 간 이루어졌다(Table 1). 즉, 교잡조합은 NIFoS 3050 × NIFoS 3127, NIFoS 3050 × NIFoS 3128, NIFoS 3050 × NIFoS 5226, NIFoS 5233 × NIFoS 3127, NIFoS 5233 × NIFoS 3128, NIFoS 5233 × NIFoS 5226, NIFoS 3050 × NIFoS 5233 이었다. 대치배양은 PDA 배지 중앙에 교잡균주를 마주보게 배치하여 접종하였다[14]. 25℃ 항온기에 10일간 배양하면서 갈색 색소를 분비하거나 명확한 대치선을 만드는 것은 교잡이 이루어지지 않은 것으로 간주하였다. 즉, 갈변이 되거나 서로 대치선이 만들어진 것은 교잡균주에서 제외시켰다. 갈변이 없고 대치선이 불분명하거나 없는 것을 교잡균주로 가정하고 선발하였다. 각 선발된 교잡균주는 모균주와의 대치배양을 통해 대치선 형성 유무로 교잡형성 여부를 확인하였다.
교잡균주의 균핵 형성 시험
교잡조합은 총 700개였고, 이중 교잡균주로 338개(48%)가 선발되었다. 특히, 재배균주간 교잡률이 낮게 나타났다. 재배균주 NIFoS 3050이 NIFoS 5233보다는 약 3배 정도 교잡 성공률이 높게 나타났다(Table 1). 이와 같은 부분은 추후 교배형 분석을 통해 교배확률을 좀더 자세히 분석할 수 있을 것으로 기대된다.
Table 1. Hybrid strains of Wolfiporia cocos selected by two way cross-breeding.
|
|
NIFoS, National Institute of Forest Science N1-n10 represents ten strains from n1 to n10. |
선발된 교잡균주는 소나무 톱밥배지에 균 접종한 후 자실체 발생 조건에 동일한 조건에서 3개월동안 유지하면서 균핵형성 여부를 관찰하였다. 톱밥배지는 소나무(Pinus densiflora) 톱밥(직경 2-3 mm) 53 kg에 물 37 L를 넣고 혼합한 다음 사각통(Incu Tissue; SPL, Pocheon-si, Korea)에 배지를 200 g씩 넣고 121℃ 60분간 멸균하였다. PDA 배지에서 자란 균은 2×3 cm 크기로 절단하여 톱밥배지에 접종하였다. 접종배지는 30℃ 내외의 변온조건(22-35℃)을 유지하는 배양실에서 3개월간 배양하면서 1개월 간격으로 균핵 형성 유무를 조사하였다. 균핵 형성 여부는 배지 표면에 균사가 뭉쳐서 덩어리 형태를 갖는 것을 균핵으로 간주하였으며 단순히 균사들이 뻗어 덩어리 형성 흔적을 갖고 생장하지 않는 것은 제외시켰다.
338개 교잡균주 중 39개 균주가 복령 균핵을 형성하였다(Table 2). 배양통 표면에 나타난 균핵의 색깔은 2가지로 흰색, 암회색 계통의 흰색(조사과정에서 흰색으로 통일)과 노란색-황금색이었다(Fig. 3). 균핵이 1개 또는 2개 덩어리 형태로 자라는 것도 있었지만, 작은 덩어리 형태로 무리지어 자라기도 하였다. 균핵이 큰 것은 2개월 동안 2 cm 정도까지 생장하였다. 균핵의 내부는 전체적으로 백색을 띠고 있는 것과 약간 톱밥이 섞여 있는 것도 있었다. 노란색 계열의 균핵은 적복령과 백복령 교잡균주에서 모두 나타났다(Table 2).

Fig. 3. Formation of sclerotia by different Wolfiporia cocos strains in plastic containers with pine sawdust medium after culturing for two months. A, NIFoS 3127 (wild strain); B, NIFoS 3128 (wild strain); C, NIFoS 3050 (cultivation strain); D, NIFoS 5233 (cultivation strain); E, NIFoS 5775 (hybrid strain); F, NIFoS 5777 (hybrid strain); G, NIFoS 5780 (hybrid strain); H, NIFoS 5806 (hybrid strain).
적복령은 균핵 내부의 색깔이 황갈색-담홍색(yellow brown – pale pink) 이지만, 백복령은 백색(white) 인데, 국내에서 유통되는 대부분의 복령은 백복령이다. 본 연구에서 적복령과 백복령의 교잡균주에서 만들어진 균핵은 백색과 황색이었다. 백복령과 적복령의 균주는 PDA 배지상에서도 구별할 수 없었다. 균핵 수준에서 백복령과 적복령은 표현형적으로 매우 큰 차이이지만, 균사체 수준에서 백복령과 적복령을 구별할 수 없다. 따라서 균사체 수준에서 이들을 구별할 수 있는 분자마커 개발이 필요한 상태이다. 균핵을 형성하는 39개 균주는 야외 실험을 통해 생산성을 검정해야 하나[15], 본 연구에서는 복령의 균핵형성 유무에 주안점을 두었고, 차후 야외실험을 통해 우수한 균주를 선발할 계획이다.
복령의 단포자 분리, 교잡균주 육성, 균핵형성 유무 확인 과정은 전통적인 방법을 따라 이루어진 것이다. 특히 톱밥을 이용한 복령의 균핵형성 유무 확인은 짧은 시간에 균핵형성 균주를 선발하는데 매우 간단하고 유용한 방법이다. 본 연구에서는 누구나 쉽게 복령의 균핵형성 유무를 확인할 수 있는 방법을 제시하였다는 것에 큰 의미가 있을 것이다.