서론
느티만가닥버섯(Hypsizygus marmoreus (Peck) H. E. Bigel.)은 Beech mushroom으로도 알려져 있으며 일본에서는 부나시메지(Bunashimeji)로 불리는 대표적인 식용버섯이다. 국내에서 느티만가닥버섯 재배는 1980년 후반 처음 시작되었으며 안정적인 생산과 판매는 2000년대 초반부터 본격화되었다. 2018년 기준 국내 농산물도매시장을 통하여 거래된 느티만가닥버섯은 약 2,121톤으로 60억원 수준에 이르며, 거래량은 매년 증가되고 있다. 2019년 기준 일본의 느티만가닥버섯 생산량은 118,597톤으로 전체 버섯생산량의 26.1%를 차지하며 129,104톤의 팽이버섯 다음으로 많이 생산되어 소비되는 버섯이다[1]. 느티만가닥버섯은 영양학적으로 조미성분에 해당하는 글루탐산 함량이 높고[2], 주요 기능성분으로 Hypsin에 의한 항진균 활성 및 항종양 효과[3], Collagen binding protein HM23 [4], hypsiziprenol A9 [5], 버섯다당류[6]에 의한 항암효과 등이 보고되었다. 이와 같은 우수한 영양학적, 기능적 가치에도 불구하고 느티만가닥버섯은 느타리, 팽이버섯, 큰느타리 보다 재배기간이 100일 이상 소요되기 때문에 배양과 생육과정에서 병원균의 감염 위험성이 다른 버섯들에 비해 상대적으로 높은 편이다. 버섯을 대상으로 오늘날까지 다양한 곰팡이병과 세균병들이 보고되었다. 양송이(Agaricus bitorquis)의 경우 Verticillium fungicola var. fungicola에 의한 dry bubble병, Ewingella americana에 의한 internal stipe necrosis병, 팽이버섯(Flammulina velutipes)의 경우 Cladobotryum varium에 의한 곰팡이병, Erwinia carotovora subsp. carotovora에 의한 soft rot병과 Pseudomonas tolaasii에 의한 black rot병[7-11], 큰느타리의 경우 Pantoea sp.에 의한 soft rot병, Cladobotryum mycophilum에 의한 cobweb병 등이 보고되었다[12,13]. Back [14] 등은 C. mycophilum에 의한 양송이, 큰느타리, 팽이버섯, 느티만가닥버섯에 대한 cobweb병을 보고하였다. 이들 병원균들은 버섯의 재배 과정의 주요 단계에 관여하여 커다란 피해를 일으키는 것으로 알려져 있다. 또한 Penicillium속 곰팡이들은 포자 형성으로 버섯배지 내부를 우점하여 자실체의 형성을 저해하며 이후 이들 포자들은 재배실 내부로 확산되어 전체적인 피해를 유발하는 것으로 알려져 있다. P. brevicompactum의 경우 중국에서 잎새버섯(Grifola frondosa)을 대상으로 심각한 blue mold병을 일으키는 것으로 보고되었으며[15], 일본에서는 표고(Lentinula edodes)의 종균배양과정에서 발생된 곰팡이 피해 증상을 보고하였다[16]. 본 연구에서는 국내에서 처음으로 느티만가닥버섯 재배 과정에서 발생된 균긁기 후 버섯의 균사재생 저해 및 원기형성을 방해하는 곰팡이의 원인균을 분리하고 동정하였으며, 버섯 재배에 있어 유발되는 피해 특성에 대한 연구결과를 보고하고자 한다.
재료 및 방법
오염균 분리 및 보존
2018년과 2019년 동안 경남지역 느티만가닥버섯 재배농가로부터 곰팡이가 오염된 배지 시료를 수집하였다. 수집된 시료는 1.0% NaOCl 용액에 5분 동안 침지 한 후 살균 증류수로 3회 반복하여 세척하였다. 세척이 완료된 시료는 감자한천배지(potato dextrose agar, PDA)에 올려놓고 25℃에서 5일동안 항온기에서 배양하였다. 배양 후 배지에서 자란 균사는 살균된 메스를 이용하여 일정한 크기(1 cm × 1 cm)로 잘라서 새로운 감자한천배지에 올려놓고 균사가 완전히 자랄 때까지 배양하였다. 순수 분리된 곰팡이 균사와 포자는 살균 미네럴오일(Sigma, St. Louis, Missouri, USA) 용액에 넣고 4℃에서 장기보존하면서 이후 실험에 이용하였다.
Genomic DNA 추출 및 염기서열 분석
분리된 균주의 genomic DNA 추출을 위하여 감자배지(potato dextrose broth, PDB)에 접종하고 25℃에서 7일동안 항온기에서 진탕배양 하였다. 균사체는 100 mesh cell strainer (SPL, Gyeong-gi, Korea)를 이용하여 회수하고 동결 건조한 후 곱게 마쇄하였다. Genomic DNA는 i-genomic BYF DNA Extraction Mini Kit (iNtRON Biotechnology, Gyeong-gi, Korea)를 이용하여 사용매뉴얼에 따라 추출한 뒤 Nano-Drop 1000 (Thermo Fisher Scientific Inc., München, Germany)를 이용하여 농도를 측정하고 -20℃에서 보관하면서 실험에 사용하였다. ITS (internal transcribed spacers) 영역의 염기서열 분석을 통해 분리균을 동정하고자 ITS1 (5′-TCCGTAGGTGAACCTGCG-3′)과 ITS4 (5′-TCCTCCGCTTATTGATATGC-3′) 프라이머를 이용하여 PCR (polymerase chain reaction)을 수행하였다[17]. PCR 반응액은 10× PCR buffer 5.0 μL, 2.5-mM dNTP 4.0 μL, ITS1과 ITS4 프라이머(1 pmol/μL) 각각 8.0 μL, Taq polymerase 0.5 μL, genomic DNA (10 ng/μL) 5.0 μL 과 살균 3차증류수 19.5 μL를 넣어 50 μL로 맞추었다. PCR반응은 유전자증폭장치(PTC-200, MJ Research Inc., Watertown, Massachusetts, USA)를 이용하여 94℃에서 5분동안 1회에 걸쳐 변성을 유도하고, 94℃에서 30초, 52℃에서30초, 72℃에서 1분간의 반응을 35회 반복한 후 72℃에서 10 분 동안 수행하여 ITS 영역을 증폭하였다. 증폭된 유전자 산물은 1.5% 아가로스겔을 이용하여 전기영동 한 후 Gel SV kit (GeneAll, Seoul, Korea)를 이용하여 추출하였다. 추출된 DNA는 pGEM-T easy 벡터(Promega, Madison, Wisconsin, USA)를 이용하여 25℃에서 4시간동 반응시키고 Escherichia coli DH5α 균주를 이용하여 형질전환 하여 클로닝하였다. 염기서열 분석은 PRISM Ready Reaction Dye terminator/primer cycle sequencing kit (Perkin-Elmer Corp., Norwalk, Connecticut, USA)를 이용하여 반응한 후 DNA sequencer (Model 3100, Applied Biosystems, Foster City, California, USA) 분석하였으며 염기서열은 GenBank에 등록하였다. 분리균주의 유연관계 분석은 BLAST (National Center for Biotechnology Information [NCBI], U.S. National Institute of Health, Bethesda, Maryland, USA)에 등록되어 있는 GenBank 데이터베이스를 이용하여 진행하였다. 유연관계 계통도는 DNAMAN (Lynnon Biosoft, Quebec, Canada)프로그램을 이용하여 neighbor-joining 방법으로 작성하였다.
균학적 특성 조사
염기서열 및 유연관계 분석을 통해 동정된 분리균주의 형태적 특성과 배양적 특성을 조사하였다. 형태적 특성은 앞에서 언급된 방법을 이용하여 포자를 형성시킨 후 모양과 크기를 조사하였다. 배양적 특성은 감자한천배지(potato dextrose agar, PDA)로부터 수집된 포자를 이용하여 현탁액을 만든 뒤 새로운 감자한천배지 중앙에 10 μL를 접종한 후 5, 10, 15, 20, 25, 30, 35, 40℃에서 배양한 후 균사생장 수준 및 균총의 특성을 조사하였다. 버섯균사에 대한 저해특성조사는 감자한천배지에 느티만가닥버섯 균사와 분리균주 포자를 70 mm의 간격을 두고 접종하여 25℃에서 배양하면서 관찰하였다.
오염 곰팡이에 의한 피해특성 검정
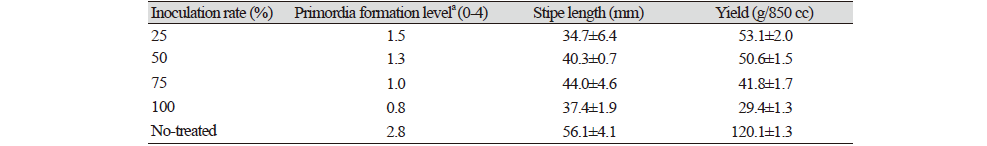
곰팡이에 의한 피해특성 검정을 위한 느티만가닥버섯 재배는 배지제조, 종균접종, 균긁기, 발이유도, 생육 및 수확단계로 진행되었다. 버섯 재배에 필요한 배지는 미루나무톱밥, 밀기울, 미강 및 건비지를 61:20:16:3 (%, w/w) 수준으로 혼합하고 배지 수분을 65% 내외로 조정한 뒤 121℃에서 90분간 고압 살균하였다. 살균이 완료된 배지는 냉각실에서 상온까지 냉각시킨 뒤 미리 배양이 완료된 MCM (Mushroom Complete Medium; Dextrose 20 g, MgSO4‧7H2O 0.5 g, KH2PO4 0.46 g, K2HPO4 1.0 g, Yeast extract 2 g, Peptone 2 g, Agar 18 g/L) 버섯 균사를 약 1.0 cm 크기로 잘라 접종하여 24℃내외에서 40일간 배양하였다. 배양이 완료된 배지는 균긁기 후 발이실로 옮겨 실내온도 15±1℃, 상대습도 98%, 이산화탄소농도 800±100 ppm의 조건에서 발이를 유도하였으며, 발이 이후에는 적정 생육 조건인 실내온도 15±1℃, 상대습도 95-98%, 이산화탄소농도 700±100 ppm에서 수확기까지 관리하였다. 균긁기 뒤 원기형성 이후 어린 갓이 형성된 기간을 발이 소요일수로 하였으며, 균긁기 이후 자실체 수확이 될 때까지의 기간을 생육소요일수로 나타내었다. 한편, 자실체 특성으로 발이개체수를 기준으로 원기형성 이후 발이 수준을 발이도로 나타내었다. 버섯의 발이도는 버섯의 발이 개체 수에 따라 발이 수준을 수치화 하였으며 850 cc (Ø60 mm) 플라스틱 병 기준으로 전체 발이 개체수가 0-25개 인 것을 1, 25-50개인 것을 2, 50-75개 인 것을 3, 75-100개 이상인 것을 4로 표시하였다. 자실체 수량 및 특성은 농촌진흥청 표준조사법에 준하여 조사하였다. 병원성 검정을 위하여 분리 균주는 감자한천배지를 이용하여 미리 접종하여 배양하였다. 버섯배지에 접종을 위한 병원균 준비는 살균 3차증류수 10 mL를 포자가 형성된 배지에 첨가하여 피펫으로 상등액만을 회수한 뒤 40 mesh cell strainer (SPL, Gyeong-gi, Korea)를 이용하여 여과하였다. 여과된 포자액은 헤모사이토미터를 이용하여 1.0×106 conidia/mL 수준이 되도록 살균 증류수로 희석한 뒤 접종원으로 이용하였다. 병원균의 접종은 피펫을 사용하여 균긁기 후 버섯배지 상면을 대상으로 4등분하여 포자현탁액을 접종하였다. 대조 처리로 살균증류수를 이용하였으며 모든 시험은 3반복으로 처리하였다.
결과 및 고찰
피해특성
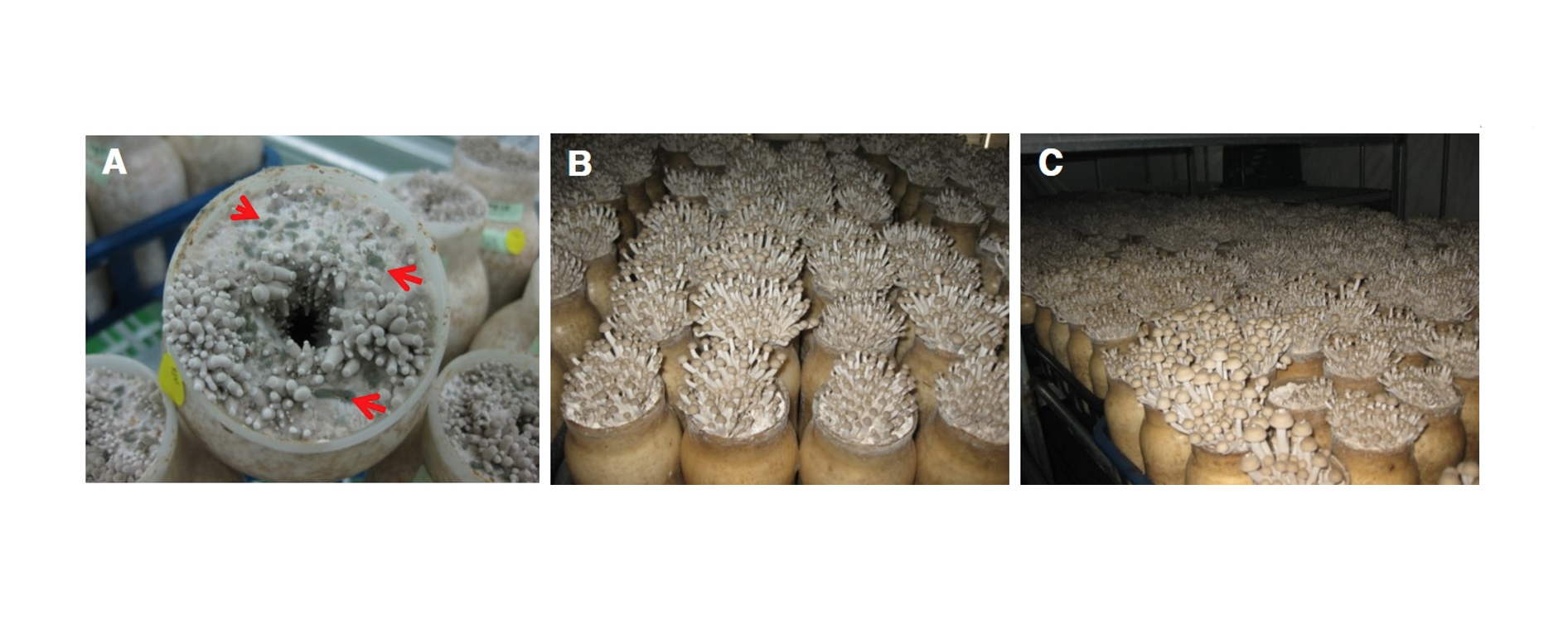
2018년과 2019년 사이 경남지역 느티만가닥버섯 재배농가에서 피해특성이 처음 확인되었다. 곰팡이에 감염된 버섯배지 표면은 생육초기단계에서 균사의 재생, 원기형성, 자실체분화가 정상적으로 이루어지지 못하였다(Fig. 1). 또한 원기형성이후 자실체 분화과정에서 곰팡이 오염 부위 주변 버섯은 대가 약간 두터워지는 특징을 보였으며 건조한 조건에서 배지 표면에 포자 형성이 확인되었다. 곰팡이 오염 배지의 경우 자실체 발생개체수를 현저히 감소시키는 특성을 보였으나, 오염 주변에 발생된 자실체에 대해서는 외형적으로 보이는 뚜렷한 피해 증상을 유발하지 않았다. 잎새버섯 봉지재배에서 Penicillium brevicompactum에 의해 감염될 경우 노란물방울을 형성하고 생육이 저해되면서 결국 사멸하게 된다고 보고하였는데[15] 느티만가닥버섯에 대한 동일 곰팡이의 피해 증상은 잎새버섯에서 유발되는 증상과 차이를 보였다.
균학적 특성 및 동정
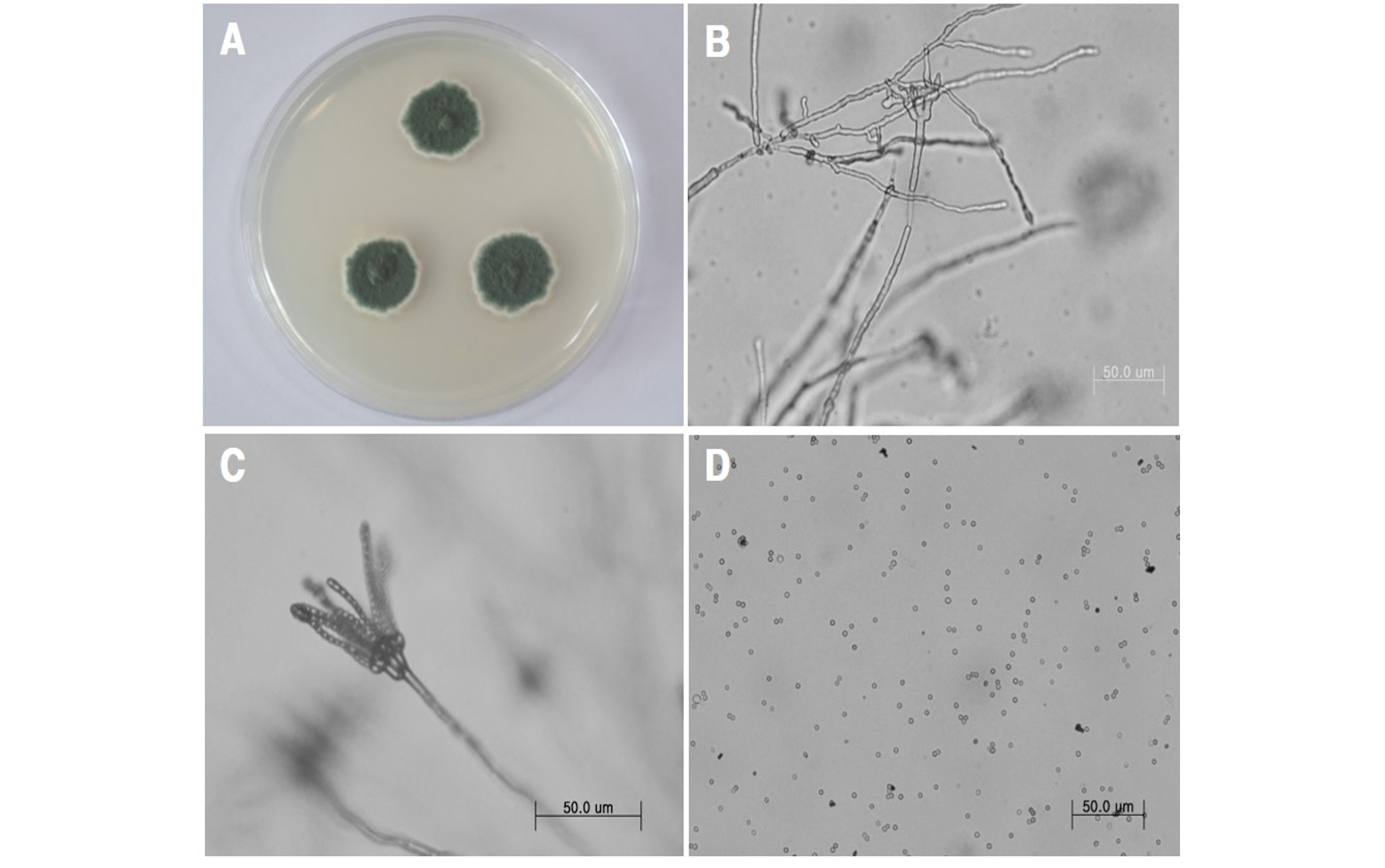
느티만가닥버섯 발이 및 생육이 정상적으로 되지 않으면서 배지 표면에 푸른색의 포자를 형성하고 있는 배지로부터 순수 분리된 균주의 균사 생장 수준을 확인하기 위하여 감자한천배지에 접종하고 25℃ 항온기에서 배양한 결과 생육 속도는 2.3-2.7 mm/day 수준으로 느리게 생장이 이루어지며, 균총의 중심에 여러 개의 돌기가 형성되었다. 배지상에서 균총 주변에 대한 색소 형성은 확인되지 않았으며, 균총의 전체 표면에서 회색을 지니는 진녹색포자를 형성하였다. 분생포자는 격막이 없는 구형 또는 약한 타원형으로 크기는 2.0-3.1×2.2-3.4 μm이었다(Fig. 2). 균사의 생육적합 온도는 25℃로 확인되었으며 30℃이상에서 균사생장은 현저히 감소하였다.
이러한 특성은 잎새버섯 곰팡이병 유발 원인균으로 보고된 Peniclillium brevicompactum과 대부분 일치하였으며 분생포자의 크기는 조금 작다.[15]. 분리균에 대한 동정을 위하여 ITS rDNA 영역에 대한 염기서열을 분석하였다. GenBank에 등록되어 있는 유사균주를 대상으로 계통도를 작성하고 유연관계를 분석한 결과 분리균주는 Penicillium 속에 속하며 P. brevicompactum (AY373897)과 100.0%의 높은 상동성을 나타내었다(Fig. 3). 이러한 결과를 바탕으로 분리균주를 P. brevicompactum F51 동정 및 명명하였으며 ITS rDNA염기서열은 NCBI Genbank 에 등록하였다(Accession number MN006169).
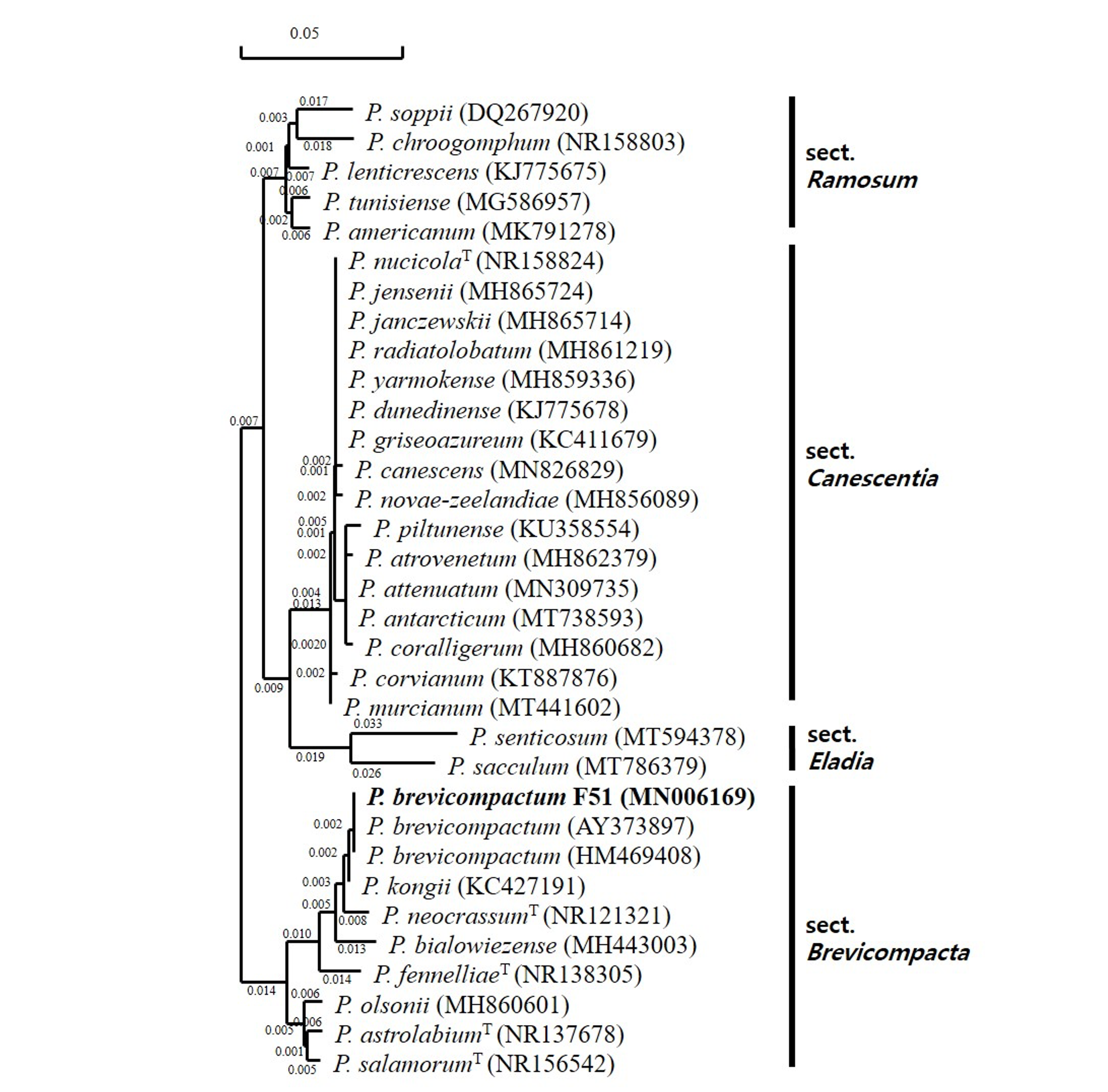
Fig. 3. Phylogenetic tree constructed by the neighbor-joining method, comparing the internal transcribed spacers(ITS) sequences of the presnet isolated strain with those of other Penicillium species from GenBank. Branch lengths are proportional to phylogenetic distance. The scale bar represents genetic distance. T = type strain. The name in bold type is the isolated strain described in this study.
곰팡이 오염에 따른 피해 검정
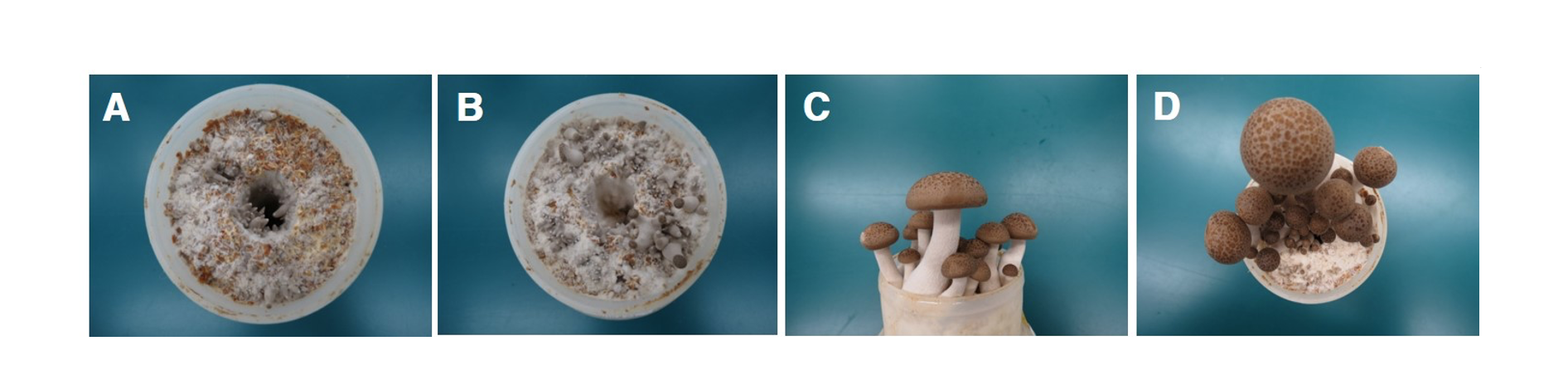
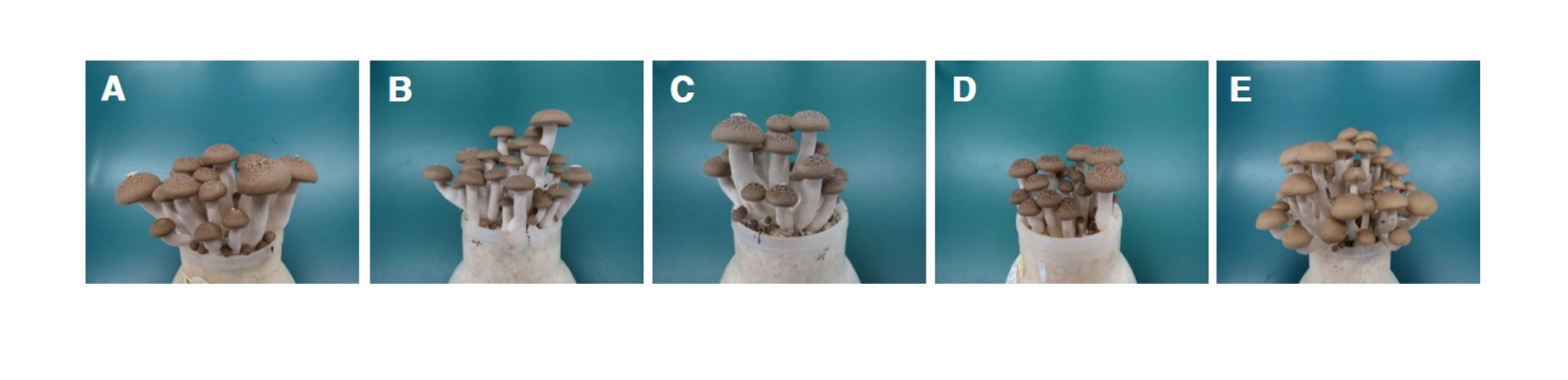
분리균주의 오염에 따른 피해 확인을 위하여 느티만가닥버섯 균사 배양이 완료된 배지를 대상으로 접종원을 제거한 뒤 배지표면에 포자 현탁액 10 mL을 처리하였다. 접종 5일 후 버섯균사의 재생은 불완전하게 이루어졌으며 버섯 균사밀도는 낮은 수준을 유지하였다. 접종 8일 이후 원기는 불균일하게 형성되었고 발이 개체수는 감소하였다. 생육단계에서 갓의 색과 모양 등 자실체 형태는 정상개체와 차이는 확인되지 않았으나 발이 개체수 감소에 따라 대가 두터워지는 특성을 보였다. 그러나 발이단계이후 정상적으로 생육이 진행된 자실체에 대해서는 곰팡이에 의한 외형적 변화는 관찰되지 않고 수확이 가능하였다(Fig. 4). 이러한 결과는 농가에서 발생된 증상과 동일한 것으로 확인되었으며 버섯 주변에 균사가 뒤덮은 상태에서 피해를 유발하는 Cladobotryum mycophilum과는 차이를 보여 주었다[13]. 또한 표고 톱밥배지 재배에 있어 종균 접종 초기에 P. brevicompactum에 의해 감염될 경우 불규칙한 모양을 가지는 자실체가 많이 생산된다고 보고한 것과는 차이를 보였다[16]. 느티만가닥버섯 재배과정에서 P. brevicompactum 감염에 따른 피해 특성을 확인해보고자 균긁기 후 노출된 버섯 배지 표면을 4등분으로 구분하고 1구획(25%), 2구획(50%), 3구획(75%), 4구획(100%)으로 나누어 포자현탁액을 한 구획당 2.5 mL씩처리하고 생육 특성을 조사하였다. 병원균의 접종 수준이 증가할수록 버섯 발이 개체수는 감소하는 경향이었으며 최대 71.5%까지 감소하였다. 생육이 진행된 자실체의 대 길이도 무처리에 비해 짧아지는 특성을 보여주었다. 버섯 수량은 곰팡이 접종 수준이 증가할수록 최대 75.6%까지 감소하였다(Table 1; Fig. 5). 이러한 결과는 느티만가닥버섯 재배과정에서 P. brevicompactum에 오염될 경우 버섯의 균사생육 저해 및 정상적인 원기형상과 발이 과정을 방해함으로서 수량을 감소시키는 피해를 유발하는 곰팡이라는 사실을 보여주는 것이다. 느티만가닥버섯 생육과정에서 오염되는 곰팡이균의 균학적 특성 및 증상에 대한 연구결과는 느티만가닥버섯에 피해를 유발하는 곰팡이에 대한 관리와 예방에 도움을 줄 수 있을 것으로 판단된다.
적요
느티만가닥버섯은 일본에서 가장 많이 생산하고 소비되는 버섯으로 영양학적 가치, 우수한 식감 및 저장성 때문에 국내에서도 점진적으로 생산량이 늘어나고 있다. 2018년과 2019년 사이 경남지역 느티만가닥버섯 재배농가에서 자실체 발생이 불균일하며 수량이 감소하는 피해가 확인되었다. 분리한 오염균은 균총의 전체 표면에 회색을 띠는 진녹색포자를 형성하였다. 분리 균주의 균사생장 적합온도는 25℃로 확인되었으며 비교적 느리게 자라는 특성을 보여주었다. 분리 균주는 ITS rDNA 염기서열 분석결과 Penicillium brevicompactum과 100.0%의 상동성을 나타내었고, P. brevicompactum F51로 동정 및 명명하였다. 분리 균주를 처리한 배지는 농가에서 수집된 시료와 동일하게 버섯균사의 재생을 저해하면서 발이가 46.5-71.5% 수준까지 감소되었으며, 수량은 최대 75.6%까지 감소하였다. 이러한 결과는 P. brevicompactum이 느티만가닥버섯 재배과정에서 피해를 일으킨다는 사실을 국내에서 처음 보고하는 것이다.