서론
싸리버섯은 자연에서 흔히 볼 수 있는 버섯으로 맛과 향이 독특하여 예부터 우리 식문화에 자리 잡았다[1]. 싸리버섯은 맛과 더불어 당질, 단백질, 아미노산, 무기질, 비타민 등 인체 중요한 영양소를 함유하고 있으며 항암, 항바이러스, 면역 강화, 항염증 및 간 보호 등 우수한 가치가 있는 생물학적 화합물의 공급원이다[2,3]. 그중 소포자나무싸리버섯 (Artomyces microsporus (Qiu X. Wu & R.H. Petersen) Lickey)은 목재부후균으로 분류학적 위치는 주름버섯강 무당버섯목 솔방울버섯과 나무싸리버섯속의 버섯이다. A. microsporus는 초여름부터 가을까지 발생되며 소나무 표피 균열에서 산호와 같은 모양으로 자라며 자실체의 크기는 7-16 cm, 너비 5-10 cm 정도이다[4]. 또 소포자나무싸리버섯은 2-6개의 가는 분지를 생성하고 분지 끝은 왕관 모양으로 지름은 약 2 mm이다. 어린 자실체의 색상은 베이지색을 띠며 노화가 진행될수록 짙은 갈색으로 변한다. 포자는 백색으로 크기는 3.0-3.8×2.1-2.9 μm이며, 형태는 타원형으로 미세한 돌기가 있다[4]. 소포자나무싸리버섯은 조직이 치밀하고 식이섬유가 풍부하며 다른 싸리버섯류와 마찬가지로 설사를 일으킬 수 있기 때문에 식용에 있어 주의해야 한다. 소포자나무싸리는 현재 분류에 관련한 연구만 진행된 상태로 균사체의 생리학적, 배양적 특성에 대한 연구는 미흡한 실정이다[5,6]. 따라서 본 연구는 A. microsporus의 분자생물학적 동정 및 균사 배양에 적합한 최적 조건과 영양원을 분석하여 구명한 결과를 보고하고자 한다.
재료 및 방법
공시 균주 및 배양 배지
본 연구에 사용된 균주는 한국농수산대학에서 보존 중인 KN00165 균주를 분양받아 사용하였다. 시험에 사용된 균주는 PDA 상에 접종하여 암 배양 상태로 25℃ 항온기에서 배양 후 3회 이상 계대를 거쳐 본 시험에 사용하였다.
Genomic DNA 추출
균주로부터 Genomic DNA를 추출하기 위하여 PDA 평판 배지 상에 배양된 균사체를 수거하여 동결건조하였다. 동결 건조한 균사체를 곱게 마쇄한 후 100 μg을 1.5 mL test tube에 옮기고 추출 완충액(200 mM Tris-HCl, pH 8.0; 200 mM NaCl; 25 mM EDTA; 0.5% SDS) 650 μL와 Proteimase K (20 mg·mL-1)를 첨가하여 buffer와 철저하게 섞어 65℃에서 1시간 동안 반응하였다. 반응 후 Chloroform:isoamylalcohol (24:1)을 넣고 혼합한 후 12,000 rpm에서 15분간 원심분리하였다. 원심분리 후 상등액을 새 튜브에 옮겨 0.7 volume의 isopropanol을 첨가하고 -20℃에서 10분간 방치 후 12,000 rpm에서 5분간 원심분리하여 DNA를 침전하였다. 70% ethanol로 DNA 침전물을 세척하여 진공 건조한 후 TE buffer (10mM Tris-HCl pH 8.0; 1 mM EDTA) 50 μL에 용해하였다. RNase (10 mg·mL-1) 2 μL를 넣어 37℃에서 30분 처리하여 RNA를 제거한 후 template DNA로 사용하였다.
Intermal transcribed spacers (ITS) rDNA 염기서열 분석
추출한 DNA를 주쇄로 ITS 1 (5’-TCCGTAGGTGAACCTGCGG-3’)과 ITS 4 (5’-TCCTCCGCTTATTGATATATGC-3’) primer를 이용하여 polymerase chain reaction (PCR) 분석을 수행하였다. ITS 염기서열 분석방법은 균류의 계통분류에 많이 사용되는 방법으로 KN00165의 종명을 분석하고자 수행하였다[7] . PCR 증폭 조건은 DNA 변성 94℃ 4분, 94℃ 1분, annealing 55℃ 1분, 합성 72℃ 2분, 35 cycle 실시 후 최종 DNA 합성 72℃ 10분으로 하였다. 증폭된 산물은 1.5% agarose gel에서 전기영동한 후 UV lamp를 통해 관찰 후 PCR clean-up gel extraction kit (Macherey-nagel Co., Duren, Germarny)를 사용하여 PCR 산물을 정제하였다. 정제된 PCR product를 Genotech (Daejeon, Korea) 사에 의뢰하여 염기서열 분석하였다. 분석한 염기서열은 MEGA X program (Molecular Evolutionary Genetics Analysis, https://www.megasoftware.net/)을 이용하여 Neighbor-joining 방법으로 계통수를 작성하였으며, tree 안정성은 bootstrap 1,000 반복하여 분석하였다[8].
균사 배양 적합 배지 선발
균사 배양용 적합 배지 선발을 위해 PDA (potato 200 g, dextrose 20 g, agar 20 g; 1L 기준), MMM (dextrose 20 g, MgSO4 0.5 g, KH2PO4 0.46g, K2HPO4 0.46 g, DL-Asparagine 2 g, thiamine-HCl 120 μg, agar 20 g; 1L 기준), YM (yeast extract 3 g, malt extract 3 g, peptone 5 g, dextrose 10 g, agar 20 g; 1L 기준), MCM (dextrose 20 g, MgSO4 0.5 g, KH2PO4 0.46g, K2HPO4 1.0 g, yeast extract 2 g, peptone 2 g, agar 20 g; 1L 기준), MEM (malt extract 20 g, peptone 5 g, agar 20 g; 1L 기준) 등 총 5가지의 배지를 조제하여 균사 배양에 적합한 배지를 선발하였다.
균사 배양 적합 초기 pH 및 적온 선발
초기 pH에 따른 A. microsporus의 생육 정도를 조사하기 위해서 1 N NaOH와 1 N HCl을 이용하여 pH 5.0에서 pH 11.0까지 pH 1.0 간격으로 PDA를 조성하였다. A. microsporus 균사체 선단 부분을 5 mm cork borer를 이용하여 동시에 접종하였다. 최적 pH 선발 후 온도를 2-3℃ 간격으로 온도를 좁게 설정하여 각각의 항온기에서 암 배양하고 2일 간격으로 균사 생육 정도를 조사하였다.
균사 배양 적합 탄소원의 선발
공시 균주의 균사 생육 시 적합한 탄소원을 선발하기 위하여 단당류, 이당류, 다당류 등 adonitol을 포함한 총 21종 탄소원을 1%가 되도록 조제하였다. PDA 상에 배양한 균주 선단 부위를 5 mm cork borer를 이용하여 절체 하여 배지 종류별로 동시에 접종하였다. 기초 배지 pH는 동일하게 5.0으로 고정했으며 항온기에서 20일간 암 배양하여 균사 생육 속도를 2일 간격으로 조사하였다. 선택된 탄소원은 최적 균사 생육 조건을 설정하기 위하여 농도별 실험을 실시하였다.
균사 배양 적합 무기 및 유기질소원의 선발
탄소원 선발 과정과 동일하나 선발된 탄소원을 최적 농도를 pH 5.0로 고정하여 기초 배지로 (NH4)2C2O4 등 무기질소원 7종, malt extract 등 유기질소원 7종을 각 1%의 농도로 조제하였다. 각 배지에 A. microsporus 균사를 동시에 접종하고 위 실험과 동일한 방법으로 균사 생육 정도를 조사하였으며 선택된 유기 및 무기질소원은 최적 배양 조건을 설정하기 위하여 농도별 실험을 실시하였다.
균사 배양 적합 아미노산의 선발
선발된 탄소원 및 무기, 유기질소원 최적 농도별로 포함된 배지를 pH 5.0로 고정하여 기초배지로 alanine 등 아미노산 14종을 각 1%의 농도로 첨가하여 배지를 조제하였다. 아미노산 선발 시 위 실험들과 동일한 방법으로 균사 생육 조사를 실시하였으며, 선택된 아미노산은 최적 배양 조건을 설정하기 위하여 농도별 실험을 실시하였다.
균사 배양 적합 유기산의 선발
선발된 탄소원 및 무기, 유기질소원과 아미노산이 최적 농도별로 포함된 배지를 위와 같이 동일한 방법으로 고정한 배지에 acetic acid 등 유기산 7종이 각각 0.1%가 포함 되도록 조제하였다. 선택된 유기산은 농도별 실험을 진행하였으며 균사 생육 실험은 위 실험들과 동일하게 실시하였다.
균사 배양 적합 무기염류의 선발
탄소원 및 유기, 무기질소원과 아미노산, 유기산이 최적 농도별로 포함되어 있는 배지를 고정으로 AgNO4를 포함한 무기염류 13종을 1 mM 농도로 조제하여 무기염류를 선발하였다. 선발 후 최적 농도를 구명하기 위하여 농도별 실험을 진행하였으며 균사 생육 속도를 위 실험들과 동일하게 실시하였다.
통계분석
모든 실험 결과는 평균(meane)±표준편차(standard deviation, SD)로 나타내었으며 3회 반복 실시하였다. 각 실험 군의 통계적 유의성 검정은 SAS 9.4 software (statisitical analysis system; SAS Institue, Cary, NC, USA) 이용하여 Duncan’s multiple test를 통해 유의성(p<0.05)을 검증하였다. 선발 배지 유의성 차이에 있어서는 Student’s t-test를 이용하여 paired t-test 하였고 유의성(p<0.05)을 검증하였다.
결과 및 고찰
ITS 염기서열에 의한 분자생물학적 동정
균주에 대한 ITS 염기서열을 분석한 결과 727 bp의 증폭 산물을 얻었으며 NCBI (National Center for Biotechnology Information) 정보에 등록되어 있는 종들과 상동성을 비교하여 분석한 결과를 Fig. 1에 나타내었다. GenBank에 BLAST 한 결과 KN00165 (GenBank accession no. MW647518)는 기존 보고된 일본의 균주 (GenBank accession no. AF336137)와 99.3% (646/649 bp) 상동성을 보였다. 또한 A. pyxidatus 와 86%의 근접한 근연관계에 있는 것을 확인할 수 있었는데 근연관계가 차이가 있으나 실제 야생에서 A. pyxidatus와 A. microsporus는 형태적으로 매우 흡사하여 구분하기가 어렵다. 1991년 Qiu-xin & Ronald에 의해서 A. pyxidatus와 A. microsporus는 대치배양을 통해 뚜렷한 대치선을 확인하여 다른 종임을 증명하였으며[9], 1947년 Doty의 연구결과 A. pyxidatus와 A. microsporus를 포자의 크기에 따라 분류하였다. A. pyxidatus의 포자의 크기는 4-5×2.5 µm이며, A. microsporus의 포자의 크기는 3.0-3.8×2.1-2.9 µm로 A. pyxidatus의 포자의 크기가 세로 길이 평균 1.2 µm 정도 크며, 모양은 원형이나 subglobose 형태의 포자인 것으로 나타나 A. microsporus 광학현미경 상 포자의 크기로 두 종의 구분이 가능하다[10].
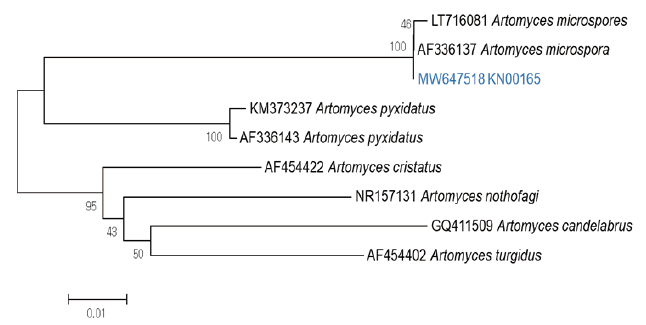
Fig. 1. Phylogenetic relationships of A. microsporus based on intermal transcribed spacers (ITS) region sequences. Number on branch is bootstrap values 1,000 replicate analysis. genetic distance between samples. Bar=0.01 (Blue color font : A. microsporus strain used in the study accession no. MW647518).
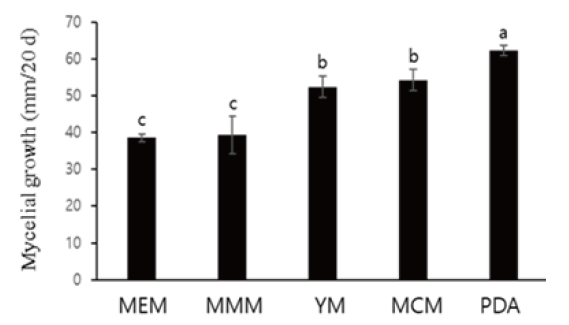
배지 종류에 따른 A. microsporus 균사 생육 특성
A. microsporus의 균사 생육 적정 배지를 확인하기 위하여 YM, MCM, PDA, MEM, MMM을 이용하여 25℃에서 2일 간격으로 조사한 결과를 (Fig. 2)에 나타내었다. 그 결과 배양 20일째 PDA 균사 생육이 50 mm로 가장 빨랐으며 MCM, YM, MMM, MEM 순이었으며 대조군으로 PDA를 선발하였다.
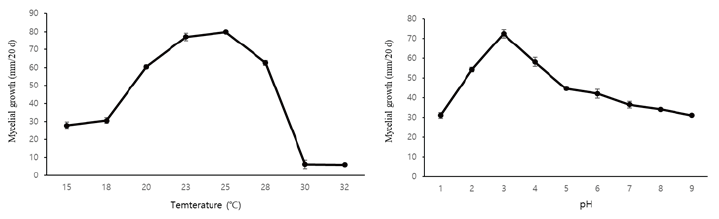
온도 및 pH에 따른 A. microsporus 균사 생육 특성
A. microsporus의 균사 생육 적정 온도를 확인하기 위하여 15℃에서 32℃까지 2-3℃ 간격으로 조밀하게 설정하여 조사한 결과 배양 20일째 A. microsporus의 최적 온도는 25℃이며 최저 23℃, 최고 28℃까지 생육이 가능한 것으로 확인되었다(Fig. 3A). 15℃에서 18℃까지 A. microsporus 생육이 저조하였으나 20℃부터 점차 생육 속도가 빨라졌으며, 25℃까지 왕성하게 균사가 생육하였고 28℃ 이상에서는 생육이 저하가 되는 것을 확인하였다. A. microsporus 최적 pH는 5.0이었으며, pH 7.0 이상에서 균사의 생육이 감소하는 것을 확인할 수 있었다(Fig. 3A).
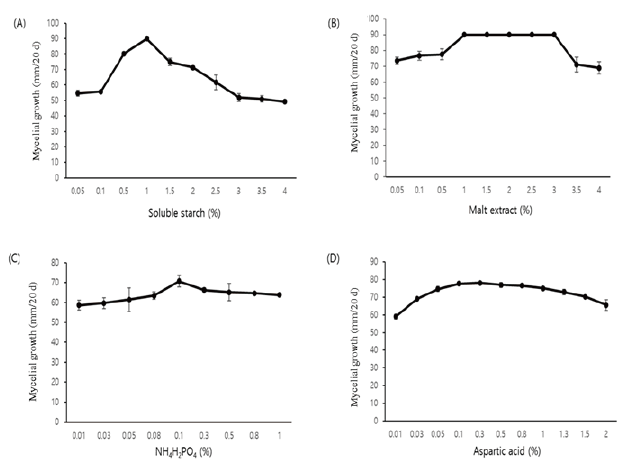
탄소원의 선발에 따른 A. microsporus 균사 생육
탄소원으로 adonitol 등 21종의 탄소원에 따른 A. microsporus의 균사 생육 결과를 Fig. 4에 나타내었다. 배양 20일째 가용성 녹말인 soluble starch에서 18일차 90 mm로 가장 빨리 생육하여 최적 탄소원으로 선발되었다. 대부분의 탄소원에서 55.8-80.0 mm로 생육이 우수하였으나 펜티톨의 일종인 adonitol에서 20일간 배양했을 때 10 mm로 가장 균사 생육이 저조하였다. 대체로 탄소원만 첨가 되었을 때 균사의 밀도가 좋지 못하였으나 균사의 생육이 가장 빨라 선발된 탄소원 soluble starch에 대한 농도별 실험 결과(Fig. 8A) 1%에서 가장 생육이 왕성하며 1.5% 이상에서는 오히려 생육이 감소하는 것을 확인하였다.
유기질소원 및 무기질소원의 선발에 따른 A. microsporus 균사 생육
유·무기질소원은 malt extract를 포함하여 7종에 따른 균사 생육에 미치는 영향을 조사한 결과를 Fig. 5에 나타내었다. 그 결과 배양 20일째, malt extract에서 79.0 mm로 가장 생육이 우수하고 왕성한 모습을 확인하였다. 균사 생육의 최적 농도는 malt extract 1%로 확인되었고 3%까지 생육 상태가 일정하게 지속되다 3.5% 이상부터 생육이 저하되는 것을 확인하였다(Fig. 8B).
무기질소원 (NH4)2C2O4 등 7종에 따른 A. microsporus 균사 생육을 조사한 결과는 Fig. 6에 나타내었다. (NH4)2HPO4를 제외한 모든 처리구에서 생육하지 않았다. 최적 무기질소원으로는 (NH4)2HPO4가 선발되었으나 농도는 0.1%의 저농도에서 균사의 생육이 안정적이었다(Fig. 8C). 무기질소원 첨가 시 균사의 생육이 평균 8.0 mm 정도 감소한 것이 확인되었으나 탄소원과 유기질소원 두 가지만 첨가했을 때 보다 일정한 균사 생육 상태를 보였다.
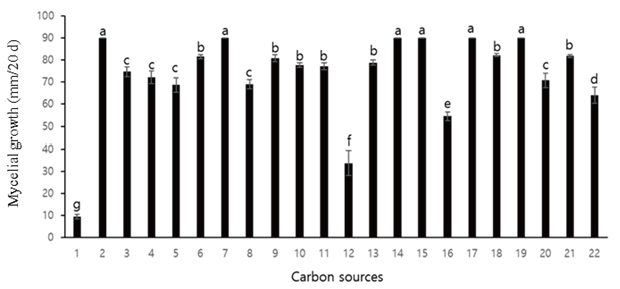
Fig. 4. Effect of carbon sources for the growth of A. microsporus in medium. 1: Adonitol; 2: Arabinose; 3: Cellobiose; 4: Dextrin; 5: Dextrose; 6: Ethanol; 7: Fructose; 8: Galactose; 9: Glucose; 10: Glycerol; 11: Inositol; 12: Lactose; 13: Maltose; 14: Mannitol; 15: Mannose; 16: Na-CMC; 17: Raffinose; 18: Salixine; 19: Soluble starch; 20: Sucrose; 21: Xylose; 22: Potato dextrose agar (PDA) control. The results are obtained from three replications. a-g: Different letters are significantly different by Duncan’s multiple range test (p<0.05).
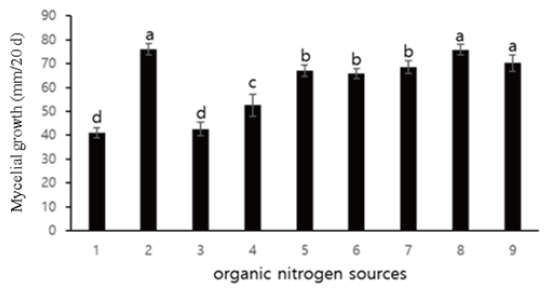
Fig. 5. Effect of organic nitrogen sources for the growth of A. microsporus in medium. 1: Casamino acid; 2: Malt extract; 3: Peptone; 4: Soytone; 5: Tryptone; 6: Urea; 7: Yeast extract; 8: Positive control; 9: Potato dextrose agar (PDA) control. The results are obtained from three replications. a-d: Different letters are significantly different by Duncan’s multiple range test (p<0.05).
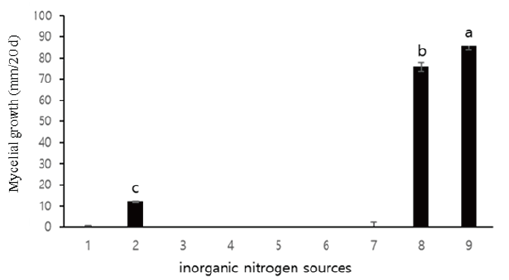
Fig. 6. Effect of inorganic nitrogen sources for the growth of A. microsporus in medium. 1: (NH4)2C2O4; 2: (NH4)2HPO4; 3: (NH4)2SO4; 4: (NH4)H2PO4; 5: C4H12N2O6; 6: NaNO3; 7: NH4NO3; 8: Control; 9: Potato dextrose agar (PDA) control. The results are obtained from three replications. a-c: Different letters are significantly different by Duncan’s multiple range test (p<0.05).
아미노산 선발에 따른 A. microsporus 균사 생육
아미노산 alanine을 포함한 13종에 대한 생육조사 결과를 Fig. 7에 나타내었다. 배양 20일째, asparatic acid 첨가 배지에서 가장 생육이 우수하였으며 최적 농도는 0.1%였다(Fig. 8D). 다른 아미노산 asparagine, leucine, methionine, threoine 등에서는 생육이 저조하거나 이외 균사가 생육하지 못하는 아미노산의 종류가 많았다. asparatic acid, glutamic acid 첨가 배지에서 모두 생육이 왕성하였고 선발된 asparatic acid 1% 이상에서는 생육이 저조해지는 것을 확인할 수 있었다.
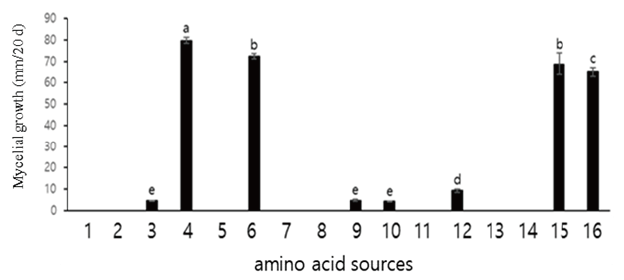
Fig. 7. Effect of amino acid sources for the growth of A. microsporus in medium. 1: Alanine; 2: Arginine; 3: Asparagine; 4: Asparatic acid; 5: Cysteine; 6: Glutamic acid; 7: Glutamine; 8: Histidine; 9: Leucine; 10: Methionine; 11: Proline; 12: Threonine; 13: Tyrosine; 14: Valine; 15: Positive control; 16: Potato dextrose agar (PDA) control. The results are obtained from three replications. a-e: Different letters are significantly different by Duncan’s multiple range test (p<0.05).
유기산의 선발에 따른 A. microsporus 균사 생육
유기산 acetic acid 등 7종에 따른 A. microsporus 균사 생육을 조사한 결과 acetic acid, lactic acid 첨가 배지에서 41.0-43.02 mm로 균사가 생육하였으나 유기산 8종 모두 균사가 생육이 저조하였다. 유기산은 배지 첨가 영양원으로 선발되지 않았다.
무기염류의 선발에 따른 A. microsporus 균사 생육
무기염류로는 AgNO4를 포함한 13종에 따른 A. microsporus 균사 생육을 조사한 결과 무기염류 13종 모두 균사가 생육하지 않았으며, 무기염류는 배지 첨가 영양원으로 선발되지 않았다.
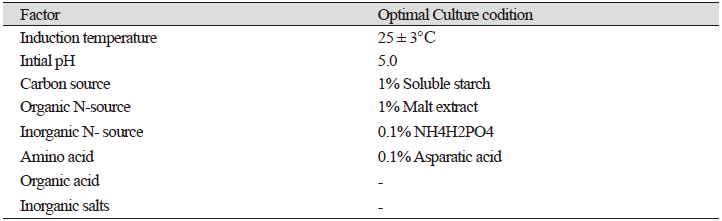
A. microsporus의 안정적 균사체 생육을 위한 최적 조건 확립
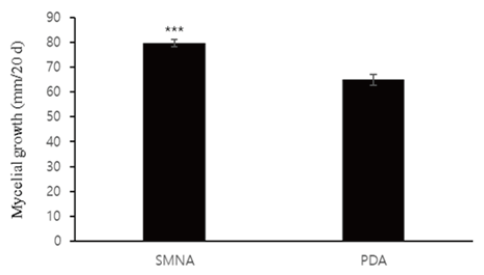
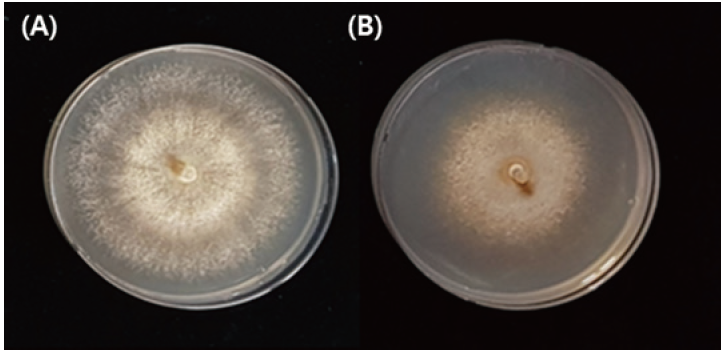
A. microsporus의 안정적인 균사체 생육을 위한 최적 배지 선발 결과를 Table. 1에 나타내었다. A. microsporus의 최적 배양 온도는 25±2℃였으며, pH는 5.0에서 생육이 가장 왕성하였다. 또한 탄소원은 soluble starch 1%, 유기질소원 malt extract 1%, 무기질소원(NH4)2C2O4 0.1%, 아미노산 asparatic acid 0.1% 이 최적 생육 조건이었으며 이 최적 조건 배지를 SMNA (soluble starch 1%, malt extract 1%, (NH4) 2C2O4 0.1%, asparatic acid 0.1%)라고 명명하였다. 이 결과는 PDA 배양 시 20일차에 60.2 mm 생육하는 반면 SMNA는 77.0 mm로 평균 16.8 mm의 생육 속도가 차이가 났으며 PDA 배지의 배양기간과 비교하였을 때 15.1% 단축하는 효과가 있었다. 이는 p 값 0.00016로 유의성 있는 차이를 나타내었다(Fig. 9). SMNA 상에서 A. microsporus 균사체의 생육은 배양기간 동안 안정적이고 균일하게 생육하는 것을 확인하였다(Fig. 10). 또한 SMNA 배지에서 생육 기간을 포함하여 총 30일이 경과되면 자실체가 유도되는 특성을 가지고 있다. 1948년 Brodie [11]의 연구결과에 따르면 A. pyxidatus의 경우 2% malt extract 배지에서 50일 경과 자실체가 발생했다는 연구결과와 비슷한 결과를 나타내었다.
적요
본 연구에서는 A. microsporus의 최적 배양 조건을 구명하고자 하였다. A. microsporus 균사체의 효율적 배양을 위한 조건은 최적 배양 온도 25℃, pH 5.0, 탄소원 soluble starch 1%, 유기질소원 malt extract 1%, 무기질소원 NH4H2PO4 0.1%, 아미노산 asparatic acid 0.1% 조건으로 선발되었고 유기산, 무기염류 첨가 시 균사생육이 저조해지는 영향을 주어 선발되지 않았다. 새로이 SMNA로 명명한 A. microsporus의 최적 배지는 기존의 PDA 배지 상에서 배양한 결과와 비교하였을 때, 균사의 생육이 균일하고 안정적이며 배양 기간을 15.1% 정도 단축하는 효과가 있었다. SMNA 배지는 추후 A. microsporus의 균사체 배양 방법에 널리 활용될 수 있을 것으로 판단된다.