서론
약용식물은 질병 치료, 건강 증진 등에 효과가 있어 약재로 사용가능한 식물로, 지구상에 있는 식물 중 약 50,000종 정도가 사용되고 있으며[1]. 약용작물은 약용식물 중 수요가 많거나 경제성이 있어 재배되는 식물을 의미한다[2]. 한국에서 자생하는 약용식물은 약 900여 종 정도로 추정되는데, 이 가운데 약재나 건강식품으로써 활용가치가 높아 악용작물로써 재배되는 종은 약 60여 종이다[3]. 참당귀(Angelica gigas Nakai)는 잎과 뿌리를 식용 혹은 약재로 사용하는 약용작물로서 중국이나 일본에서 생산되는 중국당귀와 일당귀와는 달리 짙은 자주색의 꽃을 갖는 것이 특징이다[4]. 주로 저온의 해발고도가 높은 곳에서 자라며, 고온에서는 하고현상(summer depression)이나 생육저하 현상이 나타나 재배가 어려운 작물이다[5].
식물 내생균(endophytic fungi)은 식물과 균류의 공생관계 중 하나로서, 기주식물의 모든 조직 내부에 공생한다[6]. 내생균은 식물의 조직에 병증을 일으키지 않는 상태로 살아가며[7], 식물체 내에서 2차 대사산물(secondary metabolite)을 생성 및 분비하여 식물체를 초식동물, 곤충, 외부 병원체(pathogen) 등의 요인으로부터 화학적으로 방어하는 역할을 한다[8,9]. 또한 내생균은 온도, 수분 등의 환경 스트레스에 대한 저항성 역시 식물에게 제공하여 식물의 적응도를 높인다[10]. 이러한 식물과의 관계로 인해 최근 내생균은 원예식물이나 농작물 등의 연구에 많이 이용되고 있다.
본 연구에서는 우리나라의 다양한 지역에서 재배되고 있는 참당귀의 뿌리, 줄기, 잎에 서식하고 있는 내생균을 분리, 동정하여 다양성을 분석하고, 대치배양을 통해 병원균에 대한 길항작용을 보이는 내생균 균주를 선별하고자 하였다.
재료 및 방법
내생균 분리
2020년 경북 영주, 봉화, 영양 총 3개 지역에서 시료를 채취하였다. 밭에서 재배되고 있는 참당귀 개체를 채집하여 24시간 이내에 실험실로 운반하였다. 잎과 줄기는 병증이 없는 건강한 부분을 선별하여 1% NaClO 용액에 1분, 70% EtOH에 2분간 표면살균한 후 potato dextrose agar (PDA) 배지에 치상하였다. 뿌리는 증류수로 씻어 흙을 완전히 제거한 후에 3% NaClO 용액에 3분, 70% EtOH에 1분간 차례로 처리하여 표면살균하였고, 100 μg/mL 농도의 streptomycin 용액에 10분간 처리한 뒤 멸균수로 3회 씻어주었다[11]. 표면살균된 뿌리는 filter paper를 이용하여 물기를 완전히 제거한 뒤 0.5 cm 길이로 잘라 water agar (WA) 배지의 네 곳에 치상하였다. 25℃에서 배양하면서 관찰하여 균사가 뻗어 나오는 것이 확인되면 PDA배지로 계대배양하였으며, 순수 분리된 균주는 해부현미경 및 광학현미경으로 형태적 특성을 관찰하였다.
병원균 분리
참당귀 잎에 발병한 점무늬병(leaf spot)의 병변 조직을 떼어 해부현미경 및 광학현미경으로 분생포자(conidia)의 발생을 관찰한 뒤, 병반조직을 1% NaClO 용액에 1분, 70% EtOH에 2분간 표면살균하여 PDA 배지에 치상하고 25℃에서 배양하여 병원균 균주를 분리하였다.
분리된 균주의 분자생물학적 동정
분리된 내생균 및 병원균의 균사에서 DNeasy plant mini kit (Qiagen, Germantown, MD, USA)을 이용하여 DNA를 추출한 뒤, rDNA의 5.8S 영역을 포함하는 internal transcribed spacer (ITS)영역을 균류 특이적 primer인 ITS1F와 ITS4를 이용하여 증폭하였다[12]. PCR이 끝난 DNA는 1.5% agarose gel에 20분간 전기영동하여 각각 DNA 단편의 크기를 확인한 후 염기서열 분석을 의뢰하였다(SolGent, Daejeon, Korea). DNA 염기서열은 미국 국립생물정보센터(NCBI) 상에서 BLAST하여 유사도를 확인하여 동정하였다.
내생균-병원균 대치배양
약용작물에서 분리된 전체 내생균 균주를 병원균 균주 Y11과 대치배양(dual culture)하였다. 대치배양에는 PDA 배지를 사용하였고, 6.5 mm 직경의 cork borer를 이용해 내생균과 병원균 균총을 각각 취하여 PDA 배지의 양쪽 끝에 계대하였다. 7일간 25℃에서 배양하면서 내생균과 병원균 균총 간의 상호작용을 관찰하였다. 7일 후 두 균총 간의 거리 및 병원균 균총의 직경을 측정하여 병원균 단독 배양체와 비교하였다. 병원균에 대한 내생균의 영향력 지수(I)는 내생균이 병원균의 생장에 대해 보이는 억제 효과를 공식으로 나타낸 것으로서, 다음과 같은 과정을 통해 도출하였다[13].
내생균 영향력 지수(I) = (병원균 단독배양면적 - 대치배양시 병원균의 면적) / 병원균 단독배양면적
결과 및 고찰
내생균의 다양성
참당귀의 잎, 줄기, 뿌리에서 총 76균주를 분리하였으며 분리한 내생균의 형태적, 분자계통학적 분석 결과 총 23속 35종을 동정하였다. 이 중 잎에서는 10속 20종, 줄기에서는 9속 11종, 뿌리에서는 6속 7종의 내생균이 분리되었다.
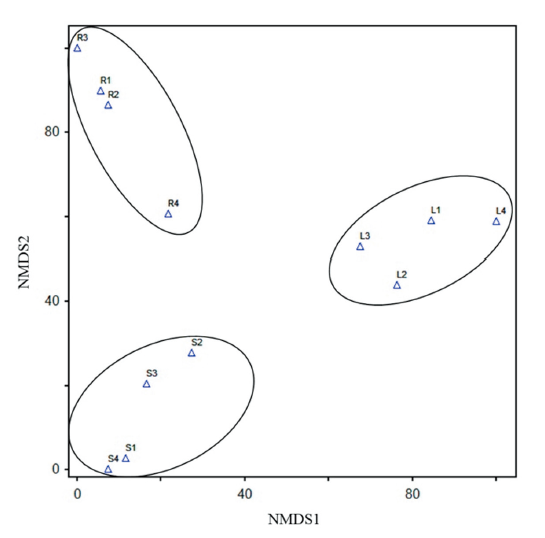
Alternaria alternata, A. brassicola, Didymella glomerata의 3종은 잎과 줄기에서 모두 분리되었으나 뿌리에서는 확인되지 않았고, 이 3종을 제외한 나머지 내생균들은 잎, 줄기, 뿌리에서 각각 다른 종 구성을 보였다. 잎에서는 A. alternata가 27%로 가장 높은 상대수도를 보였고, 줄기에서는 A. brassicola가 25%로 가장 높은 상대수도를 보였으며, A. alternata 역시 19%로 높은 비율을 차지했다. 잎과 줄기에서 공통적으로 분리된 3종 가운데 A. alternata는 잎에서 더 높은 상대수도를, A. brassica는 줄기에서 더 높은 상대수도를 보였고 D. glomerata는 줄기에서 더 높은 상대수도를 보였다. 뿌리에서는 Macrophomina phaseolina가 35%로 가장 높은 상대수도로 분리되었다(Table 1). 종 다양성 지수로써 Shannon’s index, 종 균등도(species evenness), 종 풍부도(species richness)를 도출하여 참당귀 조직 부위별로 통계분석한 결과, Shannon’s index와 종 수가 잎 > 줄기 > 뿌리 순으로 유의미하게(p<005) 나타났다. 종 균등도에서는 유의미한 차이가 존재하지 않았다(Table 1). 또한 각 부위의 내생균 군집은 ordination 상에서 서로 가까이 위치하는 것을 확인할 수 있었다(Fig. 1). 이러한 결과로 판단해볼 때, 분리한 조직부위에 따라 서식하는 내생균 군집의 종 구성이 다르며, 종 다양성 역시 부위에 따른 차이를 보인다고 할 수 있다. 실제로 식물조직의 부위에 따라 내생균의 종 수도나 다양성이 다르게 나타난다는 선행 연구 결과가 존재한다[14,15].
Table 1. Relative abundance (mean±standard error) of endophytic fungi isolated in this study, according to the tissue of Angelica gigas.
|
|
*The p value was lower than 0.05. |
병원균의 분리 및 동정
Phoma sp. Y11 균주는 영주 참당귀 잎의 점무늬병이 발병한 부위에서 분리하였으며(Fig. 2A), 병증 부위에 투명한 원통형의 분생포자(conidia)를 형성하는 것을 관찰하였다(Fig. 2B). PDA배지에 7일간 단독 배양 시 균총의 직경은 약 42 mm 정도이고, 균총의 색은 앞면은 주로 군청색을 띠나 가장자리에 흰색의 띠가 분포한다(Fig. 2C). 뒷면은 중앙부에서는 군청색을 띠며 가장자리는 붉은 빛이 도는 상아색 혹은 베이지색이다(Fig. 2D). 분생자의 형태적 특성 및 분자생물학적 분석을 통해 동정한 결과, 우리나라 참당귀 잎에 점무늬병을 유발하는 병원체로 보고된 Phoma sp. KACC 42406 (GenBank accession No. EF600958.1) 균주와 100%의 유사도를 보였다.
내생균-병원균 대치배양
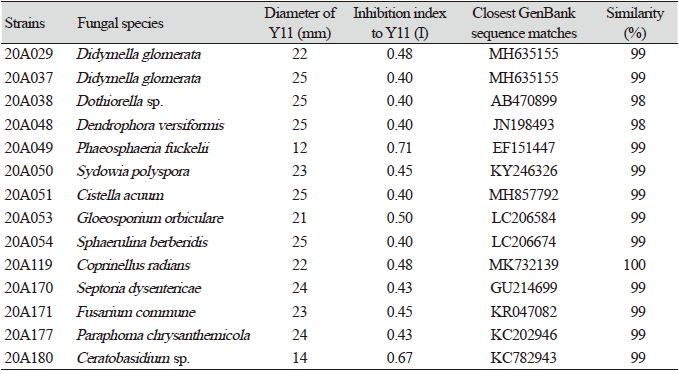
참당귀에서 분리된 76균주의 내생균을 참당귀 점무늬병 균주 Y11과 대치배양한 결과, 14균주의 내생균이 대치배양 시에 병원균의 생장직경을 25 mm 이하로 제한했으며 병원균에 대한 영향력 지수(I)가 0.4 이상이었다(Table 2). 특히 Phaeosphaeria fuckelii 20A049, Gloeosporium orbiculare 20A053, Ceratobasidium sp. 20A180 3균주는 병원균에 대한 영향력 지수(I)가 0.5 이상인 것을 확인할 수 있었다.
P. fuckelii 20A049 균주는 영주의 참당귀 줄기에서 분리되었다. 이 종은 중국의 약용작물인 Phlomis umbrosa 잎에서 내생균으로 분리된 기록이 존재하며, 멜라닌 생성 장애를 억제하는 alkaroid를 분비하는 것으로 보고된 바 있다[16]. G. orbiculare 20A053 균주는 영주의 참당귀 줄기에서 분리되었다. G. orbiculare는 이전에 Colletotrichum orbiculare로 보고되어 있었으며 오이 탄저병균으로 알려져 있으나[15], 본 연구에서는 내생균으로 분리되었다. Gleosporium 속은 열대의 mangrove에서 주로 내생균으로 분리되며, 항암작용을 하는 물질을 분비하는 종들이 존재한다[17]. Ceratobasidium sp. 20A180 균주는 영주의 참당귀 뿌리에서 분리되었다. Ceratobasidium에 속하는 종들 중에는 식물 뿌리와 공생하여 균근을 형성하는 종들이 있으며[19], 식물에 접종 시 식물의 생육을 촉진하고 병원균에 대한 저항성을 제공한다는 연구 결과 또한 존재한다[20]. Ceratobasidium 속에 속하는 균은 난초과 식물의 뿌리에서 주로 많이 분리되며, 우리나라에서는 이 속에 포함된 종이 강원도 정선 함백산의 금난초 (Cephalanthera falcata [Thunb.] Blume)에서 분리된 기록이 존재한다[21].
약용작물은 재배 과정에서 나타나는 각종 병충해로 인해 작물을 건강하게 재배하는 것이 쉽지 않다. 이와 같은 병해를 사전에 예방하거나 병해에 저항성을 갖게 하는 것이 약용작물의 재배에 매우 중요하다. 전통적으로는 농업에서 빠른 효과를 보이며 투입 비용이 적은 화학 방제법이 주로 사용되어 왔으나[22], 2019년부터 잔류농약 허용물질목록 관리제도(positive list system, PLS)가 전면 시행됨에 따라[23], 농업에서 생물학적 방제가 중요한 연구 주제가 되었다. 이러한 상황에서 내생균을 이용한 병원균의 억제는 약용작물의 재배에 매우 효율적인 생물학적 방제법이 될 수 있다. 대치배양에서 효과를 보이는 내생균들을 실제로 약용작물에 접종하여 효과를 확인할 수 있다면 이러한 방제법을 실질적으로 적용하는 데 도움이 될 것으로 생각된다.
적요
다양한 지역에서 채취한 참당귀(Angelica gigas Nakai)의 잎, 줄기, 뿌리에서 내생균을 분리하였다. 내생균 균주는 형태적특징과 ITS (internal transcribed spacer) 지역의 염기서열을 이용하여 동정하였다. 총 35종의 내생균이 동정되었다. 내생균의 다양성은 참당귀의 조직에 따라 다르게 나타났다. 분리된 내생균은 참당귀 점무늬병균 Phoma sp. Y11 균주와 대치배양하여 항균활성을 측정하였다. 총 14종의 내생균이 균주 Y11에 대해 억제효과를 나타내었다. 본 연구는 참당귀에서 분리한 내생균이 참당귀의 점무늬병에 대한 생물학적 방제제로 사용될 수 있다는 것을 제시하고 있다.