서론
최근, 국민들의 건강에 대한 관심이 크게 증가하고 특히 장내 유익균만의 대량 분포를 위해 프로바이오틱스를 복용하거나, 장 건강을 증진시키는 새로운 생리기능성 물질의 개발 등의 다양한 연구가 진행되고 있다[1-3]. 대체로 장내 유해세균들은 β-glucosidase, β-glucuronidase, tryptophanase, azoreductase, nitroreductase 등의 활성이 높아지면 아민류, 독성물질, 변이원 등을 생성하고, 이들이 장점막에 손상을 주어 대장암을 일으키거나, 장관내로 흡수된 유독 물질들이 체내를 순환하면서 암 유발, 면역기능 저하 등의 다양한 질병의 원인이 된다[4].
β-Glucuronidase (EC 3.2.1.31)는 glucuronic acid의 β-1탄소에 비당체가 결합한 glucuronide unit를 가수분해하는 효소로 다양한 미생물[5]에서 생성되고 동물에서는 주로 간장과 신장에 분포하고 있다. 이 효소는 간에서 benzopyrene 등의 발암물질이 glucuronic acid conjugate로 무독화 되어 장으로 보내졌을 때 이 결합을 끊어 발암성을 나타나게 한다[6]. N-Hydroxy-N-2-fluorenylacetamide와 diethylstilbesterol을 포함한 많은 발암 물질은 장에 결합된 glucuronide의 가수 분해에 의해 활성화된다. Xenobiotics는 살아있는 생명체에 이질적인 분자로 해독 과정에서 간에서 UDP-D-glucuronic acid와 결합되며 다시 β-D-glucuronide는 소장과 신장을 통해 배설된다. 그러나 소장의 β-glucuronidase는 이들 접합체를 가수 분해하고 탈리된 xenobiotics는 소장 벽을 통해 흡수되어 간으로 되돌아간다. β-glucuronidase는 최종 대사 산물로 소변과 대변을 통해 배설되기 때문에 xenobiotics의 배설에 중요한 역할을 하는 것으로 알려져 있다. 장내 세균에 의해 생성된 β-glucuronidase는 glucuronide를 가수 분해하여 장내 독성을 띠며 재 흡수를 통해 xenobiotics의 배설율을 감소시킨다[7].
따라서 대장암 발병을 억제하기위한 방법의 일환으로 대장에서의 발암원을 생성하는 β-glucuronidase에 대한 저해물질의 개발과 β-glucuronidase가 장내의 높은 pH에 의해 유도되므로 장내 pH를 낮추어 이 효소 활성을 저하시키는 방법 등이 알려져 있다.
그러나, 지금까지 β-glucuronidase 저해물질 생산연구는 한방식품[4], 버섯[8], 뽕나무 등의 flavonoid류[9,10]와 해조류[7] 등에서 β-glucuronidase 저해활성이 보고되어 있을 뿐 이들 저해물질의 대량생산을 위한 체계적인 생산조건의 최적화 연구 등은 실시되지 않았다.
따라서 본 연구에서는 대부분이 비병원성이면서 배양이 용이하고 각종 유용 대사산물들을 많이 생산하는 것으로 알려진 효모로부터[11-21] 대장암 발병 억제를 위한 β-glucuronidase 저해물질을 생산하여 이를 의약이나 건강소재산업에 응용하고자 실시되었다. 먼저 대전광역시 월평공원 주변의 토양 등으로부터 분리된 야생 효모들 중 비병원성 효모들을 선별하여 이들의 β-glucuronidase 저해 활성을 측정하여 우수 야생 효모를 선발하였다. 또한 이들의 β-glucuronidase 저해물질의 생산 조건을 검토하였고 한외여과와 Sephadex G-50 여과 등으로 β-glucuronidase저해물질을 부분 정제하여 몇 가지 특성을 조사하였다.
재료 및 방법
야생 효모와 배지 및 시약
실험에 사용한 야생 효모들은 필자 등이 대전광역시 월평공원에서 분리, 동정하여 보관중인 133균주들 중 전보[22]와 같이 비병원성 효모들만 선별하여 사용하였다. 배지로는 Becton and Dickinson 사(BD Difco, Sparks, MD, USA) 제품의 yeast extract-peptone-dextrose (YPD), yeast extract-malt extract (YM), potato dextrose (PD) 등을 사용하였다. β-glucuronidase 저해활성 측정에는 Sigma 사(St. Louis, Mo, USA)제품의 β-glucuronidase (대장균 생산)와 ρ-nitrophenyl-D-glucuronide를 사용하였다. 기타, 완충용액 제조 등에는 분석용 특급 시약들을 사용하였다.
배양 상등액과 무세포 추출물들의 β-glucuronidase 저해활성 측정
비병원성 야생 효모들을 YPD 배지에 접종하여 30℃에서 48시간 배양한 후 8,000 rpm으로 20분간 원심분리하여 배양 상등액과 균체물들을 얻었다. 균체물들을 다시 0.1 M Tris-HCl완충용액(pH 8.3)에 현탁 시킨 후 초음파 균체파쇄기(Vibra Cell; Sonics & Materials, Newtown, CT, USA)로 파쇄하고 12,000 rpm으로 20분간 원심 분리하여 얻은 상등액을 무세포 추출물을 제조하였고 아래와 같이 이들 배양 상등액과 무세포 추출물들의 β-glucuronidase 저해활성을 측정하였다[4,7].
β-Glucuronidase 저해활성은 위와 같이 제조한 야생효모 무세포 추출물과 세포배양 상등액[16] 시료 각각 100 μL에 0.1M 인산완충용액 (pH 7.0) 280 μL와 10 mM ρ-nitrophenyl-D-glucuronide 20 μL, β-glucuronidase (0.4 unit/mL) 100 μL를 혼합 후 37℃에서 30분간 반응시켰다. 여기에 0.25N NaOH 500 μL를 가하여 반응을 정지시킨 후 원심분리(2,000 rpm, 10 min)하여 얻은 상등액의 흡광도를 405 nm에서 측정하여 다음과 같이 저해활성을 계산하였다[4].
β-Glucuronidase 저해활성 (%)=[{C-(T-B)}/C]×100
(C, 대조구의 흡광도; T, 시료구의 흡광도; B, 시료구의 blank의 흡광도)
β-Glucuronidase 저해물질의 부분정제 및 특성
β-Glucuronidase 저해물질의 산업적 응용성을 검토하기 위하여 아래와 같이 부분 정제하여 작용온도와 pH 및 이들의 안정성 등을 조사하였다. 먼저 선발된 효모의 무세포추출물에 각각 1% (w/v) protease E (55℃), pepsin (37℃), trypsin (25℃), α-amylase, β-amylase (37℃)를 첨가하여 각각 반응시킨 후[23] β-glucuronidase 저해활성을 측정하였다. 효소 처리 후 얻은 활성 가수분해물을 3 kDa부터 30 kDa 이하까지 한외여과(Amicon Ultra, Millpore, Carrigtwohill Co., Cork, Ireland)를 실시한 후 각 분획별로 β-glucuronidase 저해활성을 측정하였다. 한외여과액 중 β-glucuronidase 저해활성이 우수한 분획물을 모아 Sephadex G-50 컬럼에서 0.5 mL/min의 유속으로 2 mL씩 분취한 후 각각에 대하여 280 nm와 β-glucuronidase 저해활성을 측정하여 얻은 활성 분획들을 최종 부분 정제물로 하였다.
위와 같이 얻은 부분정제물의 저해 작용 최적 온도와 pH를 조사하기 위하여 부분정제물을 20-70℃에서 작용 최적 온도를 조사하였고 부분정제물질들을 pH 4.0-pH 9.0까지 각각의 pH의 완충용액에 녹인 다음 이들의 최적 작용 pH를 조사하였다. 또한 이들 온도와 pH에서 30분씩 각각 처리한 후 잔존 저해활성을 측정하여 열과 pH 안정성을 조사하였다. 또한 Mg2+ 등의 각종 중금속이온들과 포도당 등 당류들에 저해활성에 미치는 영향을 조사하기 위해 이들을 농도별로 처리하여 위와 같이 잔존 β-glucuronidase 저해활성을 측정하였다.
통계분석
모든 시료의 분석은 3번 반복 수행되었다. Microsoft Office Excel 2007 program (Microsoft, Seattle, WA, USA)을 사용하여 Mean±SD 값으로 표시하였고, 각 그룹 간의 유의성을 검증하기 위하여 one-way ANOVA 분석으로 p<0.02 수준에서 유의성을 검증하였다[24,25].
결과 및 고찰
β-Glucuronidase 저해활성 우수 균주의 선발
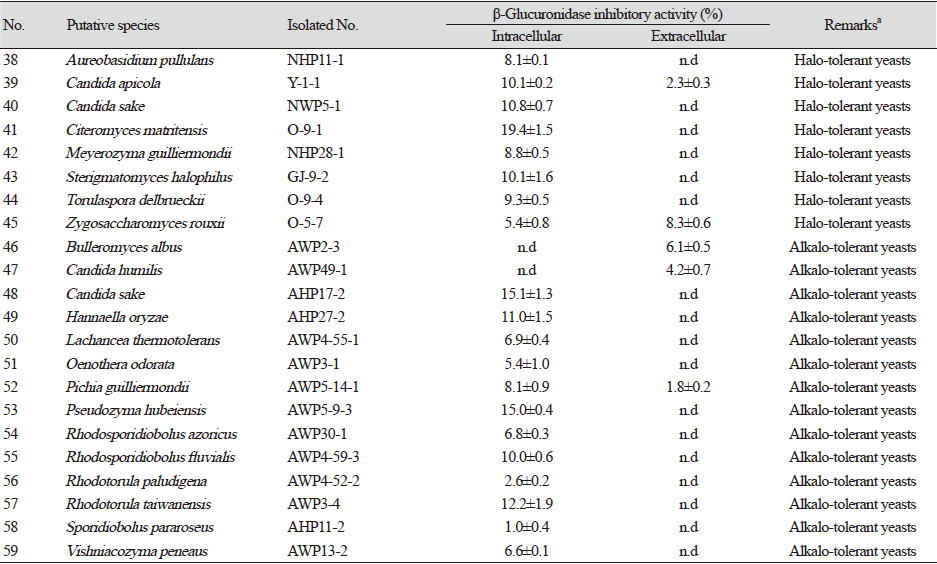
대전광역시 월평공원 내원사와 연자산, 갑천 누리길 등으로부터 분리한 야생효모 133균주들 중 선별된 비병원성 야생효모 125균주들의 배양 상등액과 이들의 무세포 추출물들에 대하여 β-glucuronidase 저해활성을 측정한 결과 59균주들이 저해활성을 보였다(Table 1).
Table 1. β-Glucuronidase inhibitory activities of non-pathogenic wild yeasts from in Wolpyeong park in Daejeon city, Korea.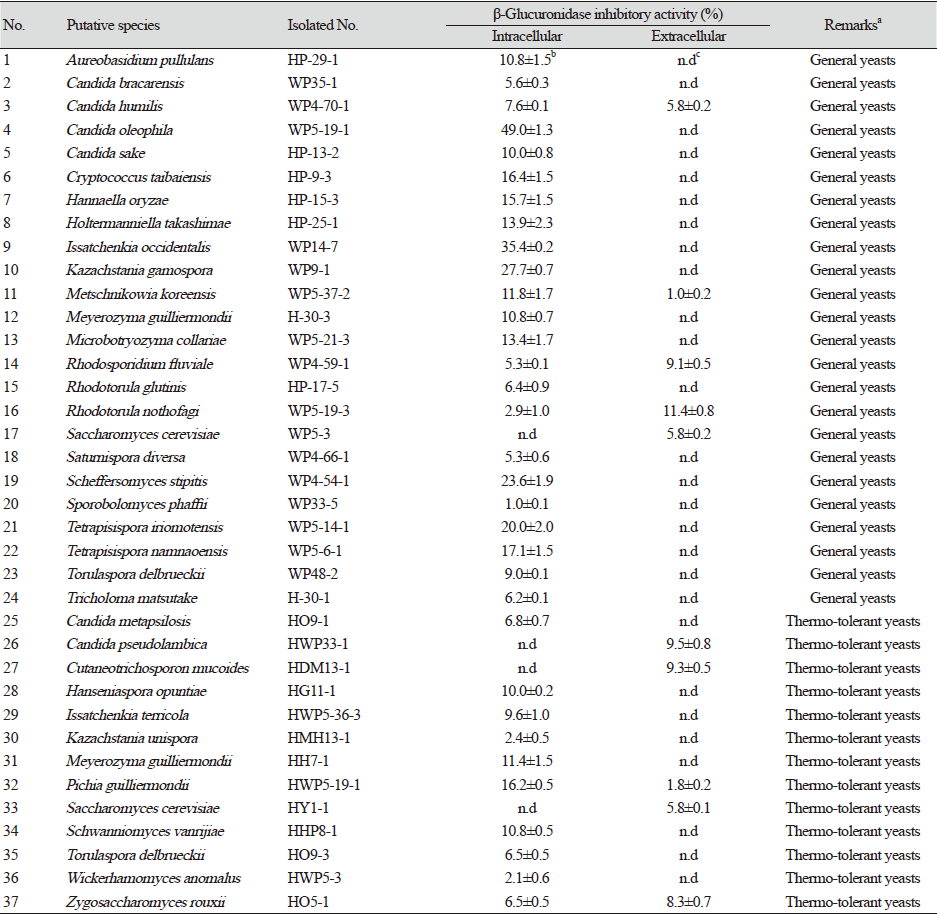
|
이들 중 Candida oleophila WP5-19-1 균주의 무세포 추출물의 β-glucuronidase 저해활성이 49.0%로 가장 높았고, Issatchenkia occidentalis WP14-7 균주의 β-glucuronidase 저해활성도 35.4%를 보였다. 또한, Kazachstania gamospora WP9-1 균주의 무세포 추출물이 27.7%, Scheffersomyces stipites WP4-54-1 균주가 23.6%를 보였으나 나머지 균주들을 대부분 15% 미만이었다. 따라서 β-glucuronidase 저해활성이 가장 높았던 C. oleophila WP5-19-1를 우수 균주로 최종 선발하였다.
현재 β-glucuronidase 저해물질 연구로서 Weng [9]등은 scutellarein, luteolin, baicalein, quercetin을 포함한 일부 flavonoid가 IC50 5.76 µM에서 IC50 29.64 µM의 강한 억제효과를 나타냄을 보고하였고 Bai [10] 등은 뽕나무 껍질에서 분리된 플라보노이드에서 IC50이 1.12 µM에서 10.63 µM 범위의 저해 활성으로 β-glucuronidase를 저해하였음을 보고하였으며 Kim 등[7]은 Grateloupia elliptica에서 β-glucuronidase를 IC50 5.4 mg/mL와 8.5 mg/mL로 저해하는 두 가지 bromophenol을 보고하였다.
Candida oleophila WP5-19-1의 β-glucuronidase 저해물질 생산
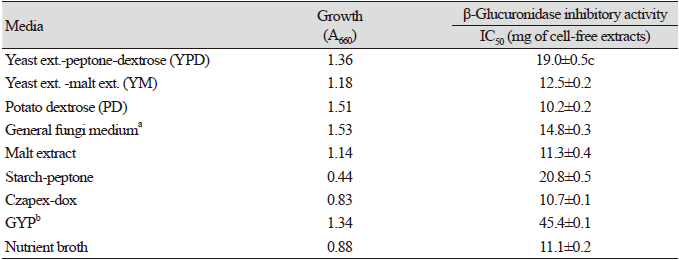
배지와 dextrose의 영향: β-Glucuronidase 저해물질 생산 우수 균주로 최종 선발한 C. oleophila WP5-19-1를 각종 미생물 배지에 접종한 후 30℃에서 48시간 배양한 후 균 생육과 β-glucuronidase 저해활성을 측정하였다(Table 2). 균 생육은 starch peptone 배지 외에 대부분의 배지에서 양호하였으나 β-glucuronidase 저해활성은 PD 배지에서 배양하여 얻은 무세포 추출물이 IC50값 10.2 mg으로 가장 높은 저해활성을 보였다.
β-Glucuronidase 저해활성이 우수하였던 PD배지에서의 dextrose와 yeast extract의 영향을 조사하기위해 1% yeast extract를 첨가한 PD배지와 첨가하지 않은 PD배지에 dextrose를 PD배지 총 함량으로 1-10%까지 일정 농도로 첨가하여 각각 배양 후 생육도와 β-glucuronidase 저해활성을 측정하였다. 균 생육은 dextrose 1-10% 농도 간에 큰 차이 없이 A660 1.1-1.5를 보였으나 β-glucuronidase 저해활성은 dextrose 5% 첨가한 PD배지에서 배양하였을 때 IC50값 8.9 mg으로 가장 높은 저해활성을 보였고 2%를 첨가하였을 때 IC50 9.4 mg의 저해활성을 보여 dextrose 5% 첨가가 β-glucuronidase 저해물질 생산이 가장 좋은 농도였다(data not shown). 또한 5% dextrose를 함유한 PD배지에 yeast extract 1% 첨가하여 배양하였을 때 β-glucuronidase 저해활성은 IC50값 13.1 mg로 오히려 낮아졌다.
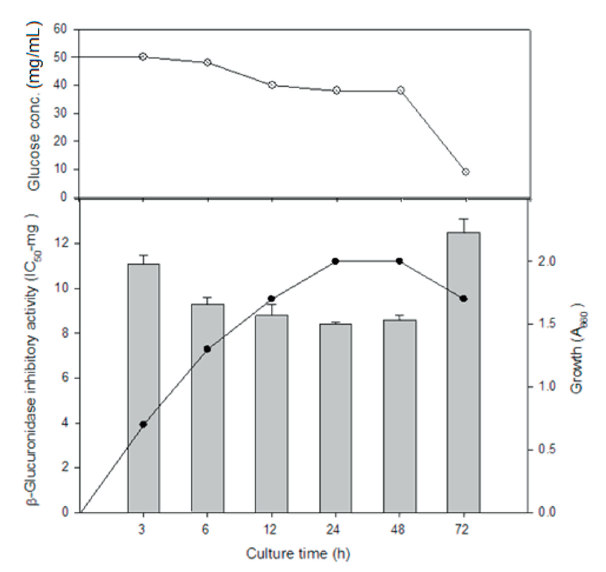
배양 시간의 영향: C. oleophila WP5-19-1를 PD 배지에 접종하여 30℃에서 72시간까지 배양하면서 이들의 균 생육과 β-glucuronidase 저해활성을 측정한 결과는 Fig. 1과 같다. 균 생육은 12시간에 대수기 중기를 거쳐 24시간에 정지기에 도달하였고 β-glucuronidase 저해활성은 대수기 말기와 정지기인 24시간과 48시간 배양해서 얻은 무세포 추출물에서 각각 IC50 8.4 mg, IC50 8.5 mg으로 가장 높았다. 또한 배양 24시간 마다 두 번 dextrose를 초기 농도로 공급하여 72시간까지 유가식으로 배양하였을 때 β-glucuronidase 저해활성은 24시간 회분식 배양에서의 저해활성 IC50 8.4 mg과 비슷하게 유지되었다(data not shown). 따라서, 배양 48시간 이후 저해활성이 급격히 감소된 회분식 배양보다는 저해물질 생산이 72시간까지 지속되는 유가식 배양이 대량생산에 유리할 것으로 사료된다.
β-Glucuronidase 저해물질의 부분 정제 및 특성
부분 정제; C. oleophila WP5-19-1 균주가 생산하는 β-glucuronidase 저해물질을 부분 정제하기 위하여 먼저 선발 균주의 무세포 추출물에 대하여 각종 protease와 amylase를 처리한 후 얻은 가수 분해물 등의 β-glucuronidase 저해활성을 측정하였다. Trypsin 처리시 β-glucuronidase 상대 저해활성이 127.9%로 무처리 대조구(100%)에 비하여 약 27% 이상 저해활성이 높아졌다. Protease E를 처리했을 때는 106.6%로 활성에 변화가 없었고 pepsin을 처리했을 때 오히려 무처리 대조구에 비하여 약 15% 저해활성이 감소되었다. 또한, α-amylase와 β-amylase를 처리했을 때 각각 103.3, 99.1%로 저해활성에 거의 변화가 없었다.
C. oleophila WP5-19-1의 무세포 추출물을 trypsin으로 가수분해 시킨 다음 한외여과 장치로 3 kDa 이하, 3-30 kDa, 30 kDa 이상으로 각각 한외여과를 실시한 후 이들의 저해활성을 측정한 결과 3 kDa 이하의 여과액이 47.1%의 가장 높은 β-glucuronidase 저해활성을 보였다. 한외여과하여 얻은 분자량 3 kDa 이하의 활성 분획을 Sephadex G-50 column을 이용하여 gel 여과를 실시한 결과 43-55번 여과액이 단일 peak를 보였고 45.3%의 β-glucuronidase 저해활성을 보여 부분 정제물로 하였다.
부분 정제물질의 특성; 부분 정제된 β-glucuronidase 저해물질의 작용 최적 온도와 온도(열) 안정성을 조사한 결과 부분 정제한 β-glucuronidase 저해제는 37℃에서 가장 잘 작용하였고 30℃와 45℃에서 30분씩 처리하였을 때 90% 이상의 비교적 높은 저해활성을 보였고 30℃에서 60℃까지 안정하였다(Fig. 2). 부분 정제한 β-glucuronidase 저해물질의 작용 최적 pH는 7.0이었고 pH 6.0-9.0에서 80%이상의 잔존 저해활성을 보여 안정하였다.
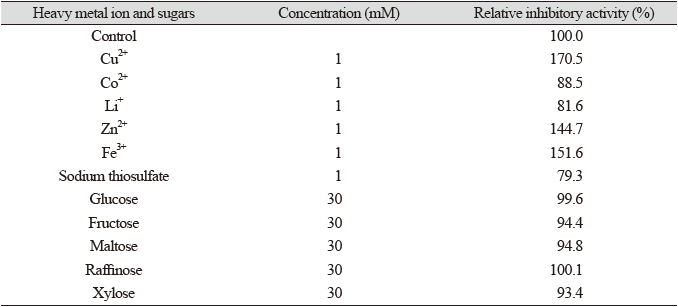
부분 정제한 β-glucuronidase 저해물질의 중금속이온들과 당류 등에 대한 안정성을 조사한 결과 Table 3과 같이 Cu2+, Zn2+, Fe3+ 등은 저해활성을 증가시켜 저해물질들을 활성화시켰으나 Li+과 Co2+ 이온 등은 저해활성을 감소시켰다. 당들은 저해물질들의 내성에 큰 영향을 주지 않았다.

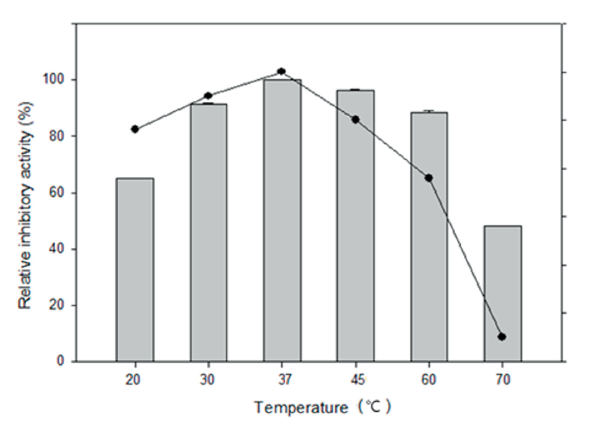
 ) and heat stability(
) and heat stability( ) of partial purified β-glucuronidase inhibitor from Candida oleophila WP5-19-1. Relative inhibitory activity
on stability was determined after treated for 30 min at each temperature.
) of partial purified β-glucuronidase inhibitor from Candida oleophila WP5-19-1. Relative inhibitory activity
on stability was determined after treated for 30 min at each temperature.