Yoosun Oh, Wonsu Cheon, Jaeduk Goh, Chang Soo Lee, and Hye Yeon Mun*
Fungi Research Division, Nakdonggang National Institute of Biological Resources, Sangju 37242, Korea
*Correspondence to outcastm@nnibr.re.kr
Korean Journal of Mycology (Kor J Mycol) 2024 December, Volume 52, Issue 4, pages 239-245.
https://doi.org/10.4489/kjm.520402
Received on September 02, 2024, Revised on November 20, 2024, Accepted on November 20, 2024, Published on Dec 30, 2024.
Copyright © The Korean Society of Mycology.
This is an Open Access article which is freely available under the Creative Commons Attribution-NonCommercial 4.0 International License (CC BY-NC) (https://creativecommons.org/licenses/by-nc/4.0/).
This study investigated the identification and physiological characteristics of four previously unrecorded Cadophora species in freshwater environments in Korea. Samples were collected from plant litter in streams and filtered freshwater. Fungal isolates NNIBRFG31097 (FBCC-F1434) and NNIBRFG6052 (FBCC-F3780) were obtained from plant litter, while NNIBRFG33135 (FBCC-F1694) and NNIBRFG27355 (FBCC-F1462) were isolated from filtered freshwater. Using internal transcribed spacer region (ITS) and large subunit ribosomal RNA gene (LSU) analysis, the four Cadophora strains were identified: C. constrictospora NNIBRFG31097, C. fallopiae NNIBRFG6052, C. fastigiata NNIBRFG33135, and C. luteoolivacea NNIBRFG27355. Physiological studies were conducted to evaluate their industrial applicability, including assessments of antimicrobial activity, siderophore production, and enzyme activity. This study contributes to the understanding of the diversity of Cadophora species in Korean freshwater environments by investigating their physiological characteristics.
Freshwater fungi, Cadophora, Korea
Cadophora 속은 1927년에 Lagerberg와 Melin에 의해 최초 보고되었으며 현재까지 56종이 분리되어 보고되었다. C. fastigiata Lagerb. & Melin이 대표종으로 이 속은 독립적인 분생포자원세포 (phialide)를 형성하는 특징을 가진다[1]. 대부분의 Cadophora 속은 주로 토양과 식물에서 분리되며, 이들은 식물 병원체 또는 부식균으로 상호작용한다고 알려져 있다[2]. 또한 극한 환경에서 토양과 부패된 나무에서 분리되기도 하며 특히 C. luteo-olivacea와 C. fastigiata는 남극의 목재 오두막에서 부패를 일으킨 사례가 보고되었으며[3], 다양한 식물의 병원체 또는 내생균으로 발견되고 있다[4,5]. C. constrictospora는 2020년에 불가리아에서 식물 내생균으로 분리되었고[6], C. fallopiae는 Crous & Akulov에 의해 2020년에 폴란드의 마디목과 식물에서 분리되어 최초 보고되었다[7].
본 연구에서는 국내 담수 환경에서 물과 식물체를 채집하여 균류를 분리 및 동정하였고 이들 중 국내 미기록 Cadophora속 4종을 선별하여 종 특성을 알아보았다.
담수균류를 분리하기 위하여 경상북도 문경시 진곡저수지와 광주광역시 풍영정천의 담수시료를 50mL 채취하여 조사 현장에서 핸드펌프와 nitrocellulose membrane filter (pore size 0.45 ㎛ MCE membrane, MF-MiliporeTM, Burlington, MA, USA)를 이용하여 여과하였다. 필터의 시료가 여과된 면을 streptomycin 100ppm이 첨가된 water agar (WA, 20 g/L, agar)에 부착하여 15℃에서 1일간 배양 후 membrane filter를 제거하고 실체현미경을 이용하여 발아한 포자를 배지에서 분리하여 V8 agar배지 (V8A; 8% V8 juice [v/v] and 1.5% agar [w/v] adjusted to pH 6.0 using 10 N NaOH)에 배양하였다. 전라북도 진안군 용담호와 강원도 원주시 용화사의 담수환경에서 채집한 담수침전식물체는 여과한 현장수에 넣고 20℃에서 2일동안 150 rpm으로 진탕배양한 후, 배양액 100 µL를 WA에 도말하여 2일동안 15℃에서 배양하였다. 배양된 배지에서 단포자 분리를 통해 균류를 V8A 배지에 순수분리 하였다. 분리된 균류의 균체 확보를 위하여 potato dextrose agar (PDA; 3.9% potato dextrose agar powder [w/v]; Difco, Sparks, MD, USA)배지에 계대배양 하였다.
생육환경에 따른 특성을 조사하기 위하여 corn meal dextrose agar (CMDA; 2% cornmeal [w/v], 2% glucose [w/v] and 2% agar), malt extract agar (MEA; 2% malt extract [w/v] and 2% agar [w/v]), oatmeal agar powder (OA; 7.25% oatmeal agar powder [w/v]; Difco, Sparks, MD, USA), V8A, yeast extract peptone dextrose agar (YPDA; 1% yeast extract [w/v], 2% peptone [w/v], 2% glucose [w/v] and 1.5% agar; SigmaAldrich, Darmstadt, Germany), PDA 등 6가지 배지 종류를 실험에 사용하였다. 분리된 균류의 포자 관찰 및 화상자료 확보를 위하여 광학현미경 (H550S, Nikon, Tokyo, Japan)을 이용하였다.
분리된 균류의 동정을 위하여 ITS5 (5’-GGAAGTAAAAGTCGTAACAAGG-3’)/ ITS4 (5’-TCCTCCGCTTATTGATATGC-3’) primer를 이용하여 ITS 부위의 염기서열과 LR0R (5’-ACCCGCTGAACTTAAGC-3’)/ LR7 (5’-TACTACCACCAAGATCT-3’) primer를 이용한 LSU의 염기서열를 이용하여 NCBI의 BLAST를 사용하여 데이터베이스에 등록되어 있는 균류들과 상동성을 비교하였으며 MEGA 11을 이용하여 계통수를 작성하였다[8].
이들 국내 미기록종의 산업적 활용에 대해 조사하기 위해 기초적인 활성인 항균활성, 사이드로포어생성능, 효소활성을 검정하였다. 항균활성 검정을 위해 시들음병원균(Fusarium oxysporum, F. solani), 탄저병원균(Colletotrichum gloeosporioides), 고추역병균(Phytophthora capsici)과 실험균주의 아가플러그(6mm)를 PDA 배지에 대치배양하였다. 사이드로포어 측정을 위해 chrome azurol S(CAS, PIPES 30.24g/L, 1.5% agar, pH 6.8 with 6M KOH, 10% blue dye solution: CAS 2mM, FeCl3-6H2O 1mM, HDTMA(CTAB) 5mM) 배지와 배양된 실험균주를 맞대어 활성이 나타나는지 확인하였다. 아밀라아제와 글리코시다아제 활성 검정을 위해 각각 Insoluble chromogenic substrates(AZCL-Amylose 0.5 g/L, xanthan gum 3.0 g/L,1.5% agar), Esculin Iron Agar(EIA, esculin 1g/L, ferric ammonium citrate 0.5g/L, agar 20g/L) 배지를 사용하였다.
형태 및 배양 특성: PDA 상에서 25℃에 7일간 배양하였을 때 약 14.7 ㎜의 크기로 느리게 자랐으며 OA 상 25℃에서 16.3㎜으로 생장율이 가장 높았고 YPDA 상 25℃에서 7.5㎜으로 생장율이 가장 낮았다. 콜로니는 CMDA, OA 배지에서 앞과 뒤는 흰색을 띄었고 MEA 배지에서는 앞과 뒤 모두 회색을 띄었다. V8A, PDA, YPDA 배지에서 앞은 중앙은 초록색, 가장자리는 흰색을 띄었고 뒷면은 갈색, 주황색, 노란색, 흰색이 차례로 관찰되었다. 콜로니는 모두 둥근 형태이다. 포자는 난형 또는 타원형으로 관찰되었고 크기는 1–2 ㎛ × 3–4 ㎛ 이다.
분리원: 담수침전식물체
표본 정보: 강원도 원주시(N37°10’37.8″, E127°50’11.7″), 2020.03.06., NNIBRFG31097 (FBCC-F1434) 국립낙동강생물자원관, ITS PQ034558, LSU PQ657929
비고: NNIBRFG31097 균주는 ITS 영역의 염기서열을 NCBI의 blast를 이용하여 비교한 결과, C. gregata (MK626763) 균주와 99% 상동성을 보였으나, 최초 보고 균주와 포자의 형태가 일치하며 계통수 상에서 C. constrictospora 균주와 같은 clade에 속하는 것으로 확인되어 최종적으로 C. constrictospora으로 동정되었다. 생장속도가 느렸으며, 20–25℃에서 생장이 좋았다. 시들음병원균과 고추역병균, 사이드로포어와 아밀라아제도 약한 활성을 보였다. 글리코시다아제 활성을 나타나지 않았다.
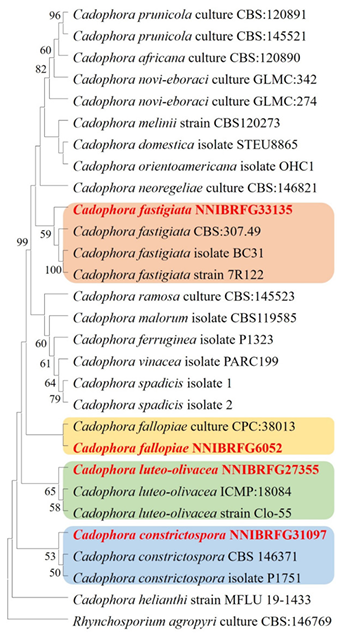
Fig. 1. Phylogenetic tree of Cadophora species were inferred using the Neighbor-Joining method by internal transcribed spacer region (ITS) and large subunit ribosomal RNA gene (LSU). The percentage of replicate trees in which the associated taxa clustered together in the bootstrap test (1,000 replicates) are shown next to the branches. The evolutionary distances were computed using the Kimura 2-parameter method. This analysis involved 29 nucleotide sequences. There were a total of 952 positions in the final dataset. Evolutionary analyses were conducted in MEGA 11 [8]. The sequences of Rhynchosporium agropyri were used as outgroup. The unrecorded strains were shown in bold and red.
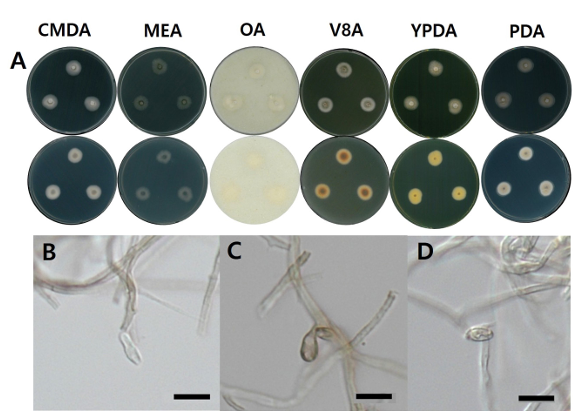
Fig. 2. Morphological characters of C. constrictospora NNIBRFG31097 (FBCC-F1434). A: mycelial growth on six media for 7 days at 25℃, B–D: conidiophore and conidia, ×400, scale bar = 10 ㎛. CMDA: corn meal dextrose agar; MEA: malt extract agar; OA: oatmeal agar; V8A: V8 agar; YPDA: yeast extract peptone dextrose agar; PDA: potato dextrose agar.
Table 1. Physiological characteristics of four Cadophora species
| FBCC No. | Species | Strain No. | Fusarium spp. | Colletotrichum gloeosporioides | Phytophthora capsici | Siderophore | Amylase | Glycosidase |
|---|---|---|---|---|---|---|---|---|
| FBCC-F1434 | Cadophora constrictospora | NNIBRFG31097 | +* | NE | + | + | + | – |
| FBCC-F3780 | Cadophora fallopiae | NNIBRFG06052 | – | ++ | NE | – | – | + |
| FBCC-F1694 | Cadophora fastigiata | NNIBRFG33135 | ++ | NE | + | + | + | – |
| FBCC-F1462 | Cadophora luteo-olivacea | NNIBRFG27355 | + | NE | ++ | + | + | +++ |
FBCC: Freshwater Bioresources Culture Collection. *NE: not examined, -: no activity, +: slight activity, ++: moderate activity, +++: strong activity.
형태 및 배양 특성: PDA 상에서 25℃에 7일간 배양하였을 때 약 19.7㎜의 크기로 느리게 자라며, CMDA 상 25℃에서 23.3㎜으로 생장율이 가장 높았고 OA 상 25℃에서 16.7㎜으로 생장율이 가장 낮았다. 콜로니의 앞은 CMDA 배지와 YPDA 배지에서 흰색을 띄었고 뒷부분은 CMDA에서는 흰색, YPDA 상에서는 노란색을 띄었다. 또한 MEA, OA, V8A, PDA 배지에서는 콜로니의 앞과 뒷면 모두 중앙에서는 초록색을 띄었고 가장자리부분은 흰색을 띄었다. 콜로니의 중앙은 균사체의 밀도가 높았으며 가장자리로 갈수록 밀도가 낮았고 콜로니는 모두 둥근형태이다. 포자는 난형 또는 타원형으로 관찰되었고 크기는 2–3 ㎛ × 3–5 ㎛ 이다.
분리원: 담수침전식물체
표본 정보: 전라북도 진안군(N35°57’10.9″, E127°31’34.4″), 2018.06.21.,NNIBRFG6052(FBCC-F3780), 국립낙동강생물자원관, ITS PQ034556, LSU PQ657927
비고: NNIBRFG6052 균주는 ITS 영역의 염기서열을 NCBI의 BLAST를 이용하여 비교한 결과, C. fallopiae (MT223784) 균주와 100% 상동성을 보였으며, 최초 보고 균주와 포자의 형태가 일치하며 계통수 상에서도 C. fallopiae 균주와 같은 clade에 속하는 것으로 확인되어 최종적으로 C. fallopiae으로 동정되었다. 생장속도가 느렸으며, 20–25℃에서 생장이 좋았다. 시들음병원균, 사이드로포어, 아밀라아제 활성은 보이지 않았으나, 탄저병원균과 글리코시다아제 활성은 나타났다.
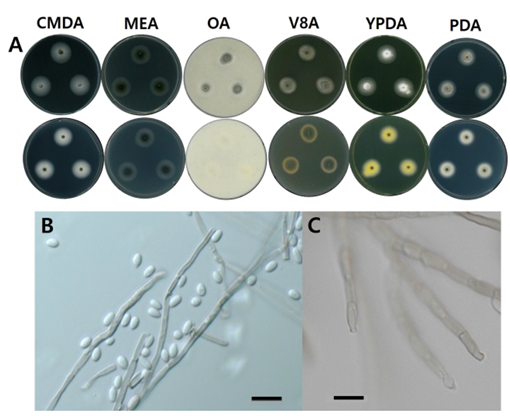
Fig. 3. Morphological characters of C. fallopiae NNIBRFG6052 (FBCC-F3780). A: mycelial growth on six media for 7 days at 25℃, B–C: conidiophore and conidia, ×400, scale bar = 10 ㎛. CMDA: corn meal dextrose agar; MEA: malt extract agar; OA: oatmeal agar; V8A: V8 agar; YPDA: yeast extract peptone dextrose agar; PDA: potato dextrose agar.
형태 및 배양 특성: PDA 상에서 25℃에 7일간 배양하였을 때 약 19㎜ 의 크기로 느리게 자라며, CMDA 상 25℃에서 23.3㎜으로 생장율이 가장 높았고 OA 상 25℃에서 17.3㎜으로 생장율이 가장 낮았다. 콜로니는 CMDA, MEA, OA, V8A, YPDA, PDA 배지 상에서 앞과 뒤 모두 중앙은 진한 초록색을 띄다가 가장자리 방향으로 연한 회색에서 흰색으로 바뀌었다. 콜로니는 중앙은 밀도가 높고 가장자리는 밀도가 낮았으며 둥근 형태이다. 포자는 끝이 타원형으로 관찰되었고 크기는 1–2 ㎛ × 2–5 ㎛ 이다.
분리원: 하천의 담수
표본 정보: 광주광역시 광산구(E35°10’46”, E126°48’43”), 2021.03.19., NNIBRFG33135(FBCC-F1694), 국립낙동강생물자원관, ITS PQ034555, LSU PQ657930
비고: NNIBRFG33135 균주는 ITS 영역의 염기서열을 NCBI의 BLAST를 이용하여 비교한 결과, C. fastigiata (MT635284) 균주와 100% 상동성을 보였으며, 최초 보고 균주와 포자의 형태가 일치하며 계통수 상에서도 C. fastigiata 균주와 같은 clade에 속하는 것으로 확인되어 최종적으로 C. fastigiata로 동정되었다. 생장속도가 느렸으며, 20–25℃에서 생장이 좋았다. 시들음병원균, 고추역병균, 사이드로포어, 아밀라아제 활성을 보였으나, 글리코시다아제 활성을 나타나지 않았다.
균학적 특성: PDA 상에서 25℃에 7일간 배양하였을 때 약 15.7 ㎜의 크기로 느리게 자라며 V8A 상 25℃에서 21.7 ㎜의 크기로 생장율이 가장 높았고 YPDA 상 25℃에서 14 ㎜의 크기로 생장율이 가장 낮았다. 콜로니의 앞은 CMDA, YPDA, PDA 배지에서 흰색이었고 뒤는 연한 노란빛을 띄고 대체로 흰색을 띄었다. 또한 MEA, OA, V8A 배지에서 콜로니의 앞과 뒤는 회색이 섞인 초록색을 띄었다. 콜로니는 V8A 배지에서 가장 밀도가 높게 자랐으며 모든 배지에서 둥근 형태로 관찰되었다. 포자는 끝이 난형 또는 타원형으로 관찰되었고 크기는 1–2 ㎛ × 1.5–5 ㎛ 이다.
분리원: 하천의 담수
표본 정보: 경상북도 문경시(N36°36’21”, E128°9’51”), 2020.02.26., NNIBRFG27355(FBCC-F1462), 국립낙동강생물자원관, ITS PQ034557, LSU PQ657928
비고: NNIBRFG27355 균주는 ITS 영역의 염기서열을 NCBI의 BLAST를 이용하여 비교한 결과, C. luteo-olivacea (JX981487) 균주와 98%의 상동성을 보였으나, 최초 보고 균주와 포자의 형태가 일치하고 계통수 상에서도 C. luteo-olivacea와 같은 clade에 속하는 것으로 확인되어 최종적으로 C. luteo-olivacea으로 동정되었다. 생장속도가 느렸으며, 20–25℃에서 생장이 좋았다. 글리코시다아제는 강한 활성을 보였으며, 시들음병원균, 고추역병균, 사이드로포어, 아밀라아제도 약하게 활성을 보였다.
본 연구는 국내 담수 환경에서 분리된 미기록 Cadophora 속 균류 4종의 균학 및 생리학적 특성을 분석하였다. 분리된 균류의 형태 및 계통학적 분석을 통해 C. constrictospora NNIBRFG31097(FBCC-F1434), C. fallopiae NNIBRFG6052(FBCC-F3780), C. fastigiata NNIBRFG33135(FBCC-F1694), C. luteo-olivacea NNIBRFG27355(FBCC-F1462)으로 동정되어 국내 미기록 균류로 확인하였다. 이들의 생리학적 특성으로 항균활성, 사이드로포어 생성능, 효소 활성을 조사하였다. 본 연구는 국내 담수 환경에서의 Cadophora 속 균류의 다양성을 이해하고 이들의 생리학적 특성을 규명하는데 기여하였다.
None.
This work was supported by a grant from the Nakdonggang National Institute of Biological Resources (NNIBR)(NNIBR20241106 and NNIBR20243107) and the Korea Environment Industry & Technology Institute (KEITI) through a project to make multi-ministerial national biological research resources a more advanced program (2021003420002) funded by the Korea Ministry of Environment (MOE).
1. Lagerberg T, Lundberg G, Melin E. Biological and practical researches into blueing in pine and spruce. Svenska Skogsvårdsföreningens Tidskrift 25(2). Alingsås: Centraltryckeriet; 1927. p. 145-272.
2. Allington WB, Chamberlain DW. Brown stem rot of soybean. Phytopathology 1948;38:793802.
3. Blanchette RA, Held BW, Jurgens JA, McNew DL, Harrington TC, Duncan SM, Farrell RL. Wood-destroying soft rot fungi in the historic expedition huts of Antarctica. Appl Environ Microbiol 2004;70:1328-35. [DOI]
4. Marco SD, Calzarano F, Osti F, Mazzullo. Pathogenicity of fungi associated with a decay of kiwifruit. Australas Plant Pathol 2004;33:337-42. [DOI]
5. Travadon R, Rolshausen PE, Gubler WD, Cadle-Davidson L, Baumgartner K. Susceptibility of cultivated and wild Vitis spp. to wood infection by fungal trunk pathogens. Plant Dis 2013;97:1529-36. [DOI]
6. Maciá-Vicente JG, Piepenbring M, Kouko O. Brassicaceous roots as an unexpected diversity hot-spot of helotialean endophytes. IMA Fungus 2020;11:16. [DOI]
7. Crous PW, Wingfield MJ, Schumacher RK, Akulov A, Bulgakov TS, Carnegie AJ, Jurjević Ž, Decock C, Denman S, Lombard L, et al. New and interesting fungi 3. Fungal Syst Evol 2020;6:157-231. [DOI]
8. Tamura K, Stecher G, Kumar S. MEGA 11: Molecular evolutionary genetics analysis version 11. Mol Biol Evol 2021;38:3022-7. [DOI]
9. Harrington TC, McNew DL. Phylogenetic analysis places the Phialophora-like anamorph genus Cadophora in the Helotiales. Mycotaxon 2003;87:141-51.