Eunjin Kim, Mi-Jeong Park, Yeongseon Jang*, and Kang-Hyeon Ka
Forest Microbiology and Application Division, Forest BioResources Department, National Institute of Forest Science, Suwon 16631, Korea
*Correspondence to idjys@korea.kr
Korean Journal of Mycology (Kor J Mycol) 2024 December, Volume 52, Issue 4, pages 283-292.
https://doi.org/10.4489/kjm.520407
Received on March 29, 2024, Revised on March 29, 2024, Accepted on December 16, 2024, Published on Dec 30, 2024.
Copyright © The Korean Society of Mycology.
This is an Open Access article which is freely available under the Creative Commons Attribution-NonCommercial 4.0 International License (CC BY-NC) (https://creativecommons.org/licenses/by-nc/4.0/).
The shiitake mushroom, Lentinula edodes is an edible species cultivated worldwide. Various mycoviruses infecting L. edodes have been reported; however, research on the effects of viral infection remains limited. In this study, virus-cured strains were obtained using the mycelial fragmentation method from a wild-type strain NIFoS 51 infected with five different viruses, cultivated strain NIFoS 2778 (Sanbaekhyang) infected with two different viruses, and cultivated strain NIFoS 3435 (Sanhohyang) infected with one type of virus. The biological significance of viral infections was assessed by comparing isogenic virus-infected and viruscured strains. Viral infection was found to reduce mycelial growth rate and fruiting body yield. Traits of commercial importance, such as fruiting body fresh weight and pileus diameter, were affected by viral infections. This study suggests that preventing viral infections may be improve spawn quality management.
Lentinula edodes, Multiple infection, Mycovirus, Viral effect
표고는 세계에서 널리 재배되는 버섯 중 하나로 총생산량이 많고 경제적, 영양적 가치가 높은 고가의 식용버섯이다. 우리나라에서는 표고 재배가 전통적인 방법으로 원목재배가 주를 이루었지만, 최근 톱밥재배를 하는 농가의 증가와 함께 대형화가 이루어지고 있다[1]. 최근까지 표고 감염 바이러스에 대해 병징이 있는 버섯과 없는 버섯에서 다양한 바이러스들이 보고되었다. 예컨대, 선형 dsRNA 바이러스인 Lentinula edodes mycovirus (LeV-HKB)는 일본에서 완전한 게놈이 밝혀진 최초의 표고 바이러스이다[2]. Lentinula edodes spherical virus (LeSV)는 LeV-HKB와 염기서열 유사성이 높아 밀접하게 관련되어 있고, 병징이 있는 표고 균주에서 확인되었다는 특징이 있다[3,4]. Lentinula edodes partitivirus 1 (LePV1)도 균사체의 변성, 톱밥배지의 비정상적인 갈변, 자실체 형성 불가능 등의 증상이 있는 균주에서 발견되면서 버섯의 표현형 변화와 관련이 있는 것으로 보고되었다[2]. Lentinula edodes negative-strand RNA virus 1 (LeNSRV1)과 LeNSRV2는 ssRNA를 게놈으로 가지며, LeNSRV1은 담자균을 감염시키는 것으로 보고된 최초의 mymonavirus이며, LeNSRV2는 진균에 감염된 segmented ssRNA virus의 첫번째 사례로 보고되었다[5]. 나아가 최근에는 중국의 300여 개의 다양한 표고 균주들에 대한 분석 결과, 23개의 새로운 RNA 바이러스들이 보고되어 표고 감염 바이러스의 다양성이 확인되었다[2-3].
일반적으로 mycovirus의 감염은 숙주에서 명확한 표현형 변화를 일으키지 않으며 잠재되어 있는 것으로 알려져 있다[4]. 그러나 환경적인 조건이나 숙주의 상태에 따라 바이러스 감염이 숙주의 형태학적 및 생리학적 변화를 일으키는 경우도 보고되었다[2,4]. 바이러스에 감염되면 균사 생장 지연, 자실체 발달 지연, 자실체 변형 등 다양한 증상이 유발된다는 보고들을 고려할 때, 바이러스 감염은 버섯 생산에 경제적 손실을 초래할 수 있는, 종균 취약성의 잠재적인 원인이기에 관심을 가져야 할 필요가 있다[5-6].
바이러스 제거 균주를 얻기 위해서 cycloheximide나 ribavirin과 같은 화학물질 처리, 단일 분생포자 계대배양, 균사 팁 이동, 저온 또는 고온 배양, 균사체 단편화와 같은 다양한 시도들이 보고되었다[7-13]. 또한 본 연구팀은 선행연구에서 표고의 담자포자 유래 단핵균주들의 바이러스 감염을 조사한 결과, 바이러스에 감염되지 않은 단핵균주를 선발하여 육종에 활용함으로써 무바이러스 균주 개발이 가능함을 보인 바 있다[14].
본 연구에서는 균사체 단편화 방법을 통하여 표고 야생종과 품종들로부터 바이러스 제거 균주를 확보하고, 이들의 균사 생장 조사 및 재배 실험을 수행함으로써 바이러스가 표고의 균사 생장과 자실체 생산성과 특성에 영향을 주는지 확인하고자 하였다.
실험에 사용한 표고 균주는 국립산림과학원 균주보존실에 참나무 톱밥배지 시험관에서 4℃로 보존되어 있는 NIFoS 51, NIFoS 2778(산백향), NIFoS 3435(산호향) 균주를 사용하였다. 이 균주들은 potato dextrose agar (PDA) 평판배지에 25℃에서 배양하여 접종원으로 사용하였다.
PDA 배지에서 성장한 균사체를 cell scraper (SPL, Seoul, Korea)로 모은 뒤, 막자와 막자사발, 액체질소를 이용해 균사를 가루 형태로 만들어서 RNeasy Mini Kit (Qiagen, CA, USA)를 이용하여 RNA를 추출하였다. RNA 정량은 Epoch Multi-volume Spectrophotometer (BioTek, VT, USA)를 사용하여 조사하였고 cDNA 합성은 High capacity cDNA reverse transcription kit (Applied biosystems, CA, USA)를 사용하여 수행하였다.
PCR은 합성된 cDNA를 주형으로 C1000 thermal cycler (Biorad, CA, USA)를 이용하여 95℃에서 5분 변성 후, 95℃에서 30초, 60℃에서 30초, 72℃에서 1분으로 25회 반복하고, 72℃에서 5분간 추가로 반응을 진행하였다. 이때 PCR 반응액은 AccuPower PCR premix (Bioneer, Daejeon, Korea)를 사용하였으며, 바이러스의 RNA 의존성 RNA 중합효소(RdRp) 유전자에 대한 특이적 프라이머로 PCR을 수행하였다(Table 1). 증폭된 PCR 산물은 1.5% 아가로스젤 전기영동으로 확인하였다.
Table 1. Primers used in this study.
| Virus | Forward primer (5’-3’) | Reverse primer (5’-3’) |
|---|---|---|
| LeSV | GCGATGATGACATACAGTAGGC | CGACGTCGGATAACATTGCGTC |
| LePV1 | AGCCTTTGACGATGTATCCGACTAC | GGGTTATGATTGCGAGAGGCATT |
| LeV-HKB | TGTTGTATAAGACAGGCGGTGTGGG | GGGTATATCTCAGCAAGCCTATGC |
| LeNSRV1 | CGAGACATCCTCGCGGCTGTAGAGG | CCGAGGTTACCAGCTCCGATTGTC |
| LeNSRV2 | AAGTATGGGGTAGTGATGATAGTGG | GAGGCTCCACCTTCCAATGTCTGAG |
LeSV: Lentinula edodes spherical virus; LePV1: Lentinula edodes partitivirus 1; LeV-HKB: Lentinula edodes mycovirus-HKB; LeNSRV1: Lentinula edodes negative-strand RNA virus 1; LeNSRV2: Lentinula edodes negative-strand RNA virus 2
무바이러스 표고 균주를 확보하기 위해 균사체 단편화 방법을 적용하였다[11-13]. 바이러스에 감염된 균사체를 PDA 평판배지에서 2~4주간 배양한 후 cell scraper로 균사체를 긁어 5 mL 멸균수에 현탁하고 40㎛ cell strainer (SPL life scicences, Pocheon, Korea)를 통해 여과하였다. 그런 다음, PDA 평판배지에 도말하고 25℃에서 암배양하였다. 균사체 단편화 후 생성된 colony를 RT-PCR을 이용하여 바이러스의 유무를 확인하였다.
PDA 배지 1개당 25 mL씩 분주하여 동일한 조건의 배지를 준비하였다. 각 배지에 균사 플러그(직경 6 mm)를 접종한 후 25℃에서 9일 동안 배양하였다. 균사 생장률 측정을 위해 디지털 버니어캘리퍼스를 이용하여 각 균주의 균총의 크기(접종원의 직경 제외)를 측정하여 생장률을 비교하였다. 균주마다 3 반복 실험을 수행하였다.
접종원용 톱밥배지는 국내산 참나무류의 톱밥을 사용하고 영양원으로 밀기울을 사용하였다. 재료들은 8:2(w/w) 비율로 혼합하여 함수율 65%로 조정하였다. 톱밥배지는 2 kg의 사각블럭 배지를 제작하였고, 균주 당 10반복으로 준비하고 100℃에서 60분, 121℃에서 90분간 살균하였으며 무균상에서 각 실험 균주의 종균을 접종하였다. 종균은 배지당 20 g씩 접종하였으며 종균이 접종된 배지는 종균 투입구를 완전히 밀봉하여 배양실로 옮겼다. 모든 사각블럭 톱밥배지는 암배양 조건에서 60일, 명배양 조건에서 40일을 CO2 1,000ppm, 온도 25℃로 배양하였다. 배양이 완료된 톱밥배지는 비닐봉지를 개봉하여 1차 발생을 진행하였고 발생 기간 동안에는 내부온도 18℃, 습도 80%를 유지하였다. 1차 발생 후 2주간 휴양 기간을 주었으며, 휴양 후에는 배지를 48시간 동안 침수한 다음 발생을 진행하였다. 버섯발생은 총 3차까지 진행하였고, 각 차수에 수확된 표고는 무게 및 수량을 조사하였다. 그리고 균주에 따른 자실체의 형태적 특성을 비교하기 위해 자실체 각각의 무게, 갓의 직경, 갓의 두께, 대 길이, 대 두께 등을 조사하였다.
균주간의 생장속도, 자실체 형태적 특성 및 생산성 차이의 통계적 유의성을 확인하기 위하여 SPSS 프로그램(SPSS version18, SPSS IBM, NY, USA)으로 t-test 및 분산분석(one-way ANOVA)을 수행하였다.
바이러스 감염이 균사의 생장과 자실체에 영향을 미치는지 분석하기 위하여 균사체 단편화 방법을 통하여 유전적으로 동일하면서 바이러스가 제거된 균주들(virus-cured isogenic strains)을 확보하고자 하였다[11-13]. 이를 위하여 국내 표고 균주들의 바이러스 감염에 대한 선행 조사에서 5종(LeSV, LePV1, LeV-HKB, LeNSRV1, LeNSRV2)의 바이러스에 감염된 것으로 확인한 야생 균주 NIFoS 51과 2종의 바이러스에 감염된 것으로 확인한 재배 균주 NIFoS 2778(산백향)[14, 15], 추가적으로 1종의 바이러스에 감염된 재배 균주 NIFoS 3435(산호향)을 사용하였다(Fig. 1).
NIFoS 51은 여러 차례의 균사체 단편화를 시도하여 5종 바이러스 중에서 1종(LeNSRV1), 2종(LeNSRV1, LeNSRV2), 3종(LePV1, LeNSRV1, LeNSRV2) 바이러스만 감염된 균주들과 5종 바이러스가 모두 제거된 균주를 확보하였다(Fig. 1, Table 2). 표고 바이러스의 자실체에서 담자포자로의 수직감염율에 대한 연구 결과에서는 LeNSRV1이 LeV-HKB에 비해 낮은 감염율을 나타냈으나[14], 균사체 단편화 방법에서는 LeNSRV1가 감염된 균주가 반복적으로 나타났다. 이러한 결과는 바이러스 제거 방법에 따라 바이러스 종류별 제거 효율에 차이가 있다는 선행 결과와 일치한다[13]. 따라서 향후 표고 바이러스 제거법 개발을 위해 바이러스 종류에 따라 다양한 방법이 시도되어야 할 것이다.
2종(LeV-HKB, LeNSRV1) 바이러스에 감염된 NIFoS 2778 균주는 각각의 바이러스가 하나씩 제거된 균주와 무바이러스 균주를 얻을 수 있었다. NIFoS 3435 균주는 같은 방법으로 LeV-HKB 바이러스를 제거한 균주를 얻을 수 있었다(Fig. 1; Table 2).
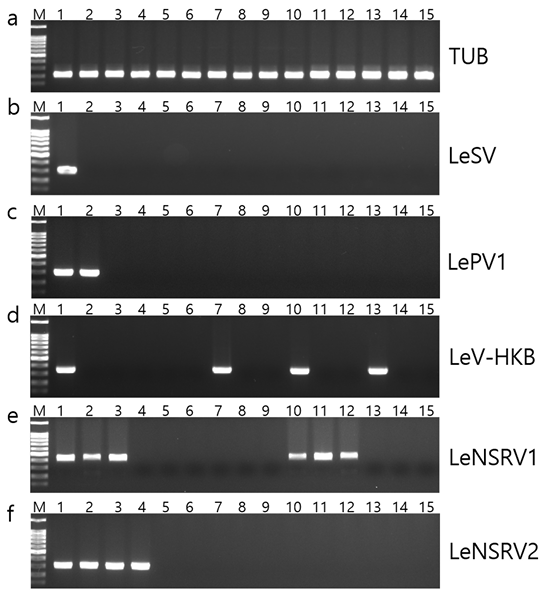
Fig. 1. RT-PCR detection of mycoviruses in the Lentinula edodes strains treated by hyphal fragmentation. Lane M, 100 bp marker; 1, NIFoS 51; 2, 51V3; 3, 51V2; 4, 51V1; 5, 51VF1; 6, 51VF2; 7, NIFoS 3435; 8, 3435VF1; 9, 3435VF2; 10, NIFoS 2778; 11, 2778V1-1; 12, 2778V1-2; 13, 2778V13; 14, 2778VF1; 15, 2778VF2. TUB, tubulin; LeSV, Lentinula edodes spherical virus; LePV1, Lentinula edodes partitivirus 1; LeV-HKB, Lentinula edodes mycovirus-HKB; LeNSRV1, Lentinula edodes negative-strand RNA virus 1; LeNSRV2, Lentinula edodes negative-strand RNA virus 2.
Table 2. The strains and their virus infection status
| No. | Strain | LeSV | LePV1 | LeV-HKB | LeNSRV1 | LeNSRV2 |
|---|---|---|---|---|---|---|
| 1 | NIFoS 51 | + | + | + | + | + |
| 2 | 51V3 | – | + | – | + | + |
| 3 | 51V2 | – | – | – | + | + |
| 4 | 51V1 | – | – | – | – | + |
| 5 | 51VF1 | – | – | – | – | – |
| 6 | 51VF2 | – | – | – | – | – |
| 7 | NIFoS 3435 | – | – | + | – | – |
| 8 | 3435VF1 | – | – | – | – | – |
| 9 | 3435VF2 | – | – | – | – | – |
| 10 | NIFoS 2778 | – | – | + | + | – |
| 11 | 2778V1-1 | – | – | – | + | – |
| 12 | 2778V1-2 | – | – | – | + | – |
| 13 | 2778V1-3 | – | – | + | – | – |
| 14 | 2778VF1 | – | – | – | – | – |
| 15 | 2778VF2 | – | – | – | – | – |
LeSV: Lentinula edodes spherical virus; LePV1: Lentinula edodes partitivirus 1; LeV-HKB: Lentinula edodes mycovirus-HKB; LeNSRV1: Lentinula edodes negative-strand RNA virus 1; LeNSRV2: Lentinula edodes negative-strand RNA virus 2.
+, infected; -, non-infected.
확보된 균주들을 활용하여 바이러스 감염이 균사 생장속도에 미치는 영향을 조사하였다(Fig. 2). LeV-HKB에 감염된 NIFoS 3435와 LeV-HKB를 제거한 3435VF1과 3435VF2를 비교한 결과, 바이러스가 제거된 두 균주에서 모균주보다 빠른 생장속도를 나타냈다. LeV-HKB와 LeNSRV1에 감염된 NIFoS 2778에서 LeV-HKB를 제거한 2778V1-1과 2778V1-2도 마찬가지로 모균주보다 빠른 생장속도를 나타내어, LeV-HKB가 균사 생장을 저해하는 작용을 하는 것으로 생각된다. 5종 바이러스에 감염된 NIFoS 51에서 유래한 바이러스 제거 균주들도 모두 모균주보다 빠른 균사 생장속도를 나타내었다. 이러한 결과는 표고와 느타리에서 바이러스 감염이 이핵균사의 생장속도를 감소시킨다는 보고들과 일치한다[11-13, 16]. 반면, NIFoS 2778에서 LeNSRV1이 제거된 2778V1-3는 모균주와 생장속도에서 차이를 보이지 않은 것으로 보아 바이러스 종류에 따라 균사 생장에 대한 영향이 다를 수 있을 것으로 추측되었다.
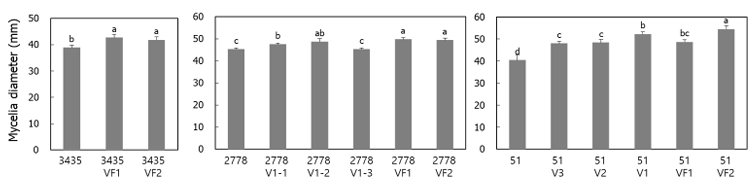
Fig. 2. Comparisons of the mycelia growth rate of virus-infected and virus-cured strains. The mycelia diameter of each strain was measured after 9 d of growth at 25℃ on potato dextrose agar (PDA) medium. The strains were indicated on the x-axis and the mycelia diameters were indicated on the y-axis. The letters indicate statistically significant differences based on one-way ANOVA with Duncan’s multiple range test (p < 0.05). Bars indicate the standard deviation.
다음으로는 바이러스 감염이 표고 자실체 특성 및 생산량에 미치는 영향을 분석하기 위하여 재배시험을 실시하였다(Fig. 3). 재배시험에는 바이러스에 감염된 균주들과, 각 균주에서 감염된 바이러스를 모두 제거하고 서로 독립적인 두 균주를 사용하였다. 2kg 톱밥배지에 균주를 접종하여 100일 배양 후 총 3번의 발생작업을 반복하였으며, 균주별로 생산량과 자실체의 특성을 분석하였다.
LeV-HKB에 감염된 NIFoS 3435의 배지당 생산량은 385g인데 반해, LeV-HKB를 제거한 3435VF1은 501g의 배지당 생산량을 보여 바이러스 제거에 의해 생산량이 증가함을 확인하였다(Fig. 4a). LeV-HKB와 LeNSRV1이 제거된 2778VF1의 배지당 생산량은 387g으로 NIFoS 2778의 300g보다 높게 나타났다(Fig. 4b). LeSV, LePV1, LeV-HKB, LeNSRV1, LeNSRV2에 의해 감염된 NIFoS 51의 배지당 생산량은 257g이었으며, 감염된 5종의 바이러스를 모두 제거한 51VF1은 334g으로 나타나 바이러스 제거에 의한 생산량 증가를 확인할 수 있었다(Fig. 4c). 이러한 결과는 느타리에서 PoV 바이러스 제거에 의한 자실체 생산량 증가와 일치한다[16]. 본 연구를 통해 표고에서도 바이러스 제거에 의해 생산량이 증가하는 경향성이 나타난 것으로 보아, 향후 우량 종균 확보와 보급을 위해 바이러스 감염 관리도 필요할 것으로 생각된다.
한편, 자실체 특성 조사 결과, 바이러스 감염균주에서 특별히 기형적인 모양이 관찰되지 않았다(Fig. 3). 적어도 본 연구에서 살펴본 5종의 바이러스는 자실체의 형태 발달에 영향을 미치지는 않는 것으로 판단된다. 다만, 느타리에서 바이러스 감염균주의 자실체가 비정형의 형태로 발달하거나, 팽이에서 바이러스 감염균주의 자실체가 전체적인 색택 변화를 보인 것을 고려할 때[3,4], 표고에서도 바이러스 종류에 따라 자실체의 형태 이상을 일으킬 수 있을 것으로 생각된다. 전반적으로 자실체의 개체중과 갓 직경이 바이러스 감염균주보다 바이러스 제거 균주에서 증가한 것으로 나타났다 (Table 3). 반면 대 길이와 대 두께는 바이러스 감염 여부에 따라 뚜렷한 차이를 보이지 않았다. 선행 연구에 따르면, 표고의 HD1 전사인자의 발현량이 균사 생장속도 및 갓 직경과 상관관계가 있음이 보고되었다[17,18]. 바이러스 제거 균주에서 균사 생장속도와 갓 직경이 증가한 결과를 고려할 때(Fig. 2, Table 3), 향후 바이러스 감염 균주와 제거 균주 간에 HD1 전사인자의 발현량에 차이가 있는지 살펴볼 필요가 있을 것으로 생각된다. 또한, 느타리에서 망간 퍼옥시다제(manganese peroxidase), 라카아제(laccase), 셀룰라아제(cellulase) 등 세포외효소(extracellular enzyme)들의 발현이 바이러스 제거에 의해 증가된다는 보고를 고려할 때[16], 향후 표고에서도 이들 유전자의 발현을 살펴봄으로써 바이러스 감염이 유전자 수준에서 어떤 기작을 통해 균사 생장과 생산량 등에 영향을 미치는지 알아볼 수 있을 것으로 생각된다.
본 연구를 통해 표고에서 균사체 단편화 방법으로 단일 및 다중 바이러스 제거가 가능함을 확인하였다. 이렇게 확보된 균주들은 표고에서 바이러스의 병원성 기작을 밝히는 데 활용될 수 있을 것이다. 또한 바이러스 감염이 균사의 생장을 느리게 하고 자실체 수율을 감소시킴을 확인하였다. 향후 무바이러스 종균의 확보 및 보급을 통해 재배농가의 소득 증대에 도움이 되길 기대한다.

Fig. 3. Morphological characteristics of fruiting bodies on sawdust cultivation. a, NIFoS 3435; b, 3435VF1; c, NIFoS 2778; d, 2778VF1; e, NIFoS 51; f, 51VF1.
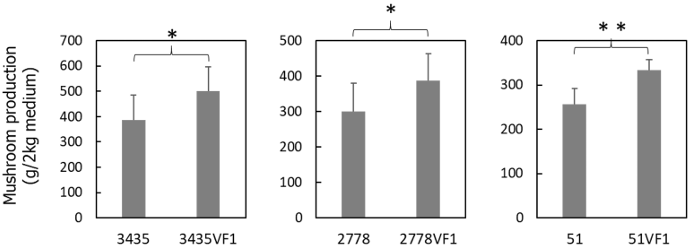
Fig. 4. Comparisons of fruiting body total yield of virus-infected and virus-cured strains cultured on sawdust block medium. The strains were indicated on the x-axis and the mushroom production was indicated on the y-axis. * p < 0.05,** p < 0.01 (by t-test).
Table 3. Fruiting body characteristics of strains cultivated on sawdust block medium
| Strain | Fresh weight (g) | Cap diameter (mm) | Cap height (mm) | Gill width (mm) | Stipe length (mm) | Stipe diameter (mm) |
|---|---|---|---|---|---|---|
| NIFoS 3435 | 44.3 ± 19.7 | 70.3 ± 14.4 | 16.1 ± 3.2 | 2.1 ± 0.8 | 39.0 ± 9.8 | 18.9 ± 5.1 |
| 3435VF1 | 52.8 ± 22.7** | 76.6 ± 12.7** | 16.8 ± 2.6 | 2.3 ± 0.9 | 40.3 ± 8.4 | 19.4 ± 4.3 |
| NIFoS 2778 | 26.3 ± 11.9 | 55.9 ± 11.2 | 13.6 ± 2.6 | 1.7 ± 0.6 | 46.7 ± 10.3 | 18.3 ± 4.5 |
| SVF1 | 31.5 ± 12.9** | 63.5 ± 8.7** | 14.3 ± 2.5* | 1.9 ± 0.6** | 48.4 ± 9.1 | 19.2 ± 4.9 |
| NIFoS51 | 13.5 ± 4.7 | 44.1 ± 7.2 | 9.2 ± 1.4 | 3.0 ± 1.1 | 36.8 ± 5.8 | 9.8 ± 2.2 |
| 51VF1 | 15.1 ± 5.5** | 46.1 ± 7.5** | 9.6 ± 1.7* | 3.5 ± 1.0** | 36.4 ± 6.0 | 9.4 ± 2.0 |
Values are presented as mean ± standard deviation.
*p < 0.05, ** p < 0.01 (by t-test).
표고는 세계적으로 널리 재배되는 식용버섯으로, 최근 다양한 표고 감염 바이러스들의 존재가 보고되고 있으나 바이러스 감염의 영향에 대한 연구는 부족한 실정이다. 본 연구에서는 5종의 바이러스에 감염된 야생 균주 NIFoS 51과 2종의 바이러스에 감염된 재배 균주 NIFoS 2778(산백향), 1종의 바이러스에 감염된 재배 균주 NIFoS 3435(산호향)로부터 균사체 단편화 방법을 통하여 바이러스 제거 균주들을 확보하였다. 확보한 균주들의 균사 생장 속도와 자실체 관련 특성에 대하여 분석한 결과, 바이러스 감염이 균사 생장 속도와 자실체 생산성을 저해할 수 있음을 확인하였다. 또한 바이러스 감염이 자실체 특성 중 상업적으로 중요한 특성인 생중량과 갓 직경에도 영향을 줄 수 있음을 확인하였다. 본 연구는 바이러스 감염 관리가 우량 종균 확보에 도움이 될 수 있음을 시사한다.
No conflict of interest is declared by the author.
This study was supported by a grant from the general project (FP0800-2023-01) of National Institute of Forest Science, Republic of Korea.
1. Castro M, Kramer K, Valdivia L, Ortiz S, Castillo A. A double-stranded RNA mycovirus confers hypovirulence-associated traits to Botrytis cinerea. FEMS Microbiol Lett 2003;228:87-91. [DOI]
2. Hollings M. Viruses associated with a die-back disease of cultivated mushroom. Nature 1962;196:962-5. [DOI]
3. Ro HS, Kang EJ, Yu JS, Lee TS, Lee CW, Lee HS. Isolation and characterization of a novel mycovirus, PeSV, in Pleurotus eryngii and the development of a diagnostic system for it. Biotechnol Lett 2007;29:129-35. [DOI]
4. Magae Y, Sunagawa M. Characterization of a mycovirus associated with the brown discoloration of the edible mushroom, Flammulina velutipes. Virol J 2010;7:342. [DOI]
5. Kwon YC, Jeong DW, Gin SI, Ro HS, Lee HS. Curing viruses in Pleurotus ostreatus by growth on a limited nutrient medium containing cAMP and rifamycin. J Virol Methods 2012;185:156-9. [DOI]
6. Eastwood D, Green J, Grogan H, Burton K. Viral agents causing brown cap mushroom disease of Agaricus bisporus. Appl Environ Microbiol 2015;81:7125-34. [DOI]
7. Carroll K, Wickner RB. Translation and M1 double-stranded RNA propagation: MAK18=RPL41B and cycloheximide curing. J Bacteriol 1995;177:2887-91. [DOI]
8. Azevedo ACS, Sosa-Gomez DR, Faria MR, Fungaro MHP. Effects of double-stranded RNA on virulence of Paecilomyces fumosoroseus (Deuteromycotina: Hyphomycetes) against the silverleaf whitefly, Bemisia tabaci strain B (Homoptera: Aleyrodidae). Genet Mol Biol 2000;23:61-3. [DOI]
9. Romo M, Leuchtmann A, Garcia B, Zabalgogeazcoa I. A totivirus infecting the mutualistic fungal endophyte Epichloë festucae. Virus Res 2007;124:38-43. [DOI]
10. Khan HA, Baig DI, Bhatti MF. An overview of mycoviral curing strategies used in evaluating fungal host fitness. Mol Biotechnol 2023;65:1547-64. [DOI]
11. Kim JM, Song HY, Choi HJ, Yun SH, So KK, Ko HK, Kim DH. Changes in the mycovirus (LeV) titer and viral effect on the vegetative growth of the edible mushroom Lentinula edodes. Virus Res 2015;197:8-12. [DOI]
12. Song HY, Choi HJ, Jeong H, Choi D, Kim DH, Kim JM. Viral effects of a dsRNA mycovirus (PoV-ASI2792) on the vegetative growth of the edible mushroom Pleurotus ostreatus. Mycobioloy 2016;44:283-90. [DOI]
13. Sun Y, Guo M, Wang J, Bian Y, Xu Z. Curing two predominant viruses occurring in Lentinula edodes by chemotherapy and mycelial fragmentation methods. J Virol Methods 2022;300:114370. [DOI]
14. Kim EJ, Park MJ, Kim MJ, Jeong ES, Jang Y, Ka KH. Vertical transmission of RNA mycoviruses in Lentinula edodes. Kor J Mycol 2022;50;263-74.
15. Kim EJ, Park MJ, Jang YS, Ryoo R, Ka KH. Detection of RNA mycoviruses in wild strains of Lentinula edodes in Korea. Kor J Mycol 2021;49:285-94.
16. Song HY, Kim N, Kim DH, Kim JM. The PoV mycovirus affects extracellular enzyme expression and fruiting body yield in the oyster mushroom, Pleurotus ostreatus. Sci Rep 2020;10:1094. [DOI]
17. Zhang L, Gong W, Li C, Shen N, Gui Y, Bian Y, Kwan HS, Cheung MK, Xiao Y. RNAseq-based high-resolution linkage map reveals the genetic architecture of fruiting body development in shiitake mushroom, Lentinula edodes. Comput Struct Biotechnol J 2021;19:1641-53. [DOI]
18. Gong W, Liu K, Li X, Zhang L, Shen N, Bian Y, Xiao Y. QTL mapping reveals mating type gene LeHD1 regulating mycelial growth in shiitake mushroom, Lentinula edodes. Sci Hortic 2022;305:111417. [DOI]