서론
곤충병원성 진균은 곤충 내부에 침입한 후 증식하여 곤충에 병을 일으키는 균을 말하며, 살충제 저항성을 가진 모기에 효과적이다[1,2]. 이러한 곤충병원성 진균들 중 Beauveria bassiana는 빈대[3]와 바구미[4], Lecanicillium lecanii는 진드기[5]의 표면에 접촉하여 감염시키는 것으로 알려져 있다. 또한 Entomophthora muscae (E. muscae)는 파리를 감염시키는 것으로 알려져 있으며, 덴마크, 미국, 브라질 등에서 보고되었다[6-9]. 파리는 채소 및 과일에 피해를 주는 해충으로, 그 중 꽃파리과의 유충은 식물의 잎을 섭식하여 작물에 피해를 주는 것으로 알려져 있다[10,11]. 씨고자리파리(Delia platura, D, platura)는 파리목(Diptera) 꽃파리과(Anthomyiidae)에 속하며 기주범위가 다양하다[12]. 국내에서는 두과작물에 피해를 입히는 것으로 보고되었다[13,14]. 현재 씨고자리파리에 대한 곤충병원성 진균의 감염에 대해 국내에서는 보고된 적이 없다. 이에 본 연구에서는 2023년 6월 공주대학교 예산캠퍼스 귀리 시험장(36°40'04.4"N 126°51'43.7"E)에서 곤충병원성 진균에 감염된 씨고자리파리들을 발견하였으며 해당 곤충병원성 진균들이 E. muscae임을 형태학적 특징 및 분자생물학 특징을 기초삼아 동정하여 이를 보고하고자 한다.
병원균의 채집
공주대학교 예산캠퍼스 귀리 시험장에서 날개를 뒤로 접은 채로 귀리에 매달려 있는 병원균에 감염된 파리를 채집하였다(Fig. 1A-C).

Fig. 1 Observation of flies infected with Entomophthora muscae. (A-C) The infected flies are attached to the tops of the oats.
병원균의 균학적 특징 및 염기서열분석
실체현미경(KS-208, Korea Lab Tech Corp., Seongnam, Korea)을 이용하여 감염된 파리를 관찰하였을 때, 배 부분에 병원균의 균사는 부풀어 있었고(Fig. 2A), 다리와 주둥이를 이용하여 줄기를 감싼 것이 확인되었다(Fig. 2B). E. muscae의 분류학적 특징과 포자 크기를 측정하기 위해 광학 현미경(KB-500, Korea Lab Tech Corp., Seongnam, Korea)을 이용하였다. Primary conidium는 종모양(campanulate)이며 크기는 13.42-19.27×16.69-22.46 μm였다(Fig. 2C). 병원균의 동정을 위해 테이프를 이용하여 숙주 곤충을 90 mm Petri dish에 붙인후 24시간동안 포자 낙하를 유도하였고, Petri dish 바닥에 낙하된 포자를 이용하였다. 숙주 곤충의 동정을 위해 액체질소를 이용하여 씨고자리파리의 다리를 파쇄 후 분석하였다. Genomic DNA의 분석을 위해 DNeasy Plant Kit (Qiagen, Hilden, Germany)를 이용하여 추출하였다. 추출된 DNA 시료를 주형으로 하여 병원균의 병원균의 ITS (internal transcribed spacer)영역을 증폭시키기 위해 emITS-1 (5’-TGG TAG AGA ATG ATG GCT GTT G-3’), emITS-4 (5’-GCC TCT ATG CCT AAT TGC CTT T-3’) 프라이머[15]를, 28S rRNA의 D1/D2영역을 증폭시키기 위해 NL1 (5’-GCA TAT CAA TAA GCG GAG GAA AAG-3’), NL4 (5’GGT CCG TGT TTC AAG ACG G-3’) 프라이머[16]를, 숙주 곤충 미토콘드리아 COI (cytochrome oxidase subunit I) 영역을 증폭시키기 위해 LCO1490 (5’-GGT CAA CAA ATC ATA AAG ATA TTG G-3’), HCO2198 (5’-TAA ACT TCA GGG TGA CCA AAA AAT CA-3’) 프라이머[17]를 사용하여 PCR을 수행하였다. PCR은 Biorad MyCycler™ Thermal Cycler System (Bio-rad, California, USA)을 사용하였다. Taq DNA polymerase (Bioneer, Daejeon, Korea)를 활용한 E. muscae의 ITS의 PCR 조건으로 pre-denaturation (94℃, 4분) 후, denaturation (94℃, 30초), annealing (52℃, 30초), extension (72℃, 60초)을 35 cycle 후 final extension (72℃, 10분) 1회 반복하였다. E. muscae의 28S의 PCR 조건으로 pre-denaturation (94℃, 4분) 후, denaturation (94℃, 30초), annealing (50℃, 30초), extension (72℃, 60초)을 35 cycle후 final extension (72℃, 10분) 1회 반복하였다. 씨고자리파리의 COI의 PCR 조건은 annealing 온도가 47℃이며 이외의 조건은 동일하였다. 증폭된 PCR 산물은 SolGent (Daejeon, Korea)에 정제와 분석을 의뢰하였다. 분석된 염기서열은 National Center for Biotechnology Information (미국국립생물정보센터) BlastN을 통해 상동성을 확인하였다. 계통학적 분석을 위해 Multiple Alignment Fast Fourier Transform ver. 7 [18]을 사용하여 염기서열을 정렬하였으며, MEGA X program [19] 이용하여 neighbor-joining 방법으로 수행하였다. 염기서열의 유전자거리는 TajimaNei parameter model로 계산하였고, Bootstrap analysis은 1,000반복으로 수행하였다. E. muscae의 28S 영역에 대한 GenBank 등록번호는 OR552408이며 길이는 1,090 bp로 확인되었다. Blastn 결과 E. muscae로 등록된 28S영역의 KC404073와 100% 상동성을 보였다. 또한 숙주 곤충의 염기서열의 Blastn 결과 D. platura 로 등록된 KY836679 와 100% 상동성을 보였다. 계통수 분석 결과 파리에 발생한 곤충병원성 진균의 28S 염기서열은 E. muscae와 같은 계통수에 포함되는 것으로 나타났으며, 숙주 곤충의 COI 염기서열은 D. platura와 같은 계통수에 포함되는 것으로 나타났다(Figs. 3 and 4). 본 연구에서는 기존 연구들로부터 얻은 데이터베이스 내 ITS영역에 대한 정보가 부족하여 분석에는 포함시키지 않았지만, 추후 연구를 위하여 ITS영역에 대한 정보를 추가적으로 제공하는 바이다(GenBank Accession No. OR552409).

Fig. 2 Morphological features of fly infected with Entomophthora muscae. (A) The mycelium of E. muscae has sprouted on the abdomen of the f ly. (B) The fly’s legs and proboscis have wrapped around the stem. (C) Primary conidium.
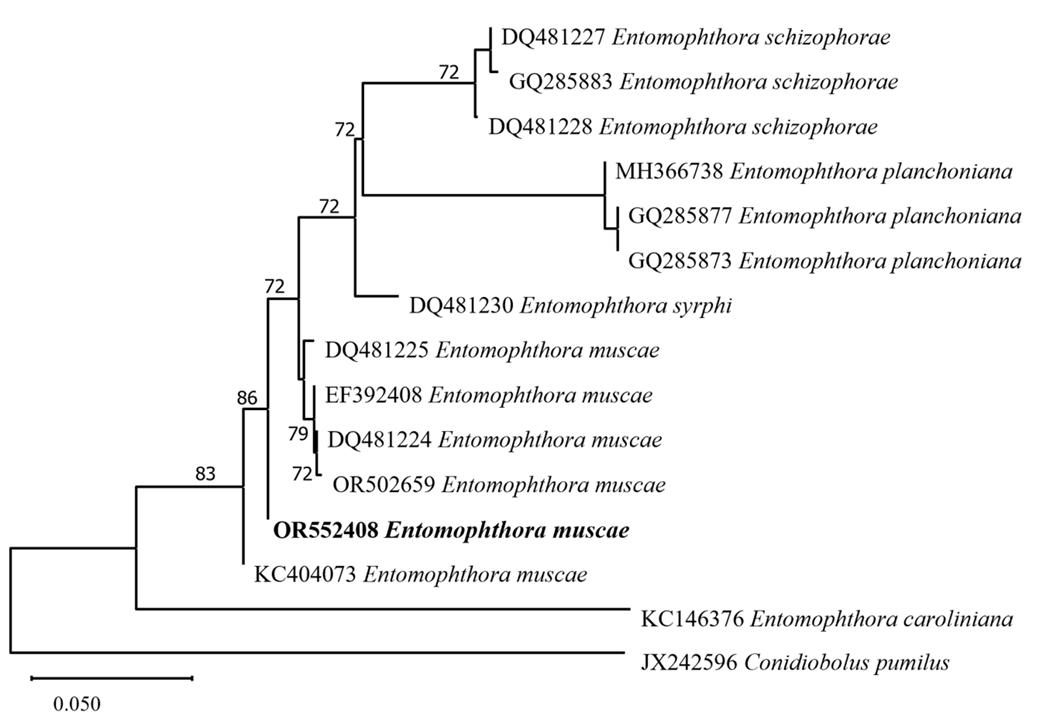
Fig. 3 Phylogenetic tree based on neighbor-joining method comparing the 28S ribosomal DNA (rDNA) region of E. muscae on Delia platura isolates and some reference isolates retrieved from GenBank. The bootstrap values over than 70% are shown at the nodes. The sequence of the strain used in this study is indicated in bold.
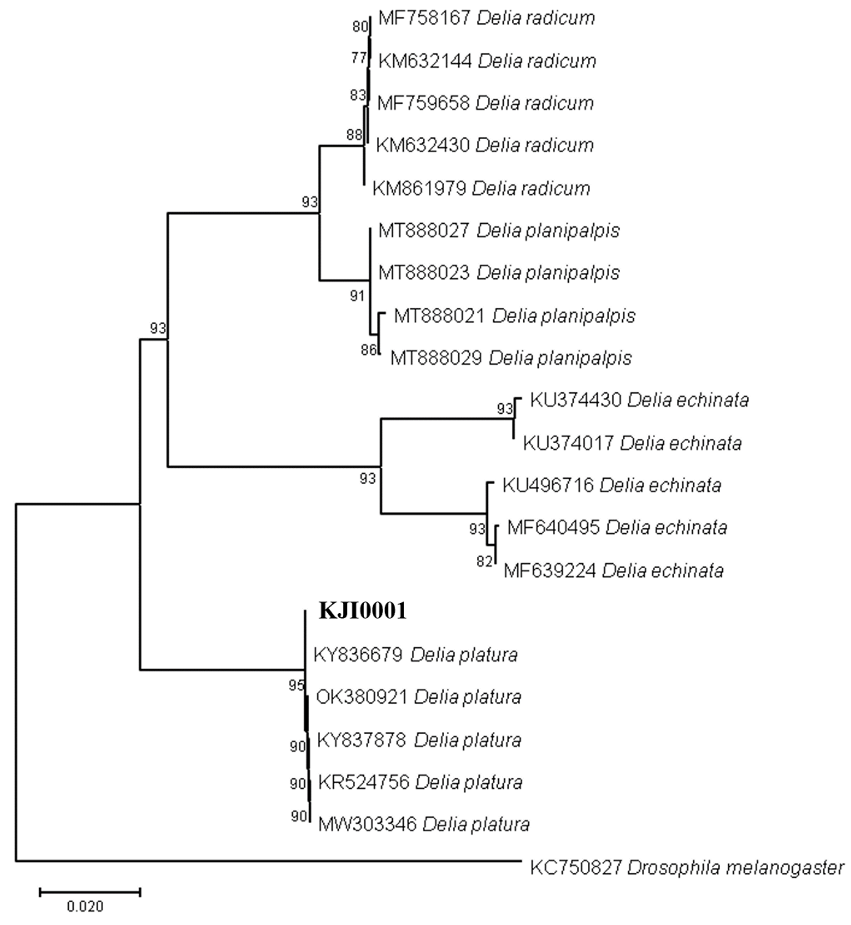
Fig. 4 Phylogenetic tree based on neighbor-joining method comparing the cytochrome oxidase subunit 1 (COI) gene of D. platura and some reference isolates retrieved from GenBank. The bootstrap values over than 70% are shown at the nodes. The sequence of the strain used in this study is indicated in bold
적요
2023년 6월 공주대학교 예산캠퍼스의 귀리 시험장에서 곤충병원성 진균에 감염된 파리가 발견되었다. 파리들은 날개를 뒤로 접은 채 매달려 있었다. 곤충 병원성 진균의 균사는 파리들의 배 부분에 부풀어 있었다. 28S ribosomal RNA 영역의 염기서열 분석 결과 곤충병원성 진균은 Entomophthora muscae로 확인되었다. 또한 cytochrome oxidase 영역의 염기서열 분석결과 숙주 곤충은 Delia platura로 확인되었다.
