서론
산림에서 발생하는 뽕나무버섯속(Armillaria)은 봄부터 가을에 걸쳐 활엽수나 침엽수의 생물이나 사물에 군생하며 전 세계에 분포한다[1]. 이 버섯들은 리그닌과 셀룰로오스를 둘 다 분해하는 백색부후균으로서, 아밀라리아 뿌리썩음병을 일으키는 산림병원균으로 기주식물 범위가 넓어서 침엽수, 활엽수, 목본덩굴식물, 초본식물에도 기생하는 부생균 또는 사물기생균으로서 존재한다[2, 3].
뽕나무버섯은 전 세계적으로 40여 종이 알려져 있고, 국내에서는 뽕나무버섯(A. mellea), 곤봉뽕나무버섯(A. gallica), 잣뽕나무버섯(A. solidipes = A. ostoyae), 뽕나무버섯부치(A. tabescens), 민뽕나무버섯(A. cepistipes) 로 6종이 보고된 바 있으나[3, 4] 최근 2017년에 뽕나무버섯부치(A. tabescens)가 Desarmillaria속으로 분리되어 5종으로 보고되었다[5]. 일반적으로 나무 그루터기에서 다발로 나서 ‘가다바리’라고 하여 종을 구분하지 않고 식용으로 판매되고 있고 약재인 천마의 증식재배에도 활용되며[6], 이 버섯의 추출물은 항산화 작용이 있다[7].
최근 사유림 경영을 선도하는 전문 임업인은 2005년 1,922명에 비하여 2016년 8,922명으로 약 4.3배 증가하였으며, 청정 임산물과 더불어 임업의 6차 산업화로 인하여 임업인의 산림소득에 대한 관심이 지속적으로 증가하고 있다[8]. 또한 간벌 등 숲의 가치를 높이기 위한 숲가꾸기 사업 후에 남겨진 벌목 그루터기에서는 이 뽕나무버섯류의 발생이 증가하고 있으므로 이들 뽕나무버섯속의 분포환경에 대한 연구가 필요하다.
A. ostoyae에서 명명법이 변경된 잣뽕나무버섯(A. solidipes)은 주로 잣나무와 참나무류, 뽕나무버섯(A. mellea)은 소나무와 참나무류, 곤봉뽕나무버섯(A. gallica)은 잣나무를 제외한 대부분의 나무에서 발생하는 것으로 보고되었다[9]. 잣뽕나무버섯은 양질사토에 배수가 잘되는 토양에서 발생량이 많았고[10], 곤봉뽕나무버섯은 기온 최저 3~23℃, 최고 15~26℃, 평균 9.9~17.5℃에 경사 15°에 양토로 이루어진 동향에서 주로 산발적으로 발생한다[11].
뽕나무버섯의 병원성은 종에 따라 상당히 다른 것으로 알려져 있다. 예를 들어, 잣뽕나무버섯(A. solidipes)은 일반적으로 병원성이 강한 반면, 곤봉뽕나무버섯(A. gallica)은 병원성이 약하다[12]. 따라서 뽕나무버섯류의 병원성 유무와 정확한 종 식별 기준, 산림 생태학적 및 생리학적 특성의 파악이 요구된다.
본 연구에서는 국내에 자생하는 잣뽕나무버섯과 곤봉뽕나무버섯의 형태적 특성, 자실체 발생지의 환경특성, 목재분해효소 특성의 차이를 알고자 하였다.
재료 및 방법
잣뽕나무버섯과 곤봉뽕나무버섯의 발생지 식생 특성 조사
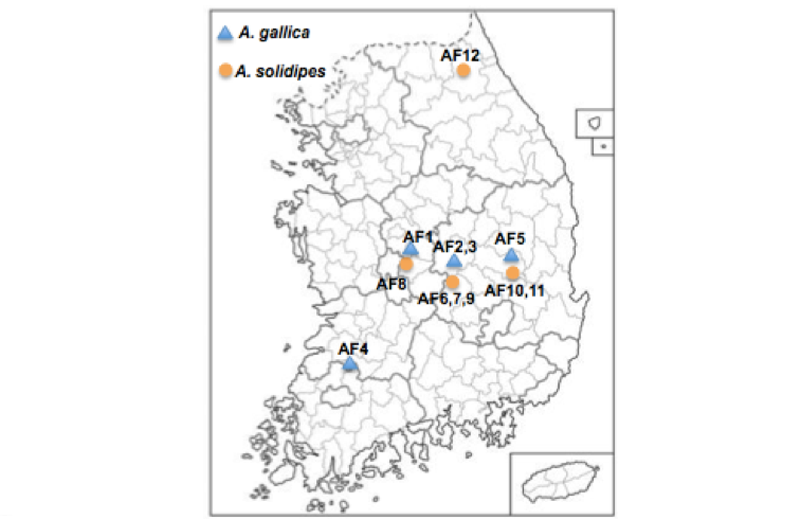
잣뽕나무버섯과 곤봉뽕나무버섯의 발생지 식생 특성은 2013년 9월부터 10월까지 경기 가평군 설악면, 강원 평창군 진부면, 충북 충주시 수안보면, 충남 계룡시 계룡산, 전북 완주군 모악산, 경북 문경시 대야산 등 6개 지역을, 2016년 9월부터 10월까지 강원도 인제군, 경북 영주시 비로봉, 충북 단양군 연화봉, 충북 보은군 등 4개 지역을 조사하였다(Table 1, Fig. 1).
식물상 조사
잣뽕나무버섯과 곤봉뽕나무버섯의 기주식물 및 주변 식생은 버섯이 발생하는 지점을 중심으로 10 × 10 m에 조사구에서 지형, 기주식물, 조사구 계층구조(교목층, 아교목층, 관목층, 초본층)을 기록하였다.
잣뽕나무버섯과 곤봉뽕나무버섯의 생물적 특성 조사
1) 자실체
잣뽕나무버섯과 곤봉뽕나무버섯의 형태학적 변이는 10개의 조사지에서 채집한 자실체로써 비교하였다. 채집한 자실체는 주름살, 갓, 대의 모양 및 색깔 등을 관찰하고, 갓의 직경 및 두께, 대의 길이 및 두께 등을 측정하였다.
2) 근상균사속
뽕나무버섯이 발생한 줄기와 수피에서 근상균사속을 채집하여 형태적 특성을 조사하였다. 기주식물 주변의 토양을 굴취삽으로 10~20 cm 정도 파내어 토양 속 근상균사속을 채취하였다. 이들 시료는 formalin-acetic acid-alcohol (FAA) 용액에 넣어 보하면서 해부현미경과 광학현미경으로 형태를 관찰하였다.
효소 활성
1) 균사 배양
두 종 균사체의 cellulase와 laccase 활성 비교를 위하여 potato dextrose agar (PDA) 평판 배지에서 25℃에서 21일 동안 배양하였다.
2) Cellulase 활성 측정
잣뽕나무버섯과 곤봉뽕나무버섯의 cellulase 활성은 carboxymethycellulose (CMC)를 기질로 사용하여 측정하였다. PDA에서 각각 순수분리 배양된 균사체를 직경 6 mm의 cork borer로 채취하여 CNY broth (1% CMC sodium salt, 0.5% NaCl, 0.5% yeast extract, 0.3% peptone, 0.2% (NH4)2HPO4, 0.05% MgSO4• 7H2O, 0.2% K2HPO4, pH 5.8)에 접종하고, 25℃에서 5일, 10일, 15일, 20일, 25일간 120 rpm으로 진탕배양 하였다. 효소활성은 Ghose [13]가 제시한 실험방법에 따라 조효소액 0.5 mL와 기질로 2% CMC 0.5 mL을 섞은 후 50℃에서 30분 동안 반응시켰다. 반응이 끝난 후 즉시 dinitrosalicylic acid (DNS) 3 mL을 첨가한 후 100℃에서 5분 동안 반응시켰다. 반응 후 증류수 20 mL을 첨가하여 0℃ 냉동저장고에 10분간 냉각시키고 UV-Vis를 이용하여 540 nm에서 흡광도로써 효소 활성을 측정하였다. 환원당 정량을 위해 glucose를 표준당으로 하여 0.1~2 g/mL로 정량곡선을 작성하였다. 효소의 활성은 Unit (U)로 나타냈으며, 1 U는 효소 0.5 mL이 30분 동안 1 μmol의 glucose를 생성하는 것으로 정의하였다.
3) Laccase 활성 측정
두 종의 laccase 활성 차이를 조사하기 위해 2,2'-azino bis (3-ethylbenzthiazoline-6-sulfonate, ABTS)를 기질로 사용하였다. PDA 배지에서 배양한 균사를 직경 6 mm의 cork borer로 3개씩을 YM broth (1% glucose, 0.3% malt extract, 0.5% peptone, 0.3% yeast extract, pH 5.8)에 접종하고 25℃에서 120 rpm으로 진탕배양하면서 5일, 10일, 15일, 20일, 25일에 배양액을 수집하여 효소활성도를 측정하였다. 이들 배양액을 miracloth에 여과하여 조효소액으로 사용하였다. Laccase 활성은 Haileka [14]이 제시한 방법으로, 조효소액 0.1 mL을 1 mL 50 mM acetate buffer (pH 3.5)와 1 mL 2 mM ABTS 용액을 혼합한 용액에 첨가하여 10분간 반응시켰으며, ABTS의 산화물은 UV-Vis를 이용하여 420 nm (ε = 36,000 M⁻-¹ cm ⁻-¹)에서 흡광도를 측정하였다. 효소의 활성은 Unit (U)로 나타냈으며, 1 U는 효소 0.1 mL가 10분 동안 1 μmol의 ABTS를 산화시키는 것으로 정의하였다.
결과 및 고찰
잣뽕나무버섯과 곤봉뽕나무버섯의 발생지 식생 특성
잣뽕나무버섯과 곤봉뽕나무버섯의 발생 시기는 9월 중순부터 10월 초였다. 이들 버섯의 장소는 주로 계곡 주변의 습윤한 지역이었으며, 공통적으로 고사목 주변이나 수세가 약한 나무, 그루터기, 토양에서 발생하였다.
잣뽕나무버섯(A. solidipes)은 잣나무, 소나무, 낙엽송, 졸참나무, 굴참나무, 밤나무, 신갈나무, 개옻나무, 물박달나무, 상수리나무 등을 기주식물로 하여 사면, 능선, 산정 등에서 발생하였으며 발생 해발고도 107~1,396 m로 조사되었다. 잣뽕나무버섯이 발생한 지역의 교목층은 잣나무, 소나무, 굴참나무, 밤나무, 신갈나무 등이 우점하였고, 아교목층은 밤나무, 개옻나무, 졸참나무, 잣나무, 전나무, 벚나무를 비롯하여 신갈나무, 낙엽송, 물푸레나무, 진달래 등이 분포하였다. 관목층은 국수나무, 화살나무, 진달래, 매자나무, 청미래덩굴, 생강나무, 병꽃나무 등이 나타났으며, 초본층은 개고사리, 국수나무, 주름조개, 조릿대, 취나물 등이 우점하였다(Table 2). 국내 자생하는 잣뽕나무버섯은 주로 잣나무와 참나무류에서 발생하는 것으로 보고되었으나[9], 일부 지역에서는 잣나무림에서만 발생하는 것으로 보고되었다[15]. 본 연구에서는 잣뽕나무버섯이 산림 내에서 우점하고 있는 교목층에 대해 넓은 기주범위를 보였는데, 이는 산림에서 수관 면적이 넓은 교목층을 죽게 하여 빛과 물이 하층식생에 들어와서 자연천이를 촉진시키는 기능을 할 것으로 생각된다. 또한 해발고도에 관계없이 저지대부터 고지대까지 발생하였는데, 잣뽕나무버섯의 최적 발생환경은 춥고 건조한 지역[16], 생장환경의 최적 해발고도는 1,000~1,600 m이다[17]. 이 종은 상대적으로 양분이 부족하고 기온이 낮으며 높은 고도의 산림에서도 수세가 약한 나무나 고사된 나무 등에 침입하고 유기물을 분해하여 양분 순환을 촉진시킴으로써 생물 다양성을 증가시키는데 중요한 역할을 할 것으로 생각된다.
|
Table 2. Structural characteristics and composition of vegetation at Armillaria solidipes fruiting sites 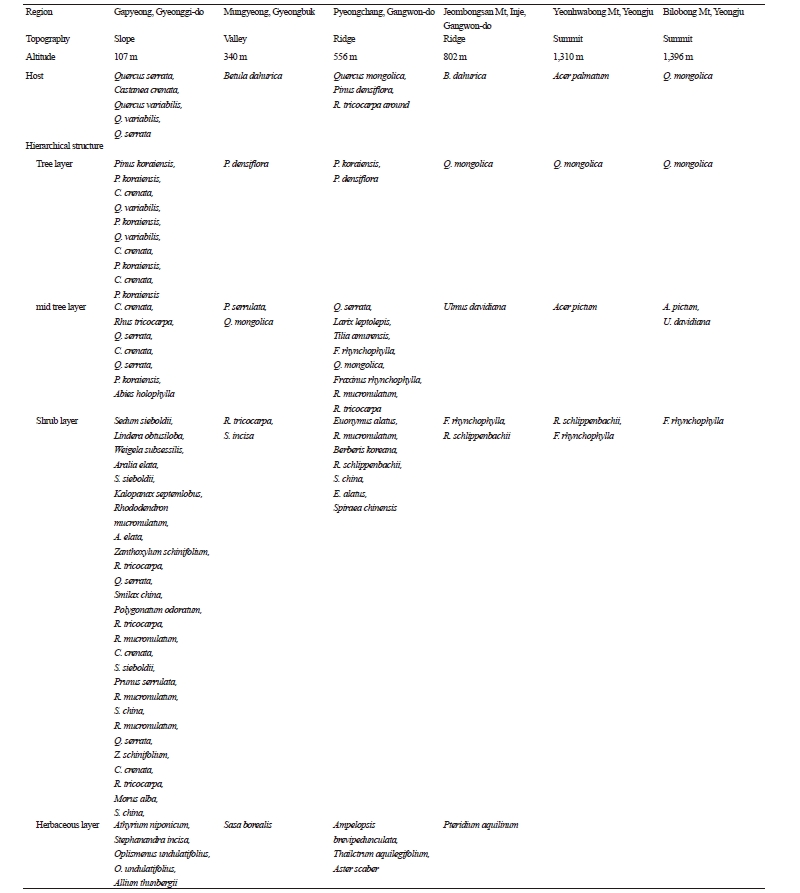
|
곤봉뽕나무버섯(A. gallica)은 소나무, 신갈나무, 물푸레나무를 기주식물로 하여 산정, 사면, 평지 등에서 조사되었고 발생 해발고도는 119~556 m 였다. 이 버섯 발생지의 교목층은 소나무, 리기다소나무, 굴참나무, 물푸레나무 등이 우점하였고, 아교목층은 헛개나무, 생강나무, 산사나무, 느릅나무, 층층나무, 당단풍나무 등이 출현하였으며, 관목층은 국수나무, 머루, 화살나무, 층층나무, 싸리, 물푸레나무, 쥐똥나무, 노린재나무 등이, 그리고 초본층에서는 고사리, 제비쑥, 사초, 쐐기풀, 애기똥풀 등이 관찰되었다(Table 3). 곤봉뽕나무버섯의 분포는 해발고도와 높은 연관성이 있는데[18], 프랑스 Massif Central 부근에서 해발고도 850 m에서는 발생하였지만 1,100 m에서는 드물었고, 1,400 m 이상에서는 발생하지 않았다[17]. Tomšovský 등[19]의 연구결과와 마찬가지로 곤봉뽕나무버섯이 고산지대에는 출현하지 않고 따뜻한 저지대를 선호하는 것으로 나타났다. Yoo 등[11]에 따르면 곤봉뽕나무버섯 발생지는 평균기온 9.9~17.5℃, 경사 15° 정도의 동향으로 물 빠짐이 좋은 양토로 이루어져있고, 수분이 풍부한 도랑 중심으로 양쪽 옆이다.
|
Table 3. Structural characteristics and composition of vegetation at Armillaria gallica fruiting sites 
|
잣뽕나무버섯과 곤봉뽕나무버섯의 생물학적 특성
1) 자실체
잣뽕나무버섯 Armillaria solidipes Peck, Bulletin of the Torrey Botanical Club 27 (12): 611 (1900)
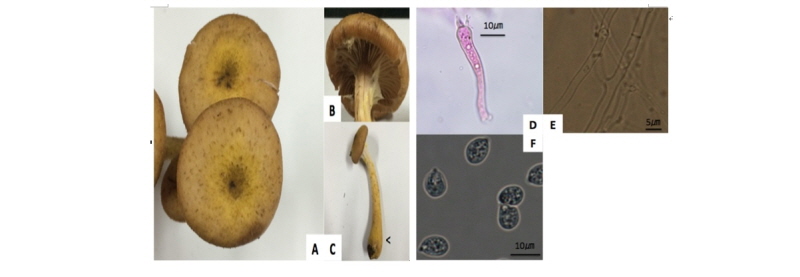
갓의 모양은 초기에 원뿔형에서 성숙하면 편평형으로 전개되며 색은 주로 연한 황갈색이고, 흐린 노란주황색, 갈색, 탁한 갈색 등으로 다양한 색을 띄고, 성숙 시에는 얼룩덜룩한 적갈색을 띄었다(Fig. 2B). 갓 인편의 색은 주로 흑갈색이였으며(Fig. 2A), 주름살은 약간 촘촘하면서 연한 황갈색을 나타냈다(Fig. 2D). 갓의 직경은 10.3~94.8 mm, 두께는 1.9~16.4 mm 이었다. 대색은 회갈색, 연한 황갈색이 주로 나타냈으며, 갈색~검은색 털이 있었고(Fig. 2C), 대는 13.8~100.7 × 10.0~37.2 mm 였다. 자실체의 갓직경/대길이의 비는 약 0.66, 갓직경/대굵기의 비는 약 5.82 였다(Table 3). 담자기 너비는 약 5.3~8.8 μm 이고, 포자는 5.35~8.84 × 4.7~6.9 μm, 장타원형, 흰색이며 포자의 장경/단경 비는 1.45 정도였다. PDA 평판 배지에 25℃에서 21일 동안 배양한 균사세포의 크기는 21.7~148.6 × 1.7~4.3 μm 였다(Fig. 2F~2G).
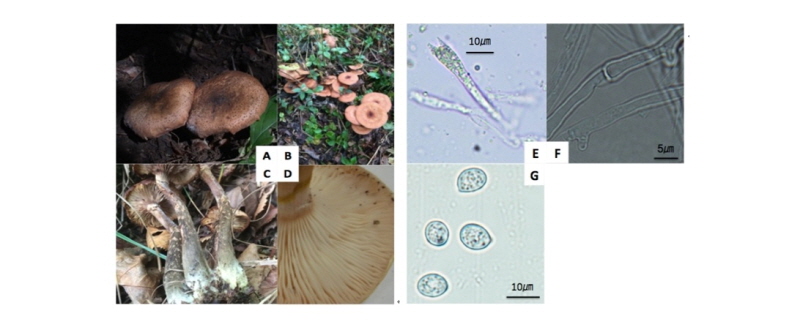
Fig. 2. Fruit body of Armillaria solidipes. A, The pileus covered with blackish brown scale; B, The pileus color is reddish brown when maturity; C, Stipe covered with brown~black hair; D, The lamellae is close; E, Basidium (ⅹ400), 5.3~8.8 μm; F, Hypha (ⅹ400); G, Ellipsoid spore (ⅹ400), 5.35~8.84 μm.
곤봉뽕나무버섯 Armillaria gallica Marxm., Bulletin de la Société Mycologique de France 103 (2): 152 (1987)
갓의 모양은 초기에는 반원형에서 성숙하면 편평형으로 전개되며 갓의 중앙부분과 가장자리가 대부분 황갈색을 띄고, 인편의 색은 흐린 적갈색이었다(Fig. 3A). 주름살은 성기면서 내린형으로 흰 분홍색이었으며(Fig. 3B) 갓의 직경은 15.4~69.4 mm, 두께는 0.7~6.5 mm이었다. 대는 35~114.1 × 2.5~8.7 mm, 곤봉형으로 황색의 털이 있으며(Fig. 3C) 탁한 갈색, 연한 황갈색, 회갈색 등으로 다양하게 나타났다. 자실체의 갓직경/대길이의 비는 약 0.7, 갓직경/대굵기의 비는 약 7.7 이었다(Table 3). 담자기 너비는 5.4~8.9 μm, 포자는 6.8~9.7 × 4.0~6.5 μm, 장타원형, 흰색이며 포자의 장경/단경 비는 약 1.5 정도였다. PDA 평판 배지에 25℃에서 21일 동안 배양한 균사는 한 가지 형태로 클램프가 없었으며, 20.8~55.4 × 2.5~4.8 μm 크기였다(Fig. 3D~3F).
두 종간의 형태적 특징 차이는 갓색, 직경, 주름살, 대의 털색과 기부 형태였다. 잣뽕나무버섯의 갓 색은 대부분 적갈색인 반면에, 곤봉뽕나무버섯은 황갈색이었고, 잣뽕나무버섯이 곤봉뽕나무버섯보다 갓 직경이 넓고 주름살은 촘촘했다. 대의 털색은 잣뽕나무버섯은 갈색~검은색인 반면에, 곤봉뽕나무버섯은 황색이었고 대의 기부가 곤봉형이었다.
뽕나무버섯속의 근상균사속
자연 상태의 근상균사속은 토양 속으로 10 cm 이내에 뿌리처럼 여러 갈래로 갈라지면서 넓게 분포하여 수목 뿌리에 접촉해 있었다(Fig. 4). 근상균사속은 지상에서는 수목의 내수피를 점유하여 자랐으며 주로 납작한 형태를 나타냈다(Fig. 4A, 4C). 근상균사속이 내수피까지 들어가 생장하였으나 목부 내부까지 침입하는 것은 확인하지 못하였다. 토양 속에 자라는 근상균사속은 대부분 원통형이며(Fig. 4B), 자실체가 붙어있는 부분에서 돌기가 있고 다른 부분보다 두꺼운 형태였다(Fig. 4D). 이는 자실체로 근상균사속에 의해 많은 양의 수분과 영양분이 이동할 것으로 생각된다. 근상균사속은 주로 황갈색으로, 생장이 왕성한 것은 딱딱하고 그 속이 균사로 꽉차있어서 잘 끊어지지 않았지만 노쇠한 근상균사속은 납작한 형태이고, 속이 비어있어서 쉽게 끊어졌다.

Fig. 4. External and internal structures of rhizomorph of Armillaria spp. A,C Rhizomorphs in the cambium and inner bark(^) of rotten butt; B, Subterranean system of cylinder shape rhizomorph of Armillaria growing within 10 cm of soil; D, The swelling of rhizomorph belonging to a A. gallica fruiting body is due to the large amounts of water and nutrients; E, Longitudinal section of rhizomorph with mesh formation(>>) in outside and light mycelial strand(>) in the middle; F, The vessel hyphae of inner medulla and outer medulla cell size are different on the cross section of rhizomorph brown outer laters.
자연 상태의 근상균사속 종단면은 여러 층으로 구성되어있고, 중앙부에는 연한 갈색의 균사무리들이 분포했다(Fig. 4E). 근상균사속의 횡단면을 관찰한 결과, 수질외층은 8.6~12.7 μm의 두꺼운 세포벽과 함께 3.7~6.3 μm의 매우 작은 지름의 균사가 분포하여 세포의 빈 공간이 거의 없었다. 수질내층은 3.0~7.1 μm의 상대적으로 얇은 벽에 22~41.8 μm의 큰 지름의 균사가 분포하였다(Fig. 4F).
Redfern [20]은 뽕나무버섯(Armillaria mellea)의 경우 근상균사속이 토양 깊이 2.5~20 cm에서 집중적으로 발생하고, 1년당 1 m 생장하는 것으로 보고하였다. 근상균사속의 생장 방향은 산소와 이산화탄소 농도 및 토양 수분상태에 관련있다[21]. 근상균사속은 수목의 내수피 부근에서 주로 발견되었는데, 내수피는 광합성에 의해 생산된 양분물질의 통로 역할로 양분이 많기 때문으로[22] 생각된다. Yafetto [23]는 도관과 유사한 균사를 ‘도관균사’라고 칭했는데, 이곳을 통해 영양분, 삼투물질, 산소 등을 근상균사속의 선단으로 이동시키며 도관균사 주변에 세포벽이 두껍고, 세포 내용물이 가득 찬 균사들은 건조와 불리한 환경에서 도관균사를 보호한다고 논의하였다.
효소 활성
1) Cellulase 활성 차이
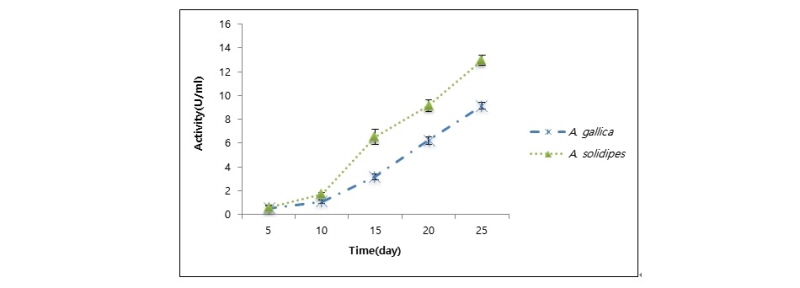
잣뽕나무버섯(A. soldipes)과 곤봉뽕나무버섯(A. gallica)의 cellulase 활성을 비교한 결과, 접종 후 25일 동안 각각 61.0 ± 1.6 U/mL, 61.6 ± 1.1 U/mL 으로 차이가 거의 없었다(Fig. 5).
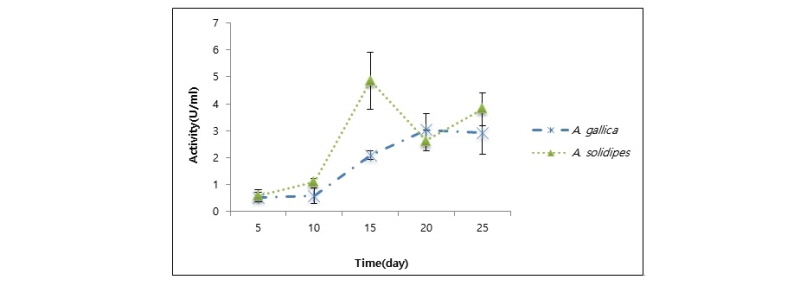
두 종의 cellulase 활성은 배양 후 5일부터 서서히 증가하다가 15일에서 곤봉뽕나무버섯은 21.1 ± 3.1 U/mL, 잣뽕나무버섯은 18.8 ± 2.0 U/mL로 최대를 보인 후, 줄어들었다(Fig. 6).
일반적으로 cellulase는 endo-β-1,4-glucanase, exo-β-1,4-glucanase, β-glucosidase 등 3가지로 구성된 복합효소이다. endo-β-1,4-glucanase은 셀룰로오스 내부를 분해해서 결정을 붕괴하는 역할로 무작위로 작용한다. cellulose chain을 생성하면 exo-β-1,4-glucanase가 cellobiose로 분해하고, β-glucosidase가 최종적으로 이 cellobiose를 2분자의 glucose로 전환시킨다[24]. cellobiose는 exo-β-1,4-glucanase의 활성을 촉진하기도 하고 저해하며, cellobiose 이용률은 CM-cellulase 활성에 영향을 미친다[25]. 이런 식으로 cellobiose가 축적되면 섬유소 분해율은 자동적으로 느려진다[26]. 따라서 배양 15~20일 이후부터 cellulase 활성이 감소한 것은 cellobiose의 축적으로 인한 섬유소 분해 조절에 의한 것으로 생각된다. Cellulose의 분해산물인 glucose, xylose, oligosaccharide 등은 산업적 뿐만 아니라 학문적으로도 매우 중요한 의미를 갖고 있으며, 그 중 특히 endo-β-1,4-glucanase (cellulase)가 효용가치가 매우 높다[27]. Cellulase, laccase와 같은 목재분해효소는 뽕나무버섯균이 처음으로 뿌리 수피를 관통한 후 형성층과 2차 사부를 관통하는데 도움을 준다[28]. 또한 Smith-White와 Summerell [29]에 따르면 뽕나무버섯은 특징적으로 cellulase를 포함하는 세포분해효소를 방출하는데 이는 1차 및 2차 식물세포벽을 분해하므로 기주의 심각한 피해 과정이다.
식물의 병원성 발현은 병원균에 의해 분비되는 물질과 식물의 방어물질 사이에 발생하는 생화학적 반응의 결과이다. Knogge [30]에 따르면 발병하는 동안 균류는 기주의 방어 장벽을 관통하기 위해 cutinases, cellulases, pectinases, proteases를 포함하는 가수분해효소를 분비하고, 그 후 종종 병원성 물질을 발생하여 병을 일으킨다. 그러므로 아밀라리아 뿌리썩음병을 일으키기 위해 일단 수목에 침투를 하는 것이 중요하므로 cellulase 활성이 병원성을 일으키는데 영향을 줄 것이라고 생각된다.
2) Laccase 활성 차이
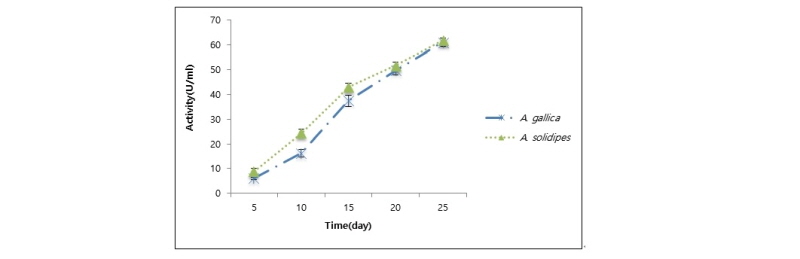
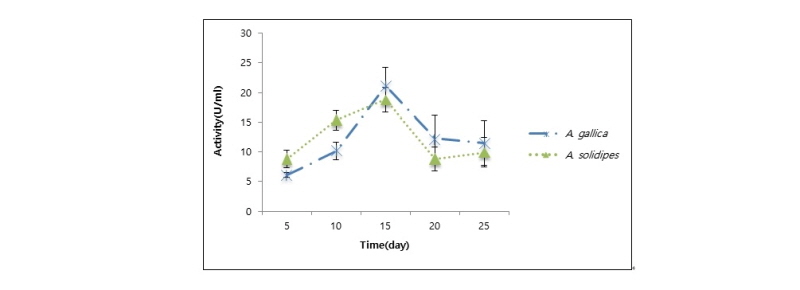
잣뽕나무버섯(A. soldipes)과 곤봉뽕나무버섯(A. gallica)의 laccase 활성을 비교한 결과, 접종 후 25일 동안 잣뽕나무버섯의 균주가 12.94 ± 0.4 U/mL로 곤봉뽕나무버섯의 9.14 ± 0.3 U/mL 보다 높았다(Fig. 7).
두 종의 laccase 활성은 배양 후 5일부터 서서히 증가하다가 잣뽕나무버섯은 15일에서 4.84 ± 1.0 U/mL로 최대의 활성을 보인 후 20일에는 활성이 감소하다가 25일에는 활성이 소폭 증가하였다. 반면 곤봉뽕나무버섯은 20일에서 3.03 ± 0.6 U/mL로 최대의 활성을 보였고, 서서히 감소하였다(Fig. 8).
Worrall 등[31]에 따르면 laccase 활성은 근상균사속의 형성과 양의 상관관계를 보이며 laccase 활성이 배양 후 15일에 최대치를 나타날 때 근상균사속의 생장률이 가장 높았다. 본 연구에서 PDA 배지에 배양할 때 근상균사속의 형성이 약 7~10일에 형성되었으며 약 15~20일경에 생장률이 높은 것을 비추어볼 때, 잣뽕나무버섯과 곤봉뽕나무버섯의 laccase 활성이 15~20일에 가장 높게 나타난 것은 근상균사속의 형성과 관계된 것으로 유추할 수 있다. laccase는 멜라닌 색소와 연합하여 세포와 세포를 접착하는 기능을 하여 단순한 균사체보다 구조적으로 더 단단하게 중합한다[32]. 따라서 근상균사속의 형성은 수많은 균사들의 결합으로 이루어진 것이므로 laccase의 활성이 증가한 것이다.
식물 병원균에서 laccase는 중요한 발병인자로 인식되고 있다. Botrytis cinerea, Cryphonectria parasitica, Cryptococcus neoformans은 발병을 위해 laccase가 필요하고, 이 효소는 식물의 방어기작을 해독한다[33-35]. 또한 백색부후균은 나무에 침투할 때, 우선적으로 셀룰로오스보다 리그닌을 분해하므로 laccase 활성이 중요하다[36]. 그러므로 laccase 활성이 높은 잣뽕나무버섯이 곤봉뽕나무버섯보다 수목에 침투하는데 유리하여 아밀라리아 뿌리썩음병을 일으키는데 도움을 줄 것으로 생각된다.
뽕나무버섯은 대상목이 병충해나 간벌, 벌채 등으로 쇠약해져서 방어능력이 낮아지면 신속히 침투해 들어가서 죽이는 아밀라리아 뿌리병의 병원균인 동시에 죽은 수목을 분해하여 양분을 순환시키는 부생균이다[1]. 유기물 분해로 인한 물질 순환과 생태계 내에 에너지 이동은 필수적이며[37] 식물의 분해로 얻은 무기물은 생태계에 매년 들어가는 필수 영양소의 양이 일반적으로 제한되어 있기 때문에 식물의 생산성에 결정적으로 중요하다[38-40]. 뽕나무버섯은 생태계 내에서 자연간벌로 경쟁을 완화하고, 산림천이와 양분순환을 촉진시키고 종다양성과 생물다양성을 높이는 역할을 하는데[1] 이 버섯에게 리그닌을 분해할 수 있는 laccase 활성이 매우 중요하다고 생각된다.
적요
본 연구는 국내에 자생하는 형태적으로 식별이 어려운 잣뽕나무버섯(Armillaria solidipes)과 곤봉뽕나무버섯(Armillaria gallica)의 형태적 특성, 자실체 발생지의 환경특성, 목재분해효소를 알아보았다.
잣뽕나무버섯은 해발고도 107~1,396 m에서 소나무, 졸참나무, 밤나무 등 8종에서 발생하였고, 곤봉뽕나무버섯은 해발고도 119~556 m에서 소나무, 물푸레나무 등 3종에서 발생하여 잣뽕나무버섯이 곤봉뽕나무버섯보다 분포와 기주의 범위가 넓었다. 형태는 잣뽕나무버섯의 자실체는 주름살이 빽빽하고 대에 갈색~검은색 털이 있으나, 곤봉뽕나무버섯은 대에 황색 털이 있고, 기부모양이 곤봉형이었다. 목재분해효소 cellulase의 활성은 두 종간의 차이가 없었으나 laccase의 활성은 잣뽕나무버섯(12.94 ± 0.4 U/mL)이 곤봉뽕나무버섯(9.14 ± 0.3 U/mL)보다 높았다.
따라서, 잣뽕나무버섯은 주름살이 빽빽하고 대에 갈색~검은색 털이 있으며, 곤봉뽕나무버섯과 구분하여 다양한 고도에서 넓은 기주범위를 보이고, 수목을 분해할 수 있는 능력이 크기 때문에 다양한 환경에 적응한 것으로 생각된다.