사상균(filamentous fungi)은 대부분 포자를 통하여 번식한다[1, 2]. 사상균의 무성 포자는 휴면(dormant) 상태를 유지하다가 적합한 환경에 노출되면 대사가 활발히 일어나는 세포로 전환된다. 무성 포자는 발아 과정 동안 휴지기 포자(resting spore)에서 활성 포자(active spore)로 바뀌게 되는데, 발아 초기에는 포자가 등장 생장(isotropic growth)을 하여 포자의 직경과 무게가 증가하는 형태적 변화가 관찰된다[3]. 이후 극성 성장이 일어나 포자에서 발아관이 형성된 다음 길이 성장을 하여 균사를 형성한다[4]. 포자의 발아는 사상균이 동식물에 병을 일으키는데 핵심적인 과정이다. 포자의 발아를 억제하게 되면 사상균에 의한 병의 확산을 제어할 수 있으나, 발아 과정에 대한 이해는 부족하다.
사상균에서 신호 전달 물질인 cAMP에 의해 활성화된 PKA가 발아 개시에 관여하며[5], Ras를 통한 MAPK cascade 전달 과정이 발아 개시를 조절한다고 보고되어 있고[6, 7], nimA, phoA, phaB와 같은 세포분열 관련 유전자나 mitosis를 조절하는 유전자가 포자의 발아에서 역할을 한다는 결과도 있다[8, 9]. 이 연구들은 포자가 발아를 시작하는 단계에서 포자의 내부에서 일어나는 유전자의 역할에 초점이 맞추어져 있으나, 포자의 발아를 시작하게 하는 신호로 작용하는 것이 무엇이며 그 신호가 어떤 경로로 포자 안으로 전달되는지에 대한 연구는 이루어져 있지 않다. 본 연구의 초점은 포자의 발아를 개시하는 신호의 존재 여부를 알아보기 위하여 시도되었다.
본 연구에서는 Fungal Genetics Stock Center (FGSC)에서 분양받은 Aspergillus nidulans FGSC A4 Ve+ 균주를 완전배지에서 배양하여 포자를 얻어 사용하였다. 무성포자의 현탁액을 조직배양기(tissue cure plate, 6well)에 103개/well이 되도록 분주한 다음 37℃에서 배양 하고, 일정 간격으로 발아하는 무성 포자의 개수를 혈구측정기(hematocytometer)와 위상차 현미경(CKX31; Olympus, Tokyo, Japan)으로 관찰하여 발아율을 계산 하였다. A. nidulans의 무성 포자에 증류수를 가하였을 때에 Fig. 1에서 보듯이 6시간 이상이 되어도 전혀 발아하지 않았다. 수분의 존재 만으로 포자의 발아 조건이 충족 될 수 없으며 포자 발아를 위한 어떤 물질이 필요하다는 것을 알 수 있었다[10]. 이와는 달리 같은 조건에서 포자에 5% 글루코오스(Sigma-Aldrich, St. Louis, MO, USA) 용액을 가하면 2시간 후부터 발아관이 생성되는 포자가 관찰되기 시작하였으며 6시간째에는 발아율이 98% 이상으로 나타났다. 이 결과를 토대로 포자가 발아하기 위해서는 외부에서 발아 신호로 작용하는 물질이 존재하여야 하며, 이 조건에서는 글루코오스가 외부 신호로 작동하였다는 가정을 세울 수 있었다. 글루코오스 이외의 당도 포자를 발아 시키는지를 알아보기 위해 Table 1에서와 같이 여러 가지 당의 용액에서 포자의 발아율을 조사하였다. 포자에 프록토오스(Sigma-Aldrich) 용액(5%)을 가하여 주고 4시간째와 6시간째에 포자의 발아율을 조사한 결과 포자의 발아는 글루코오스 용액을 가하였을 때와 유사한 양상을 보였다. 단당류뿐 아니라 이당류인 수크로오스(Sigma-Aldrich), 락토오스(Sigma-Aldrich)와 말토오스(Sigma-Aldrich)의 용액에서도 4시간째와 6시간째의 발아율은 단당류를 가했을 때와 큰 차이를 보이지 않았다. 이와는 달리 다당류를 가해준 경우에는 가해준 다당류의 종류에 따라 포자의 발아율이 현저한 차이를 보였다. 녹말(Sigma-Aldrich) 용액에서는 포자의 발아율이 글루코오스 용액을 가하였을 때보다 감소하는 경향을 보여 4시간째에 22%를, 6시간째에는 70%를 나타내었다. 글루코오스가 α-1,4 결합으로 연결된 다당체인 녹말 용액에서 글루코오스 용액보다 낮은 발아율을 나타낸 것은 구조적 차이 때문일 것으로 추측되었다. 또 다른 다당류인 이눌린(Sigma-Aldrich)의 용액을 가했을 때에는 포자의 발아율이 현저히 떨어졌으며, 발아 시작 후 4시간째에는 6%의 포자만이 발아 하였고 6시간째가 되어도 발아율은 30%를 넘지 못하였다. 프록토오스 용액에서의 포자의 발아율이 92%이었으나 프록토오스가 β-1,2 결합으로 연결된 다당체인 이눌린 용액에서는 현저한 차이를 나타내었다. 이 결과는 당의 구조가 포자의 발아를 일으키는 외부 신호의 화학적 구조가 중요할 것이라는 것을 나타내준다. 다당류 용액에서의 발아율이 낮은 것과 다당류의 종류에 따라 포자의 발아율에 차이가 나는 것은 외부 신호로서 작용하는데 단당류나 이당류보다 불리한 구조를 가졌기 때문으로 해석되었다. 따라서 글루코오스 뿐만 아니라 여러 가지 당들이 포자의 발아를 개시하는 외부 신호로 작용하며 화학적 구조를 인식하는 기구가 표자 표면에 있을 것이라는 예상을 가능케 하였다. 외부 신호의 구조적 차이에 의해 발아가 영향을 받는지를 알기 위해 D-형과 L-형의 아라비노오스(Sigma-Aldrich) 용액에서 포자의 발아를 관찰하였다. D-형의 아라비노오스 용액을 가해준 포자에서는 4시간째와 6시간째의 발아율은 0%를 나타내었다. 포자에 D-아라비노오스 용액을 가해준 후 2시간이 지나도 부품 현상 조차 관찰되지 않은 반면 L-아라비노오스 용액을 가해준 포자는 정상적인 발아율을 보였다(Fig. 1). 이 결과로부터 당은 발아 개시를 위한 외부 신호로 작용하며, 당의 구조가 발아에 중요한 역할을 하는 것을 알 수 있었다.
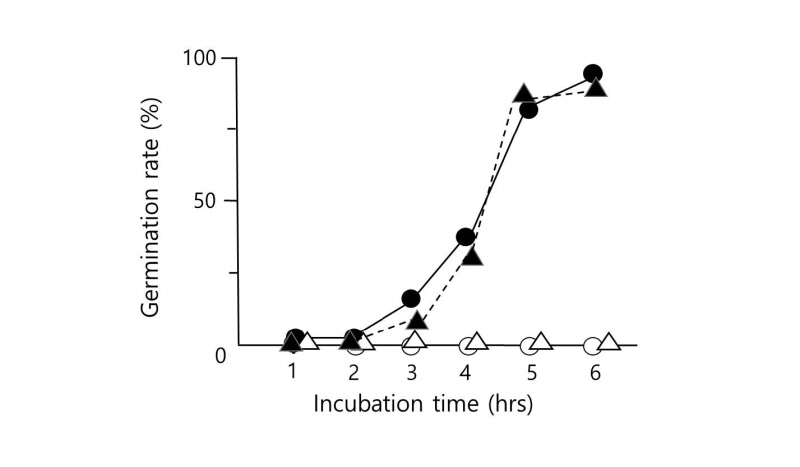
Fig. 1. Germination rate of Aspergillus nidulans spores in the presence of sugar. Asexual spores of A. nidulans were incubated in the solution of water (○), 5% of glucose (●), D-arabinose (△), and L-arabinose (▲) at 37℃, respectively. Germination rate was calculated by counting the spores formed germ tubes
|
Table 1.The germination rate of Aspergillus nidulans spores incubated in the presence of various sugars 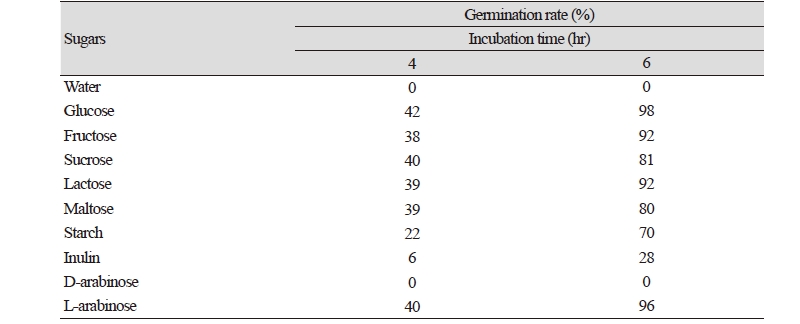
|
|
|
Germination rate was calculated after incubation for 4hr and 6hr, respectively. |
|
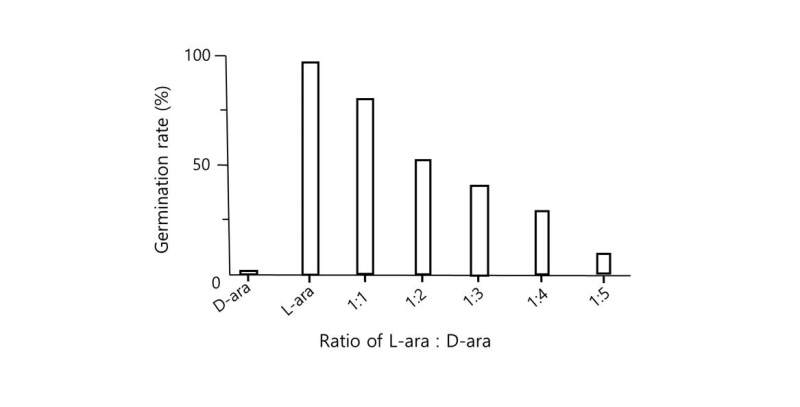
D-아라비노오스 용액에서는 포자가 발아하지 못하는 반면에 입체 이성질체인 L-아라비노오스는 발아의 신호로 작용한다는 결과는 포자의 표면에 신호가 결합할 수 있는 수용체가 있을 가능성을 시사해 준다. 외부 신호가 수용체에 결합할 것이라는 가정을 확인하기 위해서 입체 이성질체인 D-아라비노오스와 L-형의 아라비노오스가 수용체에 경쟁적으로 작용하는 지의 여부를 알아보았다. 포자를 L-아라비노오스와 D-아라비노오스의 비율을 달리한 용액에 각각 가하고 포자의 발아율을 조사한 결과 Fig. 2에서와 같이, L-아라비노오스 용액에서는 96%의 발아율을 보이는 것과는 달리 L-아라비노오스와 D-아라비노오스의 비가 1:1로 섞은 용액에서는 포자의 발아율이 84%로 감소하였고, D-아라비노오스의 비율이 높아질수록 포자의 발아율은 감소하여, 그 비가 1:5가 되었을 때에는 6시간 방치한 후에도 단지 12%의 발아율을 보였다. 이 결과에서 D-아라비노오스는 L-아라비노오스가 포자 표면 수용체에 결합하는 것을 억제하는 것으로 관찰되었다.
포자가 발아하기 위해서 당과 같은 물질이 필요하다는 결과는 포자의 발아에 에너지가 필요하기 때문일 것이라는 예측도 가능하지만, A. nidulans가 분해하여 에너지로 이용할 수 없는 이눌린 용액에서도 비록 발아율은 낮으나 발아가 일어난 것으로 미루어 보아 가해준 당이 발아에 필요한 에너지 생산에 이용되지 않을 가능성이 크다고 볼 수 있다. 이를 알아보기 위하여 포자에 글루코오스 용액과 L-아라비노오스 용액을 가한 다음 즉시 원심분리하여 가해준 당을 제거하고 충분한 양의 증류수로 3회 세척하는 과정을 5분 이내에 실행하고 이를 방치하였다. Fig. 3에서와 같이 글루코오스와 L-아라비노오스에 5분간 노출되었던 포자는 당을 가하지 않은 증류수에서 발아관을 형성하였고, 발아율은 80% 정도에 이르렀다. 이 결과는 가해준 당이 대사되어 발아에 필요한 에너지원으로 사용되는 것이 아니라 외부 신호로서 작용한다는 것을 뒷받침해준다. 종합적으로 볼 때, 가해준 당은 포자 표면에 존재할 것으로 보이는 수용체에 결합하여 포자 내부에 신호를 전달하여 발아에 필요한 단백질의 활성화와 유전자의 발현이 일어나게 할 것으로 예측되었다.
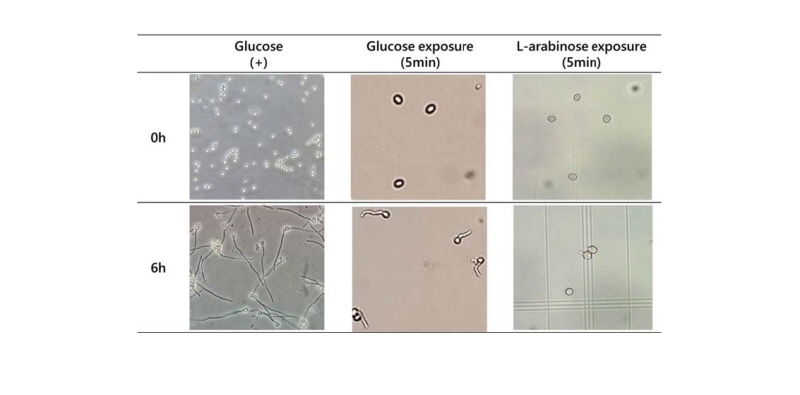
Fig. 3. Germination rate of Aspergillus nidulans spores treated with glucose and L-arabinose for short period. Asexual spores were treated with 5% of glucose and L-arabinose for 5 min, respectively. After washing out 3 times with water, spores were incubated in water without sugar for 6 hr. The germ tubes were observed by inverted microscopy after incubation (ⅹ400).
당과 같은 물질이 포자 표면에 결합할 수 있는 수용체가 존재할 것으로 예측되므로, 그 수용체가 단백질인지를 알아보았다. 포자에 1 mL의 10 mM Tris-HCl 완충용액(pH 8.0)을 가하여 주고 대조군에는 1 μg의 BSA를, 시험군에는 같은 양의 트립신(trypsin)을 가하고 37℃에서 4시간 방치하였다. 이를 증류수로 3회 세척하고 회수한 포자에 각각 5%의 글루코오스 용액을 가한 다음 시간에 따른 발아율을 조사하였다. Fig. 4에서 보듯이 대조군에서는 포자가 정상적으로 발아하였으나, 트립신을 처리한 시험군에서는 방치 시간이 경과하여도 발아율이 저조하였다. 발아 개시 6시간째에는 대조군에서는 92%의 발아율을 보였으나 시험군에서는 22%의 발아율이 관찰되었다. 트립신 처리로 인해 포자 표면에 존재하는 단백질이 일부 가수분해 되어 당과 결합할 수 없기 때문에 발아율이 감소하는 것으로 해석하였다. 트립신을 처리한 대조군에서도 한번 발아를 한 포자의 균사 성장은 정상적으로 일어났다.
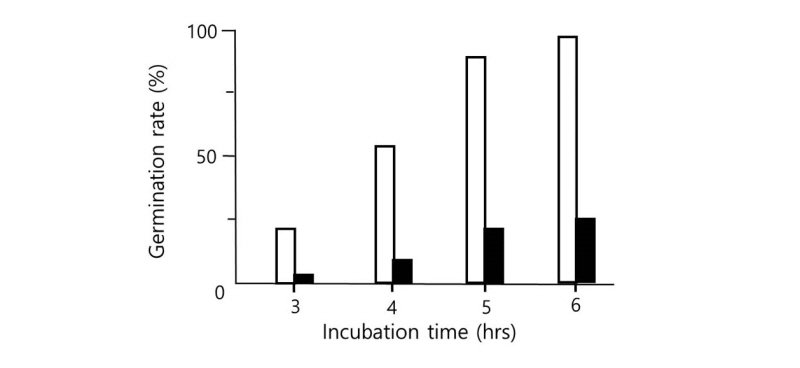
Fig. 4. Germination rate of Aspergillus nidulans spores treated with trypsin. Spores were incubated with trypsin for 2 hr. After washing out added trypsin, spores were further incubated in the presence of 5% glucose at 37℃ (□). The spores treated with BSA instead of trypsin were used as control (■).
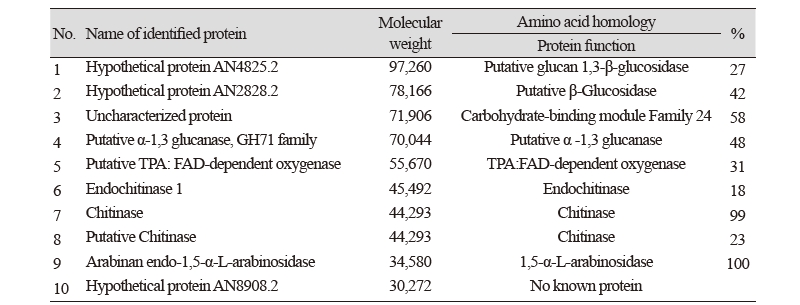
포자 표면에 어떤 단백질이 존재하는 지를 알기 위해 포자 표면에서 단백질을 용출하였다. 포자에 1 M의 NaCl이 포함된 10 mM Tris-HCl (pH 7.2) 완충용액을 가하여 주고 10분간 흔들어 준 다음 3시간 방치하여 추출한 포자 표면의 단백질을 용출하였다. 포자를 제거한 다음 여기에 trichloroacetic acid (TCA)의 최종 농도가 10%가 되도록 가하여 준 다음 침전된 단백질을 원심분리로 회수하고, 3회 5% TCA로 세척하고 최종적으로 에테르(ether)로 세척하였다. 침전된 단백질을 10 mM Tris-HCl (pH 7.2)에 녹인 후 SDS-겔 전기영동하여 단백질을 분리한 다음 은염색(silver staining; BioRad silverstaining kit; BioRad, Hercules, CA, USA)으로 단백질을 확인하였다. 같은 방법으로 트립신으로 처리한 포자에서도 단백질을 용출하여 비교하였다(Fig. 5). Fig. 5에서 보듯이 포자 표면에서 용출된 단백질의 띠는 16종 이상으로 확인되었다. 트립신으로 처리한 경우에는 트립신에 의해 분해되어 표면 단백질의 양이 줄어들었으나, 트립신 처리로 인해 새로 생긴 단백질의 띠는 관찰할 수 없었다. 포자 표면에 존재하는 단백질을 확인하기 위하여 단백질의 띠를 하나씩 분리하여 MALDI-TOF mass spectrometry (MALDI-TOF MS, Voyager-Delayed Extraction STR Biospectrometry Workstation; PerSeptive Biosystems, Framingham, MA, USA) 로 분석하였다. 총 10개의 단백질을 동정하여 Table 2에서와 같은 결과를 얻었다. 그 중 세개의 밴드는 각각 putative endochitinase 1, chitinase, putative chitinase로 동정되었다. 이와 더불어 putative α-1,3 glucanase와 arabinan endo-1,5-α-L-arabinosidase가 포자 표면에 존재하는 것으로 확인되었다. 분자량이 비교적 큰 단백질 띠는 데이터베이스에서 hypothetical protein(미확인 단백질)으로 나타났는데, 이 단백질에 대한 총 아미노산 서열에 대해 상동성을 찾아 본 결과 putative glucan 1,3-β-glucosidase, putative β-glucosidase, carbohydrate-binding module Family 24와 상동성이 높게 나왔다. 종합하여 보면 5번 단백질 띠가 putative TPA: FAD-dependent oxygenase로 동정된 것과 단백질 띠 10번이 기능이 확인 되지 않는 단백질인 것을 제외하면, 이 연구에서 포자 표면에 존재하는 단백질은 모두 다당체를 분해하거나 결합에 관여하는 기능을 가지는 단백질인 것으로 나타났다[12].
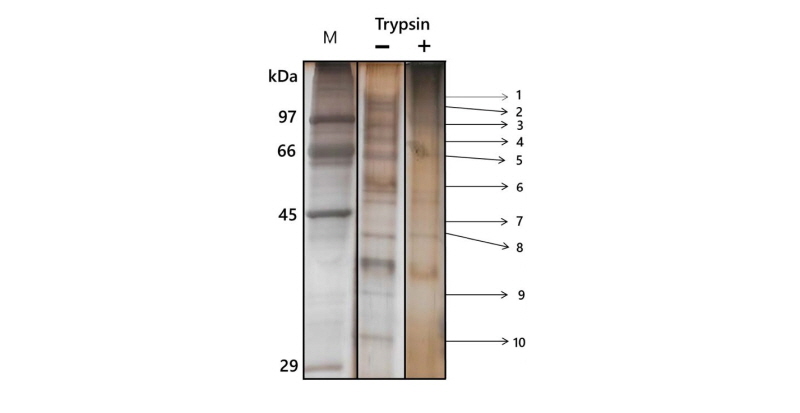
Fig. 5. Analysis of proteins extracted from spore surface of Aspergillus nidulans by SDS-polyacrylamide gel electrophoresis. Proteins extracted from asexual spores using 1 M NaCl were treated with/without trypsin. The arrows and numbers indicated protein band to be cut out for protein identification by MALDI-TOF mass spectrometry.
포자 표면에 존재하는 것으로 확인된 단백질이 다당류를 분해하는 효소가 대부분인 것은 포자의 발아에 당이 외부 신호로 작용할 것이라는 것을 암시해준다. 사상균이 자연계에서 발아하여 생존하기 위해서는 영양분이 있는 환경이 포자 주변에 조성되어야 할 것이므로, 당의 존재를 인식할 수 있는 기구가 필요한 것으로 예측할 수 있다. 다당류를 분해하는 효소가 포자 표면에 존재하는 것으로 미루어 보아, 다당류가 직접적으로 신호로 작용하거나 아니면 효소에 의해 분해된 단당류가 포자의 발아를 유도하게 될 것으로 해석하였다.
적요
Aspergillus nidulans와 Botrytis cinerea와 같은 사상균들은 당과 같은 영양분이 존재하지 않은 조건에서는 발아하지 않는다. 본 연구에서는 A. nidulans의 포자에 당을 인식하는 기구가 존재할 것이라는 증거를 제시하였다. A. nidulans의 포자에 증류수를 가하였을 때에는 발아가 관찰되지 않는 반면에 5%의 글루코오스를 가해 주었을 때에는 98%이상의 포자가 발아하였다. 뿐만 아니라 프록토오스, 설탕, 녹말과 같은 단당류, 이당류, 다당류를 가해 주어도 유사한 결과를 관찰할 수 있었다. 특이한 것은 L-형의 아라비노오스를 가해 준 포자는 발아관을 형성하였으나 D-형의 아라비노오스를 가해주면 증류수를 가해주었을 때와 같이 발아관을 형성하지 못 하였다. 포자를 트립신으로 처리한 후에 글루코오스를 가해주면 발아율이 25%롤 감소하였다. 포자 표면에 존재하는 단백질을 용출하여 분리한 후 MALDI-TOF 질량분석기로 단백질을 동정한 결과 동정된 10종의 단백질 중 8종의 단백질은 당의 대사와 관련된 효소들 임을 확인하였다.