서 론
표고버섯(Lentinula edodes)은 우리나라를 비롯하여 일본, 중국, 대만 등 동북아 지역에서 주로 생산, 소비되는 식용 및 약용 버섯으로 널리 사용되어 왔으며[1], 세계에서 두 번째로 많이 재배되고 있는 가장 인기 있는 식용 버섯이다[2]. 버섯에는 자유 라디칼 소거활성, metal chelation, 억제 효소 활성, 지질 산화 억제 등 다양한 생물학적 작용으로 인해 우수한 항산화제로 다양한 폴리페놀 화합물이 함유되어 있다[3]. 최근에는 암, 심혈관 질환, 신경질환, 백내장, 당뇨병 및 류마티스성 관절염과 같은 노화 및 질병과 관련하여 손상을 예방하는 산화 방지제가 식용 버섯의 약리적 가치에 대해 보고되고 있다[4]. 표고버섯에서도 다양한 항종양 및 저 콜레스테롤 혈증 효과, 항균 및 항산화 효과 등 다양한 질병을 예방하는 효과가 알려져 있다[5].
표고버섯의 항산화 활성에 관한 연구는 열수 추출물, 에탄올 추출물, 메탄올 추출물 등에서 총 폴리페놀 및 플라보노이드 함량과 전자공여능 등을 이용한 항산화 활성 등이 보고되어 있다[6]. 이뿐만 아니라 표고버섯의 재배 방법[7], 건조 방법[8]에 따라 추출물의 항산화 활성을 비교한 결과가 보고되고 있다.
국내에서는 참나무시들음병 피해목을 이용한 톱밥재배 시 생산된 표고버섯[1]과 참나무 수종별 톱밥재배에 따른 표고버섯의 항산화 활성을 연구하였으나[7] 원목재배 시 생산된 표고버섯에 대한 항산화 활성 연구는 이루어지지 않았다. 이에 본 연구에서는 원목재배를 통해 생산된 표고버섯 9품종(다산향, 천백고, 풍년고, 수향고, 백화향, 천장1호, 천장2호, 산림5호, 산림7호)의 물추출물을 제조한 후 이들의 항산화 특성으로 총 폴리페놀 함량과 총 플라보노이드 함량, 2,2-Diphenyl-1-picrylhydrazyl (DPPH) 라디칼 소거활성, ferric reducing antioxidant power (FRAP) 등의 항산화 활성을 조사하였다.
재료 및 방법
버섯 수집
국립산림과학원에서 품종보호 출원한 9개 품종을 동기관의 원목재배 시험지에서 재배하여 버섯을 수집하였다. 버섯재배에는 직경 15~20 cm, 길이 1.2 m의 상수리나무를 이용하였다. 실험에는 2014년~2016년에 품종별로 접종을 실시하고 관리한 원목에서 2017년 4~6월에 생산된 표고를 이용하였다.
시료의 추출
생표고는 50°C에서 72시간 동안 건조하여 분쇄 후 100 µm mesh의 체로 걸러 고운 분말을 사용하였다. 표고버섯 분말 4 g에 증류수 40 mL를 첨가한 후 WiseCube shaking incubator (WIS-20R; Daihan Scientific, Wonju, Korea)에서 150 rpm, 24시간 동안 교반하여 추출하였다. 표고버섯 추출물은 3,500 rpm에서 15분간 원심 분리한 후 상등액을 0.45 µm syringe filter로 여과한 여과액을 ‒4°C에서 보관하면서 실험에 사용하였다[7].
총 폴리페놀 함량 측정
총 폴리페놀 함량은 Folin-ciocalteu's phenol reagent를 이용한 Folin-Denis 방법을 이용하여 측정하였다[9]. 표고버섯 추출물 1.0 mL는 0.2 N Folin Ciocalteu's phenol reagent (Sigma- Aldrich, St. Louis, MO, USA) 5.0 mL를 첨가하여 5분 동안 반응시킨 용액에 7.5% Na2CO3 4 mL를 첨가하여 혼합하였다. 혼합시킨 반응액은 암소에서 1시간 동안 반응시킨 후에 Epoch Microplate Spectrophotometer (BioTek Instruments, Winooski, VT, USA)를 사용하여 765 nm에서 흡광도를 측정하였다. 이 때 함량은 gallic acid (Sigma-Aldrich)를 사용하여 시료와 동일한 방법으로 측정한 후 표준곡선으로부터 총 폴리페놀 함량을 계산하였고 mg gallic acid equivalent (GAE)/g로 나타내었다.
총 플라보노이드 함량 측정
총 플라보노이드 함량은 Xu와 Chang의 방법을 이용하여 측정하였다[10]. 표고버섯 추출물 0.25 mL에 증류수 1.25 mL와 5% sodium nitrite 75 µL를 첨가한 후 혼합하였다. 혼합시킨 반응액은 실온에서 6분 동안 반응시킨 용액에 10% aluminium nitrate 150 µL를 넣고 혼합시킨 후에 5분 동안 반응시켰다. 반응액은 1 M NaOH 0.5 mL와 증류수 2.5 mL를 넣고 혼합하여 상온에서 10분간 반응시킨 후에 Epoch Microplate Spectrophotometer를 사용하여 510 nm에서 흡광도를 측정하였다. 이 때 함량은 quercetin (Sigma-Aldrich)를 사용하여 시료와 동일한 방법으로 측정한 후 표준곡선으로부터 총 플라보노이드 함량을 계산하였고 mg quercetin equivalent (QE)/g로 나타내었다.
DPPH 라디칼 소거 활성 측정
DPPH 라디칼 소거 활성은 DPPH의 환원성을 이용한 전자 공여능을 측정한 원리로 Blois의 방법을 이용하여 측정하였다[11]. 표고버섯 추출물 1.0 mL는 0.2 mM DPPH methanol 용액 1.0 mL를 넣고 혼합한 후 어두운 곳에서 30분간 반응시킨 후 Epoch Microplate Spectro-photometer를 사용하여 517 nm에서 흡광도를 측정하였다. DPPH 라디칼 소거 활성은 시료 용액의 대조구와 시료 첨가구의 흡광도 차이를 백분율로 산출하였다.
DPPH 라디칼 소거 활성(%) = (대조구 흡광도 ‒ 시료 첨가구 흡광도)/대조구 흡광도 × 100
Ferric reducing antioxidant power 측정
FRAP 측정은 Benzie와 Strain의 방법을 참고하여 측정하였다[12]. FRAP reagent는 300 mM acetate buffer (pH 3.6), 40 mM HCl에 용해한 10 mM 2,4,6-tripyridyl-S-triazine (TPTZ) 용액 및 20 mM FeCl3·6H2O를 각각 10:1:1 (v/v/v)의 비율로 혼합한 다음 37°C 항온수조에서 15분간 반응시킨 후 사용하였다. 표고버섯 추출물 200 mL에 제조된 FRAP reagent 3.0 mL를 혼합한 후 37°C 항온수조에서 30분간 반응시킨 후 Epoch Microplate Spectrophotometer를 사용하여 593 nm에서 흡광도를 측정하였다.
통계분석
모든 실험은 3회 이상의 반복 실시한 결과값을 이용하여 평균 및 표준편차를 구하였으며, 실험 결과에 대한 상관관계를 알아보기 위해 SPSS 프로그램 (PASW Statistics 18; SPSS Inc., Chicago, USA)을 이용하여 ANOVA로 분석 후 Duncan's multiple range test에 의한 통계적인 유의성은 p < 0.05 수준에서 실시하였다.
결과 및 고찰
표고버섯 물추출물의 총 폴리페놀 및 총 플라보노이드 함량
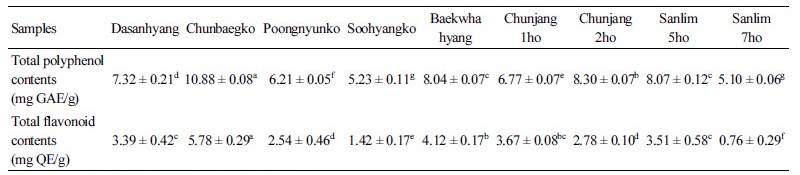
원목재배를 통해 수확한 표고버섯 추출물의 총 폴리페놀과 총 플라보노이드 함량은 Table 1과 같다. 총 폴리페놀 함량은 천백고(10.88 mg GAE/g), 천장2호(8.30 mg GAE/g), 산림5호(8.07 mg GAE/g), 백화향(8.04 mg GAE/g), 다산향(7.32 mg GAE/g) 등의 순으로 나타났다. 총 플라보노이드 함량은 천백고(5.78 mg QE/g), 백화향(4.12 mg QE/g), 천장1호(3.67 mg QE/g), 산림5호(3.51 mg QE/g), 다산향(3.39 mg QE/g) 등의 순으로 나타났다. 톱밥재배 표고버섯 추출물의 총 폴리페놀 함량(2.37~3.12 mg QE/g)과 총 플라보노이드 함량(0.48~0.84 mg QE/g)에 비해 원목재배 표고 추출물의 함량이 높은 것으로 나타났다[7].
Islam 등[13]에서 보면 43종의 식용 가능한 버섯의 추출물에서 총 폴리페놀 함량은 1.35~26.21 mg GAE/g 범위로 나타났고, 총 플라보노이드 함량은 0.05~5.90 mg QE/g으로 보고되었다. 총 폴리페놀 함량이 총 플라보노이드 함량에 비해 높은 이유는 폴리페놀이 플라본, 플라보놀, 카테킨, 이소플라본, 안토시안 등을 총칭하는 플라보노이드와 페놀산, 쿠마린, 엘라그산 등을 포함한 비플라보노이드를 포함하기 때문이다[14, 15]. 총 폴리페놀과 플라보노이드 함량은 시료에 따라 환경의 영향을 많이 받기 때문에 균주, 재배방법, 수확시기, 건조방법, 추출 용매 등에 따라 차이가 날 수 있다[7]. 본 실험에서 원목재배 표고 품종간 차이를 알아본 결과 총 폴리페놀과 플라보노이드 함량은 천백고가 다른 품종들에 비해서 가장 높게 나타났다.
DPPH 라디칼 소거 활성
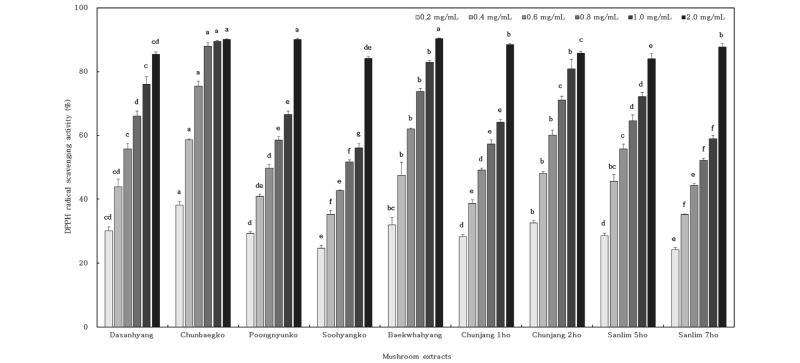
원목재배를 통해 수확한 표고버섯 추출물의 DPPH 라디칼 소거활성은 Fig. 1과 같다. DPPH 라디칼 소거 활성은 추출 농도에 따라 유의적인 차이를 보였으며 0.2~2.0 mg/mL의 농도 범위에서 농도 의존적으로 증가하는 경향을 나타냈다. 2.0 mg/mL의 농도에서 백화향(90.41%), 천백고(90.11%), 풍년고(90.07%), 천장1호(88.48%), 산림7호(87.67%) 등의 순으로 나타났다. 그 중에서 천백고는 0.2~2.0 mg/mL 농도 범위에서 38.19~90.11%로 다른 품종들에 비해서 가장 높게 나타났다. 이와 같은 결과는 DPPH 라디칼 소거 활성이 표고 추출물에 함유되어 있는 총 폴리페놀과 총 플라보노이드 함량과 관련이 되어있다고 볼 수 있다. 총 폴리페놀과 총 플라보노이드 함량이 높을수록 DPPH 라디칼 소거 활성이 증가되며 영지, 표고, 양송이 등에 포함되어 있는 페놀성 화합물이 자유 라디칼에 전자를 공여하여 항산화 효과를 높인다고 이전 연구를 통해 보고되고 있다[16].
Ferric reducing antioxidant power
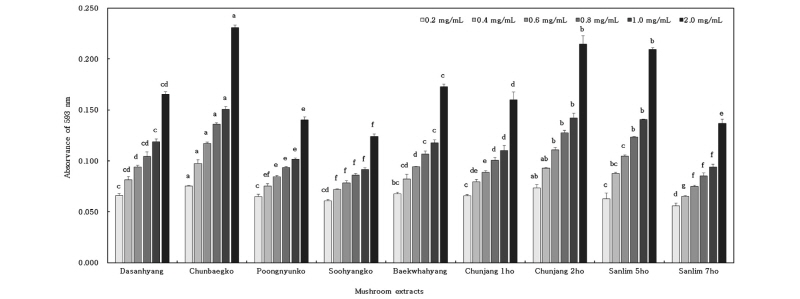
원목재배를 통해 수확한 표고버섯 추출물의 FRAP의 결과는 Fig. 2와 같다. FRAP의 결과는 추출 농도에 따라 유의적인 차이를 보였으며 0.2~2.0 mg/mL의 농도 범위에서 농도 의존적으로 증가하는 경향을 나타냈다. 2.0 mg/mL의 농도에서 천백고(0.231), 천장2호(0.214), 산림5호(0.209), 백화향(0.173), 다산향(0.165) 등의 순으로 나타났다. 그 중에서 천백고는 0.2~2.0 mg/mL 농도 범위에서 0.075~0.231로 다른 품종들에 비해서 가장 높게 나타났다. 본 연구의 결과에서 총 폴리페놀과 총 플라보노이드의 페놀성 화합물의 함량이 높을수록 증가한 DPPH 라디칼 소거 활성과 동일하게 높은 활성을 나타낸 것을 확인할 수 있었다.
본 연구에서 원목재배를 통해 수확한 표고버섯을 건조한 후 물을 이용해 추출한 표고버섯 추출물의 총 폴리페놀과 총 플라보노이드 함량, DPPH 라디칼 소거 활성, FRAP을 측정한 결과 다른 품종에 비해 천백고가 유의적으로 더 높은 경향을 나타내는 것으로 확인되었다.