서 론
멜론(Cucumis melo L.)은 달콤한 향과 맛을 내며, 특히 독특한 사향 냄새와 유사하다고 하여 이름 붙여진 머스크멜론처럼 항산화 물질과 각종 비타민 등이 풍부해 암, 혈관질환 등을 비롯한 다양한 성인병 관리에 효과가 뛰어나다고 알려져 있다[1-3]. 멜론은 초기에 소규모로 재배되었으나 2000년 들어 소비의 증가로 국내 재배면적이 급격히 증가되었고, 주산지는 담양, 나주 및 부여 지역이며 동기작과 하기작으로 나누어 재배되고 있다. 1990년 이후 재배 면적은 1,764 ha로 확대되었다[4]. 우리나라에서 멜론에 발생하는 주요 병으로 흰가루병, 덩굴쪼김병, 덩굴마름병, 역병, 노균병, 과일썩음병 및 모자이크병 등을 포함한 다수의 곰팡이, 세균 및 바이러스 병이 알려져 있다[5].
흰가루병균은 박과류를 비롯하여 국화과, 가지과, 현삼과, 꿀풀과 등 다양한 식물체에 흔히 발생하는 병해로 주로 식물체 잎 표면에 발달하며, 50% 이하의 상대습도에서도 발병이 쉽고, 감염된 잎은 황백화되어 조기 낙엽지고, 광합성 능력이 떨어져 과일이 작아진다[6, 7]. 멜론 흰가루병은 Podosphaera fusca (Fr.) Braun & Shishkoff에 의하여 발생하며, 멜론 과실의 생장이 지연되고 비대 불량으로 현저한 수량 감소를 야기하기 때문에 초기 방제 시기를 놓치면 방제 효과를 보기 어렵고 농가 소득에 큰 피해를 야기한다[6, 8].
흰가루병 방제는 주로 농약을 이용한 화학적 방제를 실시하지만, 이는 약제 저항성 균의 출현 및 새로운 race의 출현을 가속화시키는 등의 문제를 야기하였다[8, 9]. 최근 친환경 농산물에 대한 사회적인 관심이 늘어나고 농산물·식품의 안전성 관리제도(국립농산물품질관리원, http://www.naqs.go.kr/)가 강화되어 시행됨에 따라 친환경 방제 방법의 필요성이 크게 부각되고 있다[10]. 흰가루병의 방제를 위한 대표적인 미생물 농약으로 Bacillus속을 이용한 Serenade (AgraQuest, Davis, CA, USA) 및 Sonata (Wilbur-Ellis, Aurora, CO, USA) 등이 우리나라를 포함 전세계적으로 사용되고 있다[11]. 우리나라에서는 Bacillus속 균을 활용한 8개 품목의 흰가루병 방제 미생물 농약이 등록되어 있다[12].
따라서 본 연구에서는 멜론의 친환경 재배를 위하여 선발한 Bacillus velezensis M09, M70 및 M99-1 균주의 멜론의 주요 병원균에 대한 항균 활성 및 흰가루병에 대한 방제 효과를 검정하였다.
유용미생물 분리
Bacillus sp. M09, M77 및 M99-1 균주는 부여의 멜론 재배 농가에서 채집한 멜론 잎 조직에서 분리하였다. 멜론 잎 조직을 멸균수 5 mL가 들어있는 test tube에 넣고 20분간 방치 후 potato dextrose agar (PDA; Difco, Detroit, MI, USA) 배지에 도말하여 25°C에서 2일간 배양한 다음 분리하였다. Yeast potato dextrose (YPDA; Difco) 배지에 접종하여 계대배양 후 균체는 멸균한 글리세롤 20%액으로 ‒20°C에 보관하면서 실험에 사용하였다.
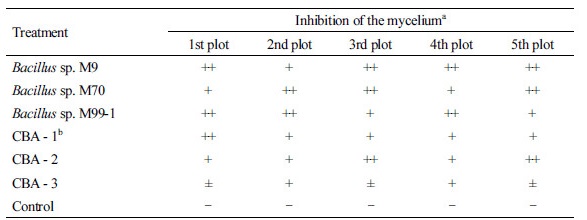
균주의 동정
Genomic DNA는 Accuprep DNA extraction kit (Bioneer, Daejeon, Korea)를 이용하여 추출하였으며, 추출된 genomic DNA는 16S rDNA 및 gyrA 유전자 증폭을 위하여 27F와 1492R 프라이머 및 p-gyrA-f와 p-gyrA-r 프라이머[13]를 이용하여 PCR을 수행하였다. PCR 반응 산물은 Expin PCR Purification Kit (GeneAll, Seoul, Korea)를 이용하여 정제하였다. DNA 염기서열의 분석은 Macrogen (Seoul, Korea)에서 수행하였다. 얻어진 염기서열은 EzTaxon-e server (http://eztaxon-e.ezbiocloud.net)와 GenBank database (NCBI database)를 통해 기존에 보고된 세균의 16S rDNA 염기서열과 상동성을 비교하여 동정하였다. 계통수는 MAFFT v.7 [14]로 염기서열을 정렬한 후 Kimura 2-parameter model [15]과 1,000회 반복 bootstrapping으로 MEGA ver. 5.0 [16]을 사용하여 neighbor-joining tree를 작성하였다(Fig. 1). 16S rDNA의 염기서열 분석 결과, 분리한 3균주는 Bacillus subtilis species complex의 Bacillus amyloliquefaciens DSM 7(T), Bacillus siamensis KCTC 13613(T) 및 Bacillus velezensis CR-502(T)와 같은 그룹을 형성하였다(Fig. 1A). Bacillus sp. M70와 M99-1 균주는 16S rDNA의 염기서열이 일치하였고, Bacillus sp. M9 및 Bacillus velezensis CR-502(T)와 99.9%의 염기서열 유사도를 보였다. 반면에 Bacillus sp. M9는 Bacillus sp. M70, Bacillus sp. M99-1, Bacillus siamensis KCTC 13613(T) 및 Bacillus velezensis CR-502(T)와 99.9%의 염기서열 유사도를 보였다. gyrA 유전자의 염기서열 분석 결과 선발한 3균주는 Bacillus velezensis CR-502(T)와 같은 그룹을 형성하였고 97.3~99.7%의 gyrA 유전자의 염기서열을 보였다(Fig. 1B). Bacillus sp. M70와 M99-1 균주는 gyrA 유전자의 염기서열이 일치하였고, Bacillus sp. M9와 97.8%의 염기서열 유사도를 보였다. 16S rDNA 및 gyrA 유전자의 염기서열을 바탕으로 Bacillus sp. M9, M70 및 M99-1 균주는 Bacillus velezensis으로 동정하였다.
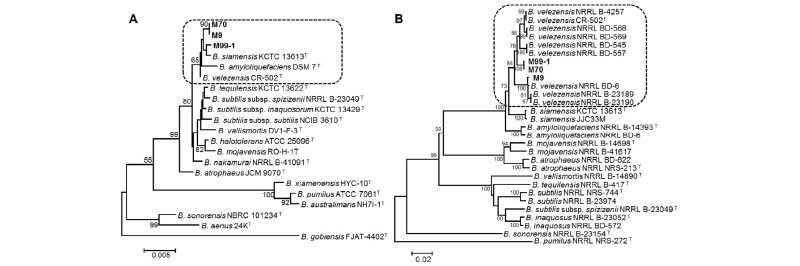
Fig. 1. Neighbor joining trees inferred from 16S rDNA (A) and gyrase subunit A (gyrA) (B) gene sequences of Bacillus subtilis species complex. Bootstrap scores > 50 are presented at the nodes. The scale bar indicates the number of nucleotide substitutions per site. The selected antagonistic bacteria are indicated in bold.
과채류에 발생하는 병원성 진균에 대한 Bacillus속 균주의 항균활성 검정
멜론의 주요 병원균으로 검은점뿌리썩음병균 Monosporascus cannonballus (KACC 42093), 덩굴마름병균 Didymella bryoniae (KACC 40939), 덩굴쪼김병균 Fusarium oxysporum f. sp. melonis (KACC 47669)는 국립농업과학원 농업생명자원서비스에서 분양받았고, 나머지 Verticillium dahliae, Fusarium solani, Fusarium equiseti, Stemphylium lycopersici, Botrytis cinerea, Colletotrichum fructicola 및 Phomopsis sp.는 부여 지역의 멜론, 토마토, 딸기 재배농가에서 채집한 식물체의 이병조직에서 분리하여 충남농업기술원 과채연구소에 보관 중인 균주를 사용하였다. 병원균은 PDA 배지에 7일간 배양하여 균사의 끝부분에서 5 mm 직경의 cork-borer로 agar plug를 떼어내어 YPDA 배지의 중앙에 치상하고, 동시에 길항 미생물을 멸균수에 현탁하여 루프를 이용해 가장자리 3곳에 접종하고 25°C에서 6~20일간 배양 후 생육억제 정도를 조사하였다. 각 실험은 3반복으로 수행하였다. 아래 공식에 의하여 균사생장 억제율을 계산하였다.
균사생장 억제율(%) = (1–길항미생물 접종 배지에서 자란 균사의 길이 / control 배지에서 자란 균사의 길이) × 100
선발된 균주의 멜론의 주요 병원균 및 다양한 식물병원균에 대한 균사생육 억제효과를 조사한 결과, B. velezensis M09와 M70은 다양한 식물병원균에 49~67%의 유사한 균사생육 억제효과를 보였고, Verticillium dahliae를 제외한 모든 식물병원균에 대하여 B. velezensis M99-1 보다 높은 균사생장 억제효과를 보였다(Fig. 2). 특히 B. velezensis M09와 M70는 Botrytis cinerea, Colletotrichum fructicola 및 Verticillium dahliae에 높은 균사생육 억제효과를 보였다(Fig. 2). B. velezensis M99-1는 본 실험에 사용한 모든 병원균에 대하여 47~69%의 유사한 균사생육 억제효과를 보였고, 특히 Verticillium dahliae에 높은 균사생육 억제효과를 보였다(Fig. 2).
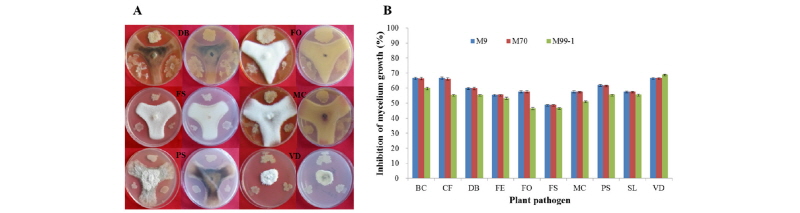
Fig. 2. In vitro inhibitory effect of mycelial growth of plant pathogens by antagonistic bacteria, Bacillus sp. M9, M77, and M99-1. A, dual culture assay; B, measurement of inhibition effects of bacterial isolates on mycelial growth of plant pathogen. Error bars represent standard deviations of three replicates. BC, Botrytis cinerea; CF, Colletotrichum fructicola; DB, Didymella bryoniae; FE, Fusarium equiseti; FO, Fusarium oxysporum f. sp. melonis; FS, Fusarium solani; MC, Monosporascus cannonballus; PS, Phomopsis sp.; SL, Stemphylium lycopersici; VD, Verticillium dahlia.
Bacillus속 세균의 항균활성은 이미 오이, 겨자채를 비롯한 여러 작물의 흰가루병에서 잘 알려져 있고[12, 17-19], B. subtilis complex 그룹의 종들은 병원균의 균사 생장, 포자 발아 억제 및 식물에 저항성을 유도하는 리포펩타이드 계통(bacillomycin D, fengycin, iturin 및 surfactin)의 이차대사물질을 생산하는 것으로 알려져 있다[20, 21]. 따라서 Bacillus속을 이용한 미생물 농약들이 전세계적으로 판매되고 있다[11, 22].
메론 잎 디스크를 이용한 흰가루병균의 생육억제 효과 검정
페트리 디쉬 내의 filter paper에 식물체 조직이 직접 닿지 않도록 스트로우를 놓고, 그 위에 시설하우스에서 흰가루병이 자연 발생된 멜론(품종: 얼스탤런트) 잎을 직경 38 mm 디스크로 제작한 후 앞, 뒷면을 선발균의 현탁액(108 CFU/mL)에 적셔 올려놓은 다음, 14시간은 26°C에서 광 상태로, 10시간은 25°C에서 암 상태로 조절된 항온배양기에 두고 5일간 배양한 후 식물체 표면에 발달한 균사체의 생육상태를 해부현미경으로 흰가루병균의 억제 및 발생 정도를 육안으로 달관조사하였다. 실험은 3반복으로 3차례 시험하였다.
Fig. 3. Comparison of inhibition of mycelium growth by treatment with antagonistic bacterial cell suspension (A, Bacillus sp. M9; B, Bacillus sp. M70; C, Bacillus sp. M99-1; D, commercial goods-1; E, commercial goods-2; F, control) on the colonified leaf disk with mycelium and spores of melon powdery mildew. Antagonistic bacteria (1 × 108 CFU/mL) were sprayed onto whole leaf disk. The degree of growth of the mycelium was measured 5 days after treatment, and the photographs were taken under stereo microscopy (10×).
흰가루병 발생 및 감염 최적온도가 각각 20~27°C, 10~32°C 사이임을 감안하여, 공시 균주의 세포 현탁액이 부착된 감염된 잎 디스크를 광(26°C/14시간), 암(25°C/10시간)이 조절되는 배양기에 5일간 방치하여 조사한 결과, 처리 후 1~2일까지는 초기 살포된 수분으로 인해 균사체의 생육이 불안정하거나, 미약하였다. 3~4일에는 균체 및 식물체의 표면에 부착된 수분이 서서히 마르면서 잎 표면의 균사체, 분생포자가 활발히 생장하면서 뚜렷한 백색 집락을 형성하였다(Fig. 3F). B. velezensis M9, M70 및 M99-1 처리 시 무처리구 및 시판되고 있는 3종의 흰가루병 미생물제 처리(Fig. 3D, 3E)에 비해 잎 표면에서 생장 중인 흰가루병균의 균사체 및 colony 발달이 현저히 감소되었고, 미미한 생육 상태를 보였다(Table 1, Fig. 3A~3C). 이는 선발 균주가 멜론 식물체의 잎 표면에 잘 정착하여 흰가루병균의 포자발아, 균사체 생장이 억제된 것으로 해석되었으며, 또한 흰가루병에 치료 효과가 있는 것으로 생각되었다. Bacillus속의 B. subtilis, B. pumilus 등은 식물체 잎 표면에서 정착력, 증식력, 항균 활성물질 생산력이 우수하여 식물병원균의 균사 억제 뿐만 아니라 포자발아, 균사의 조직침입 저지 등 병 발생을 초기에 예방 및 방제 효과가 우수하여 생물학적 미생물제제로서 농업현장에서 사용되고 있다[20, 23]. 따라서 본 연구에서 선발된 균주는 멜론의 흰가루병뿐만 아니라 멜론의 다양한 병원균에 대하여 친환경적인 재배에 적용 가능한 대체 생물제로의 가능성을 보여주었다.