서 론
식물은 생태계 내에서 다양한 형태로 미생물들과 공생 관계를 형성하고 있다. 이 중 식물에 공생하는 진균성 균류인 내생균(endophytic fungi)은 뿌리, 잎, 줄기 등 식물의 모든 조직 내에서 불현성(不顯性, inapparent)으로 감염하여 병증을 보이지 않고 증식한다[1]. 내생균은 식물체 내에서 2차 대사산물을 합성하여 포식자 혹은 병원체로부터의 방어 기작을 식물에게 제공하는 역할을 한다[2]. 특히 이러한 2차 대사산물들이 갖고 있는 병원체에 대한 항생 효과로 인해[3], 내생균에 대한 분류학적, 생리학적 연구가 필요한 상황이다. 본 연구에서는 눈향나무(Juniperus chinensis var. sargentii A. Henry)의 침엽에서 분리된 내생균에 대해 연구하던 중 확보된 4종의 국내 미기록 내생균 균주의 형태적, 계통학적 특성에 대해 보고하고자 한다.
재료 및 방법
한라산의 정상 부근 해발 1,900 m에 서식하는 눈향나무의 병증이 없는 건강한 침엽을 선별하여 채취하였으며, 채취한 잎은 48시간 이내에 실험실로 운반하였다. 증류수로 세척한 침엽을 30%의 H2O2로 30초~1분간 표면 살균하고[4], potato dextrose agar (PDA) 배지의 가장자리에 4조각씩 치상하였다. 잎을 치상한 배지를 25°C의 암소에서 배양하면서 균사가 뻗어 나오는 것을 관찰하였고, 균사가 관찰되면 새로운 PDA에 계대배양하여 균주를 순수 분리하였다. 확보된 균주는 형태적 특성에 따라 분류하였고, 염기서열 분석을 위하여 DNeasy Plant mini kit (Qiagen, Germantown, MD, USA)의 protocol에 따라 균사에서 genomic DNA를 추출한 뒤 균 특이적인 프라이머인 ITS1F와 ITS4를 이용하여 internal transcribed spacer (ITS) 영역을 증폭하였고[5], 프라이머 LR0R과 LR16을 이용하여 rDNA의 large subunit (LSU) 영역을 증폭하였으며[6], 추가적인 분석을 위하여 프라이머 bt2a와 bt2b를 이용하여 β-tubulin (TUB) 영역을[7], 프라이머 526F와 1567R을 이용하여 translation elongation factor (TEF) α-1 영역을 증폭하였다[8]. Annealing 온도는 ITS 영역은 50°C, LSU rDNA 영역은 44°C, TUB 영역은 58°C, TEF 영역은 57°C로 설정하여 수행하였으며, PCR 산물은 1.5% agarose gel에서 22분간 전기영동하고 예상되는 크기의 증폭된 DNA 단편을 확인한 후 염기서열 분석을 의뢰하였다(SolGent, Daejeon, Korea). 분석된 염기서열은 NCBI 상에서 BLAST를 이용하여 유사도를 확인한 후 각 종들 간의 계통 분석을 통한 유연 관계를 확인하기 위해 MEGA6 [9]를 이용하여, neighbor-joining 방법으로 phylogenetic tree를 작성하였다. 분리된 균주는 국립생물자원관(NIBR)에 기탁하였으며, DNA 염기서열은 국립생물정보센터(NCBI)에 제출하였다.
결과 및 고찰
Epicoleosporium ramularioides Videira, H.D. Shin & Crous, Stud Mycol 83: 100 (2016)
PDA 배지에서 7일간 배양된 균총의 직경은 17~20 mm 정도이며, 균총의 형태는 매우 불규칙하다. 균총의 색은 앞면은 올리브색 혹은 황록색을 띠고 뒷면은 중앙부에서 검푸른색을 띠고 가장자리에 약간의 흰색을 띤다. 균총의 고도는 배지에 납작하게 붙어 있는 형태이다(Fig. 1A). Malt extract agar (MEA) 배지에서 7일간 배양된 균총의 직경은 19~22 mm 정도이며, 대부분의 형태적 특성은 PDA 배지에서 배양된 균총과 일치하나 균총 앞면의 색이 회백색을 띠는 것이 차이점이다(Fig. 1E). 균사 생장 방향의 측면 혹은 정면에서 유리질의 투명한 원통형의 분생자경(conidiophore)이 형성되며, 타원형의 분생자(conidia)를 만든다[10]. 본 연구에서는 원 기재문의 특성과 일치하는 유리질 원통형의 분생자경이 관찰되었으며, 크기는 (5.8~12) × (2.4~3.2) µm 정도이다(Fig. 1I).
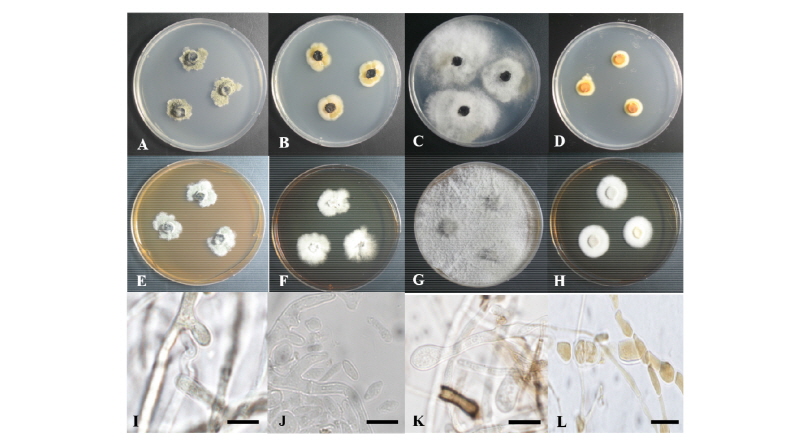
Fig. 1. Colonies of strain 17E013 (Epicoleosporium ramularioides) grown for 7 days on potato dextrose agar (PDA) (A) and malt extract agar (MEA) (E), conidiophore (I). Colonies of strain 17E062 (Kabatina juniperi) grown for 7 days on PDA (B) and MEA (F), conidia (J). Colonies of strain 17E063 (Allantophomopsis lycopodina) grown for 7 days on PDA (C) and MEA (G), conidiophore (K). Colonies of strain 17E066 (Seiridium podocarpi) grown for 7 days on PDA (D) and MEA (H), conidia (L) (scale bars =10 µm).
Specimen examined. Mt. Hallasan, Jeju-do, Korea, N 33°21'47.9", E 126°32'10.2", April 18, 2017, isolated from leaves of Juniperus chinensis var. sargentii, strain 17E013, NIBRFG0000502327, GenBank no. MH333253.
Note: Epicoleosporium속과 E. ramularioides는 2016년 Videira 등에 의해, 본래 식물 내생균으로 많이 알려져 있던 Ramularia속으로부터 새로 분지되었다[10]. ITS와 LSU, 그리고 TEF 영역의 분자적 분석 결과 ITS 영역의 DNA 염기서열이 E. ramularioides GU214688.1과 99.0%의 일치도를 보였고, LSU 영역의 염기서열은 E. ramularioides KX286984.1과 99.0%의 일치도를, 그리고 TEF 영역의 염기서열은 E. ramularioides KX287847.1과 99.0%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 2).
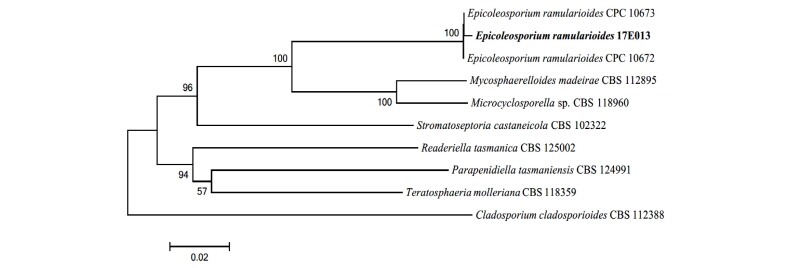
Fig. 2. Neighbor-joining phylogenetic tree based on a combined alignment of both internal transcribed spacer, large subunit and translation elongation factor sequences. Cladosporium cladosporioides was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Fungal strain isolated in this study is in bold.
Kabatina juniperi R. Schneid. & Arx, Phytopathologische Zeitschrift 57: 181 (1966)
PDA 배지에서 7일간 배양된 균총의 직경은 19~21 mm 정도이며, 균총의 색은 앞·뒷면 모두 중앙부는 검은색이며 가장자리는 베이지색이다. 균총의 고도는 배지에 납작하게 붙어 있으며, 가장자리는 불규칙한 원형이다(Fig. 1B). MEA 배지에서 7일간 배양된 균총의 직경은 21~26 mm 정도이며, 앞면은 흰색이고 뒷면은 베이지색이다. 균총의 고도는 납작하며, 중앙부로부터 가장자리로 균사가 방사형으로 뻗어 있다(Fig. 1F). 균사 생장 방향의 측면에서 뻗어 나온 분생자경에서 유리질 타원형의 분생자를 형성하며[11], 본 연구에서도 분생자를 관찰할 수 있었다. 분생자는 타원형 혹은 찌그러진 타원형이며 투명하고 크기는 (3.4~4.3) × (1.4~2.0) µm 정도이다(Fig. 1J).
Specimen examined. Mt. Hallasan, Jeju-do, Korea, N 33°21'47.9", E 126°32'10.2", April 18, 2017, isolated from leaves of Juniperus chinensis var. sargentii, strain 17E062, NIBRFG0000502328, GenBank no. MH333252.
Note: Kabatina juniperi는 1966년 Schneider와 Arx에 의해 최초 보고되었으며, 노간주나무속(Genus Juniperus)의 침엽에서 최초 분리된 것에서 종명이 유래했다[11]. 노간주나무속을 비롯하여 측백나무속(Genus Thuja), 편백나무속(Genus Chamaecyparis)의 침엽에서도 내생균으로 분리된 기록이 존재한다[12]. ITS와 LSU 영역의 분자적 분석 결과 ITS 영역의 DNA 염기서열이 K. juniperi AY616211.1과 99.0%의 일치도를 보였고, LSU 영역의 염기서열은 K. juniperi AY183367.1과 98.0%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 3).
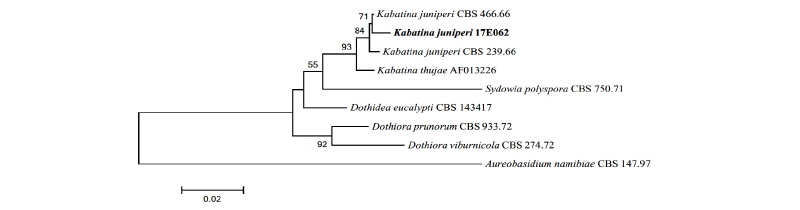
Fig. 3. Neighbor-joining phylogenetic tree based on a combined alignment of both internal transcribed spacer and large subunit sequences. Aureobasidium namibiae was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Fungal strain isolated in this study is in bold.
Allantophomopsis lycopodina (Höhn.) Carris, Can J Bot 68: 2290 (1990)
PDA 배지에서 7일간 배양된 균총의 직경은 40~44 mm 정도로 매우 빠르게 자라며, 앞·뒷면 모두 중앙부는 검은색이고 가장자리는 흰색이다. 균총의 중앙부에서는 배지에 납작하게 붙어 있는 형태이고, 가장자리에는 불규칙한 형태로 공중균사가 형성된다(Fig. 1C). MEA 배지에서 7일간 배양된 균총의 직경은 43 mm 정도이며, 앞면은 회백색을 띠고 뒷면은 베이지색이다. 균사체가 그물 형태로 중앙부에서 바깥쪽까지 퍼져 있는 형태이며, 균총의 고도는 살짝 융기되어 있다(Fig. 1G). 분생자경은 플라스크를 뒤집어 놓은 형태이고, 부드러운 유리질이다. 분생자경에서 형성되는 분생자는 단일 격막을 가진 타원형 혹은 초승달 형태이다[13]. 본 연구에서는 원 기재문의 형태와 일치하는 분생자경을 확인하였으며, 분생자경의 크기는 (8.2~8.5) × (4.6~4.8) µm 정도이다(Fig. 1K).
Specimen examined. Mt. Hallasan, Jeju-do, Korea, N 33°21'47.9", E 126°32'10.2", April 18, 2017, isolated from leaves of Juniperus chinensis var. sargentii, strain 17E063, NIBRFG0000502340, GenBank no. MH333254.
Note: A. lycopodina는 1990년 Carris에 의해 최초로 보고되었으며, 원 기재문에서는 크랜베리 잎의 병원성 반점에서 분리되었다[13]. 그러나 목본식물의 가지에서 내생균으로 분리된 기록이 존재하고[14], 본 연구에서도 병증이 없는 침엽에서 분리되었다. 이 종으로 동정된 균주의 2차 대사산물 중 allantopyrone A가 분리되었으며, 이 물질은 인간 유래 백혈암 세포에 대한 세포독성 효과를 보이는 것으로 보고되어 있다[15]. ITS와 LSU, 그리고 TEF 영역의 분자적 분석 결과 ITS 영역의 DNA 염기서열이 A. lycopodina KR873230.1과 99.0%의 일치도를 보였고, LSU 영역의 염기서열은 A. lycopodina KR873264.1과 100.0%의 일치도를, 그리고 TEF 영역의 염기서열은 A. lycopodina KR873305.1과 97.0%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 4).
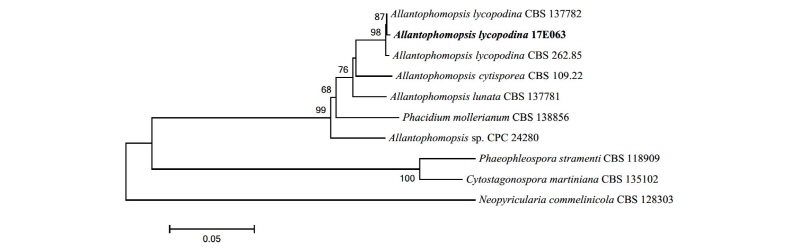
Fig. 4. Neighbor-joining phylogenetic tree based on a combined alignment of both internal transcribed spacer, large subunit and translation elongation factor sequences. Neopyricularia commelinicola was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Fungal strain isolated in this study is in bold.
Seiridium podocarpi Crous & A.R. Wood, Persoonia 32: 251 (2014)
PDA 배지에서 7일간 배양된 균총의 직경은 13~13.5 mm 정도이며, 균총의 색은 앞면은 주황색 혹은 황적색이고 뒷면은 밝은 노란색이다. 균총의 가장자리는 조밀한 방사형으로 형성되어 있으며, 균총의 고도는 배지에 납작 붙어있는 형태이다(Fig. 1D). MEA 배지에서 7일간 배양된 균총의 직경은 22~23 mm 정도이며, 균총의 색은 앞면은 밝은 흰색이고 뒷면은 베이지색에 가깝다. 중앙부에서 가장자리로 균사가 조밀하게 방사형으로 뻗어 있고, 균총의 고도는 배지에 납작 붙어 있는 형태이다(Fig. 1H). 여러 갈래로 분지되는 유리질, 원통형의 분생자경을 가지며, 일반적으로 분생자경은 2~3층의 격막을 갖는다. 분생자는 방추형이며, 반투명 혹은 옅은 갈색으로 최대 5층까지 격막에 의해 분리된다[16]. 본 연구에서는 분생자경 및 격막에 의해 2층으로 분리된 황갈색의 분생자를 확인할 수 있었으며 분생자의 크기는 (5.9~8.2) × (3.7~3.9) µm 정도이다(Fig. 1L).
Specimen examined. Mt. Hallasan, Jeju-do, Korea, N 33°21'47.9", E 126°32'10.2", April 18, 2017, isolated from leaves of Juniperus chinensis var. sargentii, strain 17E066, NIBRFG0000502341, GenBank no. MH333255.
Note: S. podocarpi는 2014년 Crous와 Wood에 의해 최초로 보고되었으며, 죽백나무속(Podocarpus spp.)의 침엽에서 내생균으로 분리된 것에서 종명이 유래했다[16]. ITS와 LSU, 그리고 TUB 영역의 분자적 분석 결과 ITS 영역의 DNA 염기서열이 S. podocarpi LT853101.1과 98.0%의 일치도를 보였고, LSU 영역의 염기서열은 S. podocarpi KJ869207.1과 99.0%의 일치도를, 그리고 TUB 영역의 염기서열은 S. podocarpi LT853248.1과 98.0%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 5).
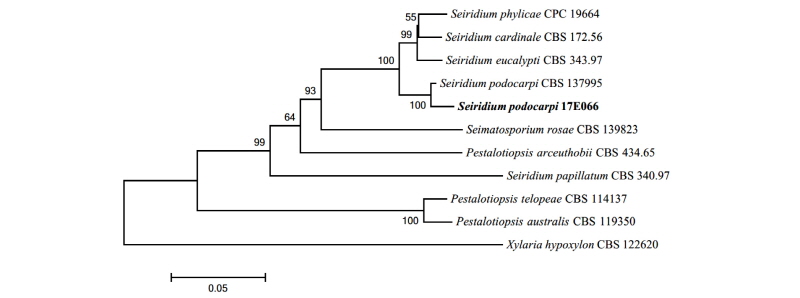
Fig. 5. Neighbor-joining phylogenetic tree based on a combined alignment of both internal transcribed spacer, large subunit and beta-tubulin sequences. Xylaria hypoxylon was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Fungal strain isolated in this study is in bold.

