서 론
우리나라에 자생하는 녹청균속(Chlorociboria) 종들은 주로 참나무류의 죽은 나무를 청록색(blue-green)으로 물들이며, 여름과 가을에 작은 술잔 또는 부채 모양의 자실체를 만든다. 색소를 띤 녹청균류의 균사체가 죽은 나무의 세포 안으로 침입하여 군락을 이루게 되면 나무 조직으로 색소가 확산되는 일련의 과정을 통해 나무를 변색시킨다[1, 2]. 이들은 목재 부후를 일으키는 연부후성 자낭균류(soft-rotting ascomycetes)이기도 한데[3], 연부후균은 식물의 이차 세포벽에서 균사 생장이 우수하게 나타나는 특징이 있다[4]. 녹청균(Chlorociboria aeruginosa)은 잘 썩은 활엽수에 부생하고[2], 변형술잔녹청균(Chlorociboria aeruginascens)은 썩은 활엽수 고목, 특히 참나무류에 부생하는 것으로 알려져 있다[5].
현재 녹청균속(Chlrociboria)의 분류학적 위치는 녹청균과(Chlorociboriaceae) 고무버섯목(Helotiales) 두건버섯강(Leotiomycetes) 자낭균문(Ascomycota) [6]이며, 북미 지역에 2종류(C. aeruginosa, C. aeruginascens)의 녹청균류가 분포하는 것으로 보고된 바 있다[1, 7]. 우리나라에는 3종류(C. aeruginosa, C. aeruginascens, C. poutoensis)의 녹청균류가 분포하는 것으로 최근 보고되었다[8]. 이 중 녹청균과 변형술잔녹청균은 자실체의 형태가 매우 유사하기 때문에 육안으로 두 종을 구별하긴 어렵고, 현미경 관찰을 통해야만 형태적 동정이 가능한 것으로 알려져 있다[2].
아직 국내에서는 녹청균류에 대한 관심이 적으나, 다른 나라에서는 이미 19세기 후반부터 이 균류가 생산하는 청록색의 천연 색소를 상업적으로 활용하기 위한 본격적인 연구가 시작되었으며[2], 최근까지 다양한 산업 분야에 적용하기 위한 연구들이 활발하게 이루어지고 있다[9, 10]. 녹청균이나 변형술잔녹청균과 같은 녹청균류가 생산하는 청록색 색소는 ‘xylindein’으로, 1868년 Rommier가 알칼리성 유기용매를 이용하여 녹청균이 감염된 나무로부터 녹색 색소를 추출한 후 붙인 이름이다[7, 11]. Xylindein은 일반적인 유기용매로는 추출하기 어려운 단점이 있어[12] 유기용매 처리가 필요한 산업용 소재에 적용하기란 쉽지 않았다. 그러나 최근에는 녹청균을 포함한 변색균류(pigmented fungi)의 색소 추출뿐만 아니라 건조된 색소를 다시 용해시킬 때에도 이상적인 유기용매라 평가되고 있는 dichloromethane (DCM)이 있어[13, 14] 색소 추출이 과거보다 용이해졌다.
녹청균에 의해 변색된 나무를 이용하거나 목재 염색에 녹청균류의 색소를 사용하기 시작한 것은 15세기 이후로[1, 7], 르네상스 시대 상감 세공 장인들은 식물을 세공품에 표현하기 위해 녹청균류에 의해 청록색으로 변색된 나무 조각을 이용하였다[1, 15]. 현재에도 녹청균류를 이용한 목공품 제작은 지속적으로 이루어지고 있는데, 영국의 잉글랜드 지역에서 생산되는 ‘Tunbridge ware’는 녹청균이나 변형술잔녹청균을 이용하여 참나무를 인공적으로 염색한 대표적인 상감 목공 세공품이다[5, 12].
녹청균류의 색소는 목공품, 종이, 섬유 등을 장식하기 위한 산업용 염료로 이용할 수 있어[2, 14] 국외에서는 생물공학적인 방법으로 이 색소를 생산하려 하고 있다. 녹청균류가 spalted wood 제조용 xylindein을 최대로 생산할 수 있는 배양 조건이나[1, 2], 발색력과 알코올 용해성이 아닐린 염료(aniline dyes)와 대등한 녹청균류의 색소를 실험실에서 단시간에 생산하는 연구를 하고 있다[9]. 섬유산업 분야에서는 상업적으로 유용한 의류 염료를 개발하기 위해 녹청균류의 색소로 각종 직물을 염색한 후 표백제나 땀에 대한 염색견뢰도(colorfastness)를 시험하거나[11, 16, 17] 섬유에 색소가 결합한 형태를 분석하여 균류의 색소가 UV에 대한 내성이 있는지 등을 연구하고 있다[3]. 이외에도 녹청균류의 색소는 다양한 생리활성 기능(항혈전, 항산화, 항염증, 면역억제, 이뇨작용)과 중경작물(cultivated crops) 재배 시 잡초 발아 억제 작용이 있어 의약품과 제초제 관련 특허출원의 관심의 대상이 되고 있다[2]. 이와 같이 xylindein은 상업적인 소재로서의 이용 가치가 매우 높으나, 자연계에서 녹청균류에 감염된 나무를 발견하기 어렵고 수요에 상응하는 양을 손쉽게 확보할 수 없기 때문에 국외에서는 xylindein 합성에 관한 연구[12]나 실험실 내 균류 배양 연구 등을 통해 상업적 활용을 위한 색소 생산 조건들을 정립해가고 있다[1, 2, 10]. 그러나 국내에서는 녹청균류의 생장 특성과 색소 생산에 관한 생물공학적 연구들이 아직 활성화되어 있지 않은 상태이다.
본 연구는 국내 산림버섯 자원의 수집 및 보존 연구를 수행하는 과정에서 천연 염료자원으로 활용 가능할 것으로 판단되는 녹청균속 균주들의 기초 배양 특성을 조사한 것으로 그 결과를 본 논문에 소개하고자 한다.
재료 및 방법
시험 균주의 수집과 동정
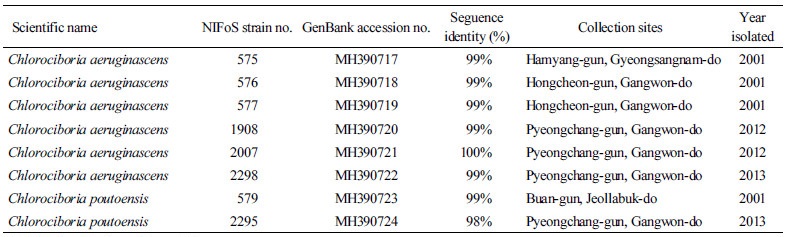
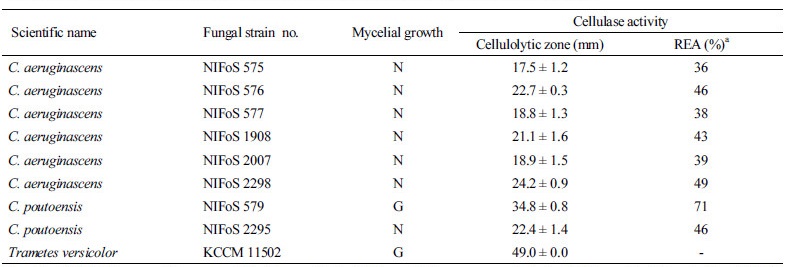
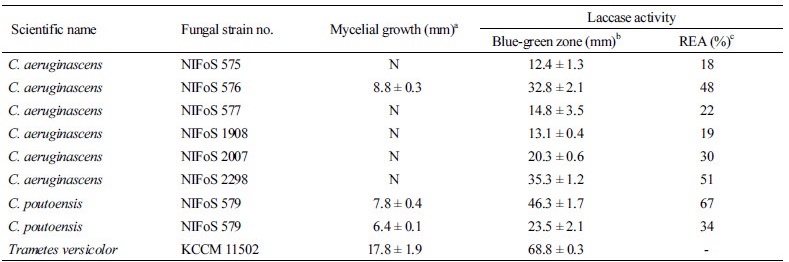
국립산림과학원은 우리나라에 자생하는 녹청균속(Chlorociboria spp.) 균류를 확보하고자 강원도, 경상남도, 전라북도 지역에서 균주를 수집하고, 포자로부터 균을 분리하였다[4]. 자실체의 형태적 특성을 근거로 녹청균(C. aeruginosa)과 변형술잔녹청균(C. aeruginascens)으로 일차 동정하였으나, ITS1과 ITS4 primer를 이용하여 증폭시킨 rDNA의 internal transcribed spacer (ITS) 부위 염기서열 분석[18] 결과 Table 1과 같이 C. aeruginascens와 C. poutoensis임이 확인되어 이를 근거로 시험균의 종을 최종 확정하였다. 순수 분리한 녹청균속 균주들의 배양 특성을 조사하기 위해 Ka 등[4]과 Jeon과 Ka [19]의 방법을 참고하여 균사 생장력과 세포외효소 활성을 시험하였다.
Chlorociboria spp.의 균사 생장력 조사
균사 생장력은 고체배지의 종류, 배양 온도, 액체배지의 pH 등 배양 조건에 따른 균총(mycelial colony)의 크기나 균체량 변화, 균사체의 형태적 특성과 청록색 색소 발현도 등을 조사하였다. 고체 배지별 균사 생장력은 3종류의 상용 배지 potato dextrose agar (PDA; Difco, Detroit, MI, USA), malt extract agar (MEA; Difco), Sabouraud dextrose agar (SDA; Difco)를 이용하였다. 배지(pH 6.0)는 멸균 petri dish (bottom 85 mm × height 15 mm) 1개당 25 mL씩 분주한 후, 무균대 내에서 고형화하였다. 각 시험 배지의 중앙에 각 균주의 접종원(직경 6 mm)을 1개씩 접종하고, 25°C 항온 배양기에서 60일간 암배양하였다. 온도별 균사 생장력은 각 균주의 접종원(직경 6 mm)을 PDA 배지(pH 6.0)의 중앙에 1개씩 접종하고, 설정 온도(10°C, 15°C, 20°C, 25°C, 30°C)가 서로 다른 5개의 항온 배양기에서 각각 60일간 암배양하였다. 고체배지에서 생장한 균총의 크기는 digital vernier calipers를 이용하여 측정(접종원 크기는 제외)하였다. 액체배지의 pH별 균 생장력을 조사하기 위해 pH가 서로 다른 5종류(pH 4.0, pH 5.0, pH 6.0, pH 7.0, pH 8.0)의 potato dextrose broth (PDB; Difco)를 제조하였다. PDB 배지(20 mL/flask) 1개당 각 균주의 접종원(직경 6 mm)을 1개씩 접종한 후, 암 조건의 25 ± 2°C에서 60일간 정치배양(static culture)하였다. 균 배양체를 여과 및 건조(70°C, 2 days)하고, 건중량(mg/flask)을 측정하였다.
Chlorociboria spp.의 세포외효소 활성 조사
녹청균속 균주들의 세포외효소인 셀룰라아제(cellulase)와 라카아제(laccase) 활성도를 측정하고, 백색부후균(white rot fungi)과 효소 활성도를 비교하기 위해 구름송편버섯(Trametes versicolor KCCM 11502)의 효소 활성도 함께 측정하였다. 백색부후균에 대한 녹청균류의 상대적 효소 활성도(relative enzyme activity, REA)는 다음과 같이 산출하였다.

Cellulase 활성 검색용 배지는 Kasana 등[20]이 제시한 배지의 조성에 따라 제조하였다. 10 mL의 배지가 고형화된 carboxymethylcellulose (CMC) agar plate (pH 6.0, petri dish size: 55 mm × 15 mm)의 중앙에 각 균주의 접종원(직경 6 mm)을 1개씩 접종한 후, 25°C에서 8일간 암배양하였다. 염색 시약으로는 Gram’s iodine solution (KI 2 g, I2 1g, 증류수 300 mL)을 사용하였다. 염색한 배지는 약 2시간 동안 상온에 방치한 후, cellulase 활성 영역(cellulolytic zone)인 투명대의 직경(접종원 크기 제외)을 측정하였다. 또한, 균사 생장력과 cellulase 활성 발현도와의 상관성을 조사하기 위해 배지 상의 균사 생장 여부도 함께 관찰하였다.
Laccase 활성 검색용 배지로는 Crowe와 Olsson [21]이 제시했던 배지 제조법을 일부 변형하여 만든[4, 19] 2, 2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid) (ABTS) agar plate를 사용하였다. 20 mL의 배지가 고형화된 ABTS agar plate (85 mm × 15 mm)의 중앙에 각 균주의 접종원(직경 6 mm)을 1개씩 접종한 후, 25°C에서 5일간 암배양하였다. 청록색의 원형 발색대가 형성된 경우와 균사가 생장한 경우에는 그 크기를 측정(접종원 크기 포함)하였다. REA를 산출하여 백색부후균에 대한 녹청균류의 상대적 laccase 활성도를 평가하였다.
결과 및 고찰
녹청균류는 근연종간 형태적 특성이 매우 유사하기 때문에 본 연구에서는 분자적 동정을 통해 C. aeruginascens 또는 C. poutoensis로 확정된 8개의 시험균을 대상으로 배양 특성을 조사하였다(Table 1, Fig. 1). 실험실 내 녹청균류의 배양 조건(배지의 성분, 배양 기간, 배지의 pH 등)은 녹청균류의 균사 생장과 청록색 색소 발현에 영향을 끼치는 것으로 알려져 있다[1, 2, 22]. 본 연구에서는 우리나라에서 수집한 녹청균류들의 균사 생장이나 색소 생산에 가장 적합한 배양 조건을 찾고, 청록색 색소 발현도가 우수한 균주를 선발하기 위해 배지의 종류, 배양 온도의 변화, 배지의 pH 변화에 따른 배양 특성을 조사하였다.
고체배지의 종류에 따른 Chlorociboria spp.의 균사 생장 특성
일반적으로 한천 배지에서 녹청균의 생장은 매우 느린 것으로 알려져 있다[1, 2]. 녹청균류는 이당류인 maltose만으로 구성된 2% maltose extract agar (MEA) 배지에서 생장이 우수한 것으로 알려져 있으나[14], 이 배지에서도 one-point 접종법을 통해 배지 전면을 점유할 정도로 균이 생장하지는 않는다[2]. 2% MEA 배지에서 배양 시 Robinson과 Laks [1]은 자실체에서 분리한 녹청균류 균주 1개월 배양체의 균총이 18 mm [1]라 하였고, Robinson 등[22]은 변형술잔녹청균(C. aeruginascens) 균주들의 4개월 후 균총 크기가 18~28 mm 정도라 하였다. 이와 같이 녹청균류는 한천 배지에서 매우 느리게 생장하기 때문에 다량의 녹청균 색소를 확보하기 위해 고체배지를 이용한 균류 배양 시에는 five-point 접종법(배지 1개당 5개의 접종원을 접종)을 선택하기도 한다[14].
우리나라에 자생하는 녹청균류 또한 one-point 접종법을 통해 고체배지에서 배양한 결과, 느린 균사 생장 속도를 나타냈다. PDA 배지에서 60일 배양체의 균총 크기는 16~43 mm 범위였다. 녹청균류는 Jeon과 Ka [19]가 보고한 목재부후성 버섯류에 해당하지만, 균사 생장 속도는 목재부후균[19]보다 느리며 외생균근균[23]의 생장 속도와 비슷하였다. 녹청균류는 목재를 심하게 썩게 하는 균류가 아니라 연부후성 자낭균류이자 변색균이기에 일반적인 목재부후성 버섯과는 다른 생장 특성을 나타낸 것으로 보인다.
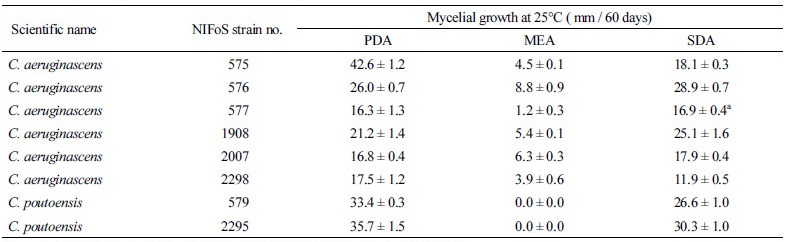
녹청균류 역시 PDA와 SDA 배지보다는 MEA 배지에서 균사 생장력이 가장 낮아 목재부후균이나 외생균근균에서와 같은 배양 특성을 나타냈다. 시험균의 63% (5균주/총 8균주)는 PDA 배지에서 더 잘 생장하였다(Table 2). C. aeruginascens 균주들 중 균사 생장력이 가장 높은 균주는 NIFoS 575로, PDA 배지에서 자란 60일 배양체의 균총 크기는 42.6 ± 1.2 mm였다. PDA와 SDA 배지 간 균 생장력을 비교하기 위해 유의수준 0.05에서 독립표본 t-검정을 실시하였다. 그 결과, 2균주(NIFoS 575, NIFoS 2298)는 유의 확률(p-value)이 0.05보다 낮아(p < 0.05) PDA와 SDA 배지에서의 균 생장력이 통계적으로 유의한 차이가 있음을 알 수 있었고, 따라서 SDA보다 PDA 배지에서 균 생장력이 높은 것으로 조사되었다. 이와 달리 3균주(NIFoS 576, NIFoS 1908, NIFoS 2007)는 PDA보다 SDA 배지에서 균 생장력이 유의하게 높았다(p < 0.05). NIFoS 577은 PDA와 SDA간 균사 생장력에 유의한 차이가 없었다(p ≥ 0.05). C. poutoensis 균주들은 SDA보다 PDA 배지에서 균사 생장력이 높았다. C. poutoensis 균주들 중 균사 생장력이 가장 높은 균주는 NIFoS 2295로, PDA 배지에서 자란 60일 배양체의 균총 크기는 35.7 ± 1.5 mm였다. C. aeruginascens 균주들과 달리 C. poutoensis 균주들은 MEA 배지에서 전혀 생장하지 않았다. Maltose가 함유된 고체배지임에도 우리나라에서 분리한 녹청균류들은 MEA 배지에서 균 생장이 저조하거나 전혀 생장하지 않는 생장 특성을 나타냈다. 2% MEA 배지에서 녹청균류의 균사 생장력를 조사했던 Robinson의 결과[1, 22]와 비교해보면, MEA 배지에서의 균사 생장력이 매우 낮은 것을 알 수 있다. Maltose가 함유된 동일한 한천 배지이지만, 본 시험에 사용한 MEA 상용 배지 내 maltose 함량은 1.3%이며, maltose 외에 dextrin과 peptone이 함유되어 있기 때문에 녹청균의 균사 생장력이 다르게 나타난 것으로 보인다. 또한, PDA나 SDA 배지보다 MEA 배지에서 균사 생장력이 낮았던 것은 배지 내 탄소원 함량 때문일 수도 있다. 시험 배지 3종의 탄소원 함량을 비교한 결과, SDA (4%)나 PDA (2.4%) 배지보다 MEA (1.6%) 배지의 탄소원 함량이 낮았다. 한편 Robinson 등[22]은 glucose와 sucrose 함량이 높은 목편(wood particle)을 한천 배지에 첨가했을 때 녹청균류의 균사 생장과 색소 형성이 촉진되는 연구 결과를 보고하였다. 본 연구의 결과와 Robinson 등[22]의 연구 결과를 종합해 볼 때, 고체배지 내 탄소원 함량이 녹청균의 생장에 중요한 영향을 끼친다는 것을 알 수 있었다.
고체배지에서 녹청균류 균총의 형태적 생장 특성을 조사한 결과, 균총의 색, 주름 형성 여부, 대사산물 방출 여부 등은 배지의 종류 및 균주에 따라 다르게 나타났다(Fig. 2). 녹청균류의 생장에 있어 색소 발현은 매우 중요 특성 조사 항목으로 균사 생장력이 청록색 색소 발현에 미치는 영향을 조사한 결과, 균사 생장이 낮은 MEA 배지에서는 색소 발현도 낮았다. 색소 발현 균주들(예: NIFoS 575, NIFoS 577)의 경우, 청록색 발색대의 크기는 균사 생장대보다 작은 경향을 나타냈다. C. aeruginascens 중에는 PDA 배지에서 균사 생장력이 가장 높았던 NIFoS 575가 가장 높은 색소 발현도를 나타냈는데, 균총의 중앙부는 청록색이나 균총의 외곽으로 갈수록 황색 색소가 관찰되었다(Fig. 2A). 이외에도 NIFoS 2298을 포함한 몇몇 균주들(NIFoS 576, NIFoS 577)은 PDA나 SDA 배지에 청록색 이외의 황색 색소를 생산하는 것이 관찰되었다. 황색~갈색 색소는 청록색 색소와 함께 균총에 혼재되어 있거나 액상의 물방울 형태로 균총 표면에 존재하거나 배지에 착색된 형태로 존재하였다. 녹청균류는 가끔 고체나 액체배지에 청록색 색소 이외에 황색 색소를 생산하는 데, 이는 xylindein의 전구체이거나 xylindein의 분해 산물인 xylindein quinol일 가능성이 있다고 한다[10, 22]. 특히 실험실 조건에서 관찰되는 xylindein의 분해 산물인 peri-xanthenoxanthene는 황색을 띠는 것으로 분석되었다[10]. 따라서 NIFoS 575를 포함한 몇몇 균주에서 발현된 황색 색소는 xylindein의 전구체이거나 분해 산물로 보여지는 xylindein quinol일 가능성이 있다. C. poutoensis 균주들의 색소 발현도는 C. aeruginascens보다 우수하였다. NIFoS 579와 NIFoS 2295 모두 PDA나 SDA 배지에서 황색 색소의 혼재 없이 균사 생장대와 유사한 크기로 청록색 발색대를 형성하였다(Fig. 2G, 2H).
배양 온도에 따른 Chlorociboria spp.의 균사 생장 특성
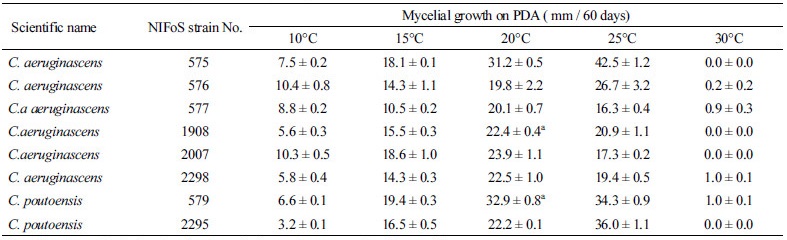
PDA 배지 상에서 온도 변화에 따른 녹청균류들의 균사 생장력을 조사한 결과, 시험균 모두 20~25°C에서 균사 생장력이 가장 높아 목재부후균[19]이나 외생균근균의 배양 특성[23]과 유사하였다(Table 3). 20°C와 25°C 간 균사 생장력을 비교했을 때, 2균주(NIFoS 1908, NIFoS 579)는 균사 생장력에 유의한 차이가 없었다(p ≥ 0.05). 10~20°C 범위에서는 모든 균주들이 배양 온도가 증가할수록 균사 생장력도 높아지는 경향을 나타냈으며, 30°C에서는 균이 거의 생장하지 않았으나 10°C에서는 균이 미약(10 mm 이하)하게라도 생장하여 녹청균은 저온보다는 고온에 더 민감하다는 것을 알 수 있었다. 흥미롭게도, 이러한 녹청균의 생장 특성은 저온보다 고온에 취약한 외생균근균의 온도 민감성[23]과 유사했으나, 30°C 고온보다 10°C 저온에서 균사 생장력이 낮은 일반적인 목재부후성 버섯균의 특성[19]과는 달랐다.

Fig. 2. Cultural characteristics and pigment expression of Chlorociboria aeruginascens strains (A~F) and Chlorociboria poutoensis strains (G, H) grown on different solid media (PDA, MEA and SDA) at 25°C for 60 days. A, NIFoS 575; B, NIFoS 576; C, NIFoS 577; D, NIFoS 1908; E, NIFoS 2007; F, NIFoS 2298; G, NIFoS 579; H, NIFoS 2295; NIFoS, National Institute of Forest Science; PDA, potato dextrose agar; MEA, malt extract agar; SDA, Sabouraud dextrose agar.
배양 온도가 청록색 색소 발현에 미치는 영향을 조사한 결과, 대부분의 균주들은 10°C나 30°C보다 20~25°C에서 색소 발현도가 높아 균사 생장력이 높은 온도 조건에서 색소 발현도도 높은 것을 알 수 있었다(Fig. 3). 이러한 특성은 C. aeruginascens보다는 C. poutoensis 균주들에서 더 명확히 관찰할 수 있는데, NIFoS 579와 NIFoS 2295는 30°C를 제외한 배양 온도 범위에서 온도가 증가할수록 균사 생장력과 색소 발현도가 높았다(Fig. 3G, 3H). C. aeruginascens의 4균주(NIFoS 575, NIFoS 576, NIFoS 577, NIFoS 2298)는 20~25°C에서 배양 시 xylindein quinol로 추정되는 황색 색소를 발현하였다. C. poutoensis의 균주들은 C. aeruginascens 균주들과는 달리 더 낮은 온도(10~20°C)에서 황색 색소가 생성된 것을 볼 수 있었다. 특히, 황색 색소는 NIFoS 579보다 NIFoS 2295의 균총이나 배지에서 더 많이 관찰되었다. 총 8개의 시험균 중 배양 온도 변화에도 가장 안정적으로 청록색 색소 발현을 유지한 균주는 NIFoS 579였다(Fig. 3G).

Fig. 3. Cultural characteristics and pigment expression on PDA of Chlorociboria aeruginascens strains (A~F) and Chlorociboria poutoensis strains (G, H) grown at various temperatures (10°C, 15°C, 20°C, 25°C and 30°C) for 60 days. A, NIFoS 575; B, NIFoS 576; C, NIFoS 577; D, NIFoS 1908; E, NIFoS 2007; F, NIFoS 2298; G, NIFoS 579; H, NIFoS 2295; NIFoS, National Institute of Forest Science; PDA, potato dextrose agar.
배지의 pH 변화에 따른 Chlorociboria spp.의 균사 생장 특성
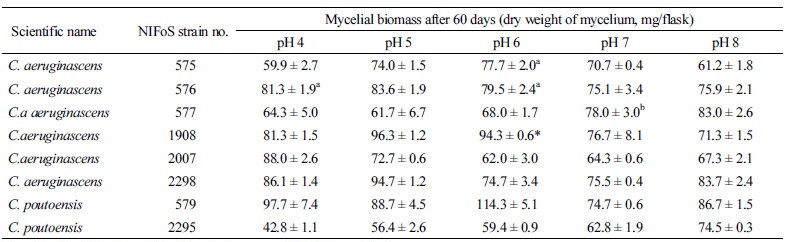
배지의 pH 변화는 균류의 생장뿐만 아니라 색소 생산성에 영향을 끼칠 수 있다. 홍국균(Monascus ruber)은 pH 2인 고체배지에서는 노란색, pH 8인 배지에서는 붉은색의 색소를 생산하며, 변형술잔녹청균(C. aeruginascens)은 배지의 pH 변화에 따라 균사체의 색상이 다르게 나타나는데, 황녹색~갈녹색 범위의 색소 생산에 적합한 고체배지의 pH 범위는 2.5~7.5로 제한되어 있다[2]. 녹청균류의 색소 생산성에 영향을 끼칠 수 있는 또 하나의 요인은 균사 생장력이다. 액체 배양은 균류의 생장과 이차대사산물의 생산을 증가시키기 위한 방법으로[10], 자연계와 실험실 내 고체배지에서는 녹청균류의 생장이 느리기 때문에 균류의 생장과 색소 생산을 촉진하기 위해 액상 회분식 배양 조건을 선택하기도 한다[10]. 본 연구 또한 회분식 액체배양을 통해 배지의 pH 변화에 따른 녹청균류의 균사 생장 특성을 조사한 것으로, 동일한 균종 내에서도 균주에 따라 최대 균체량을 나타내는 pH 범위가 다르게 나타났다. 시험균의 63%는 pH 5~6에서, C. aeruginascens NIFoS 2007은 pH 4.0에서, C. poutoensis NIFoS 2295는 pH 8.0인 배지에서 생장력이 가장 높았다(Table 4). 총 8개의 시험균 중 가장 많은 균체량을 생산한 균주는 NIFoS 579 (114.3 ± 5.1 mg/flask at pH 6.0)였다. 3종류의 고체배지 중 PDA (pH 6.0)에서 균사 생장력이 가장 높았던 2균주(NIFoS 575, NIFoS 579)는 agar를 제외하고는 배지 조성과 산성도가 동일한 PDB (pH 6.0)에서도 가장 높은 균사 생장력을 나타내어 두 균주의 균사 생장에 적합한 배지의 산성도는 pH 6.0임을 알 수 있었다.
pH 변화나 균주에 따라 균사체의 색상 발현도는 다소 차이가 있었지만, 8개 균주 모두 액체배지에서 색소를 띠는 균사체를 생성하여 정치배양 조건에서 세포외 색소물질을 생성할 수 있는 능력이 있는 것으로 조사되었다(Fig. 4). 2균주(NIFoS 576, NIFoS 2295)를 제외한 6균주는 균사 생장력이 가장 높았던 배지에서 청록색 색소 발현이 유지되었다. 특히, NIFoS 575와 NIFoS 579는 다른 균주들에 비해 넓은 pH 범위에서 청록색 색소 발현을 유지하였다. 모든 시험균은 특정 pH 조건에서 청록색 색소 이외에 황색 색소도 발현하였다. NIFoS 575는 pH 4.0에서 청록색 색소의 발현이 높았으나, pH 8.0 부근에 가까울수록 점차 황색 색소가 발현되는 것을 관찰할 수 있었다. NIFoS 576은 pH 4.0에서만 황색 색소가 발현된 반면, NIFoS 2295는 모든 pH 범위에서 황색 색소가 발현되었다. 동일한 C. poutoensis 종이지만, NIFoS 579와 NIFoS 2295 균주의 색소 발현 양상은 동일한 pH 의 고체배지와 액체배지에서 큰 차이를 나타냈다. 두 균주 모두 PDA (pH 6.0) 배지에서는 청록색 색소 발현도가 매우 높지만(Fig. 2G, 2H), PDB (pH 6.0) 배지에서는 청록색 색소 발현이 우세한 NIFoS 579와 달리 NIFoS 2295는 황색 색소의 발현이 우세하였다(Fig. 4G, 4H). 또한, NIFoS 2295는 NIFoS 579보다 넓은 온도 범위에서 황색 색소가 발현되어 세포외 색소물질 생성에 있어 NIFoS 2295는 NIFoS 579보다 배양 온도와 액상 환경의 변화에 더 큰 영향을 받는 것으로 나타났다.

Fig. 4. Cultural characteristics and pigment expression of Chlorociboria aeruginascens strains (A~F) and Chlorociboria poutoensis strains (G, H) at different pH values. All strains were incubated at 25 ± 2°C for 60 days under static and dark conditions. A, NIFoS 575; B, NIFoS 576; C, NIFoS 577; D, NIFoS 1908; E, NIFoS 2007; F, NIFoS 2298; G, NIFoS 579; H, NIFoS 2295; NIFoS, National Institute of Forest Science.
Weber 등[10]은 녹청균류의 균주들이 정적인 환경과 흔들리는 액체 배양 환경 모두에서 ‘분리된 알갱이(pellets)’ 형태로 자라는 경향이 있다고 보고하였다. 본 실험에서도 정치배양한 시험균 모두 액체배지의 모든 pH 범위에서 크기는 다양하지만 pellets 형태로 생장하는 것을 관찰할 수 있었다. 또한, 청록색 색소 발현도가 높은 NIFoS 579 균주는 pH 7.0에서 접종원을 중심으로 두꺼운 mycelial mat를 형성하기도 하였다(Fig. 4G).
Chlorociboria spp.의 세포외효소 활성
동일한 목재부후균이지만 백색부후균은 cellulose, hemicellulose, lignin을 각각 비슷한 속도로 분해하는 한편, 연부후균은 cellulose를 먼저 분해하고 소량의 lignin을 분해하는 특성을 갖고 있다[4]. 이는 두 균류 간의 세포벽 구성성분 분해율은 다르지만, 연부후균인 녹청균류도 백색부후균처럼 목질분해효소를 생성하여 세포 밖으로 방출할 가능성이 있음을 의미한다. 자연계에서 녹청균류의 목질분해력은 녹청균류가 갖는 고유한 특성 중 하나이긴 하지만, 실험실 내 인공배지에서 배양 시 그 특성을 유지하고 있는지는 알 수 없다. 또한, 전술한 Robinson 등[22]의 연구 결과를 보면, 실험실 내 인공배지에 첨가되는 목편 첨가물의 종류가 녹청균류의 생장과 청록색 색소 생산에 영향을 끼칠 수 있기 때문에 균류의 목질분해효소 활성도는 목편을 첨가한 녹청균류의 인공배지 개발에도 중요한 영향을 끼치는 요인이 될 수 있다. 이와 같은 이유로 본 연구에서는 녹청균류의 목질분해효소 활성을 조사하였으며, cellulase와 laccase를 모두 생산할 수 있는 백색부후균을 비교 대상으로 하였다. 백색부후균 중 특히, 구름송편버섯은 목재부후성을 탐지하거나 목재 방부제의 유효성을 시험하는 데에 사용되며[24], 구름송편버섯이 생산하는 cellulase와 laccase는 상업적인 활용이 고려될 만큼 주목 받고 있는 이차대사산물이기도 하다[25, 26]. 따라서 본 연구에서는 우리나라에서 수집한 녹청균류의 세포외효소(cellulase와 laccase) 생산 여부, cellulase와 laccase 활성을 모두 나타내는 백색부후균(T. versicolor KCCM 11502)에 대한 녹청균류의 상대적 효소 활성도(REA), 효소 활성 검색용 배지(CMC와 ABTS agar plate)에서 균사 생장과 효소 활성 발현과의 상관성 등을 조사하였다.
CMC 배지에서 8일간 배양 후 녹청균류의 균사 생장 여부를 조사한 결과, NIFoS 579를 제외한 모든 시험균은 CMC 배지 상에서 생장하지 않았다(Table 5). 그러나 균사 생장 여부와 상관없이 cellulase 활성 발현은 모든 시험 균주에서 나타났다(Fig. 5). 시험균 중 NIFoS 579는 가장 높은 cellulase 활성(34.8 ± 0.8 mm)을 나타냈으며, 구름송편버섯(KCCM 11502)에 대한 REA도 71%로 나타나 8개의 시험균 중 백색부후균에 가장 가까운 효소 활성도를 보였다. 이 균주는 고체와 액체배지 모두에서 청록색 색소 발현도가 가장 우수한 균주이기도 하다. NIFoS 579와 달리 C. aeruginascens 균주들 중 고체와 액체배지에서 청록색 색소 발현도가 가장 우수했던 NIFoS 575는 동일 균종 내에서도 가장 REA가 낮았다(36%). C. aeruginascens 균주 내에서 REA 50%에 근접한 균주는 NIFoS 2298 (REA 49%)였다.
ABTS 배지에서 5일간 배양한 후 녹청균류의 균사 생장 여부를 조사한 결과, C. aerug-inascens 중 1균주(NIFoS 576)와 C. poutoensis 중 2균주(NIFoS 579, NIFoS 2295) 모두 ABTS 배지 상에서 생장하였다(Table 6). 균사 생장대의 크기는 10 mm 이하로 백색부후균인 구름송편버섯(KCCM 11502)의 크기(17.8 ± 1.9 mm) 절반 정도로 작았다. 균사 생장 여부와 상관없이 laccase 활성 발현은 모든 시험 균주에서 나타났으며(Fig. 5), 균사 생장대와 발색대의 크기간 상관성도 찾을 수 없었다. 시험균 중 NIFoS 579는 가장 높은 laccase 활성(46.3 ± 1.7 mm, REA 67%)을 나타냈으며, 이와 동일 종인 NIFoS 2295는 NIFoS 579보다 약 2배 낮은 laccase 활성을 나타냈다. C. aeruginascens 균주들 중 2균주(NIFoS 576, NIFoS 2298)는 REA 50%에 근접한 반면, NIFoS 575는 동일 균종 내에서 가장 낮은 REA (18%)를 나타냈다.
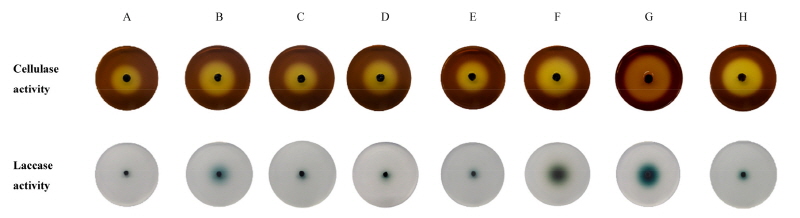
Fig. 5. Cellulase and laccase activities of Chlorociboria aeruginascens strains (A~F) and Chlorociboria poutoensis strains (G, H) on two different enzyme detection media (CMC and ABTS agar plates). CMC agar plates (55 mm in diameter) were incubated for 8 days at 25°C. ABTS agar plates (85 mm in diameter) were incubated 5 days at 25°C. A, NIFoS 575; B, NIFoS 576; C, NIFoS 577; D, NIFoS 1908; E, NIFoS 2007; F, NIFoS 2298; G, NIFoS 579; H, NIFoS 2295; NIFoS, National Institute of Forest Science; CMC, carboxymethylcellulose; ABTS, 2, 2'-azino-bis(3-ethylbenzthiazoline-6-sulfonic acid).
본 실험에 사용한 2종류의 효소 검색용 배지는 한 배지 내에 cellulase와 laccase 활성을 동시에 검색할 수 있는 기질이 포함된 배지가 아니므로, 시간에 따른 연부후균의 전형적인 목질 분해 특성을 찾을 수는 없었다. 그러나 모든 시험 균주는 각각의 효소 검색용 배지에서 백색 부후균보다는 활성이 낮지만 cellulase와 laccase 활성을 나타내었다. 또한, 시험균 중 NIFoS 579는 고체와 액체배지에서 청록색 색소의 발현도가 우수했을 뿐만 아니라 변화하는 다양한 배양 조건에서도 안정적으로 청록색 색소 발현을 유지하는 특성이 있었으며, 2종류의 세포외효소 활성도도 시험균 중 가장 높은 것으로 나타나 자연계의 목재나 실험실 배양 조건 모두에 적응력이 강할 것이라 예측되기 때문에 천연염료 개발에 유용한 미생물 자원이 될 것으로 기대한다.