서 론
대부분의 병원체에 존재하여 우리의 면역세포와 반응하게 되는 일반적인 병원체 유래 물질의 종류를 일컬어 병원체 분자형태(pathogen-associated molecular patterns, PAMPs)라고 한다. 이들은 박테리아, 균류, 몇몇 진핵생물의 세포 표면에 존재하는 물질로 β-glucan, flagellin, lipopolysaccharide (LPS), lipoteichoic acid, peptidoglycan, CpG 등이 바로 그러한 물질이다[1]. 이러한 PAMPs에 대응하여 반응하는 숙주의 단백질이 형태인식수용체(pattern recognition receptors, PRRs)이며 toll-like receptor (TLR), CD14, LPS binding protein (LBP), mannose receptor, lectin류 등이 바로 여기에 해당된다[2]. 면역반응은 이들 PAMPs와 PRRs의 상호인지를 통한 자극에 의해 선천성 면역반응이 개시되고, 여기에 가담되는 대식세포, 수지상세포, 그 외 림프구들에 의해 분비되는 매개물질이나, 제시된 항원에 의해 B-cell과 T-cell이 활성화되는 세포성 면역까지 이어진다[3].
당생물학(Glycobiology)은 최근 들어 각광 받고 있는 새로운 분야이다. 다양한 당화합물이 세포 표면에 존재하는 여러 수용체와 결합하거나 활성을 조절하기도 하고 염증반응 등을 일으키기도 한다[4]. 그 중에서 β-glucan은 β-D-glucopyranose 단위를 기본으로 하면서 다양한 가지를 갖는 중합체이며 주로 세균, 진균, 심지어 식물의 세포벽에 존재하기도 한다. β- Glucan은 크기에 따라 다양한 기능을 수행하는데, 큰 분자량의 zymosan과 같은 경우 직접적으로 백혈구를 활성화시키고 염증 매개 물질의 생성을 유발한다[5]. 반면, glucan phosphate와 같은 작은 분자량의 β-glucan은 작은 효과의 생리활성을 나타내며 세균 등의 LPS와 같은 부수적 성분에 대한 반응을 증가시키고, 핵전사인자의 활동을 매개한다[6]. β-Glucan의 기능은 방사선에 대한 보호작용, 암 억제, 다양한 병원체의 감염에 대한 방어작용을 한다고 알려져 있다[7].
PAMPs에 대항한 숙주의 반응인자인 PRRs의 한 종류인 렉틴(lectin)은 리간드의 종류에 따라, P-type, C-type, S-type, I-type으로 나뉜다[8]. 이 중에서 Dectin-1은 칼슘 의존성 효과를 나타내는 C-type 렉틴의 한 갈래이다. C-type 렉틴류는 렉틴 구조 내 Ca2+-의존성인 탄수화물 인식영역(carbohydrate recognition domain, CRD) 부위를 통하여 진균류의 당 리간드를 인지함으로써 면역세포로 하여금 선천성 면역반응을 유도한다[9, 10].
Dectin-1은 TLR과 작용할 뿐만 아니라 syk kinase와도 반응한다. 이때 Dectin-1/Syk와 Dectin-1/TLR2 신호전달 경로는 서로 독립적으로 작용한다[11]. Dectin-1은 β-glucan의 수용체로써 대식세포가 진균류를 인식하게 하거나 포식작용을 유도하며, 반응성산소종 (reactive oxygen species, ROS)의 생성 및 염증성 사이토카인의 유도를 일으키기도 한다. Spleen tyrosine kinase (Syk)는 tyrosine kinase로써 B cell과 T cell 수용체, Fc 수용체를 통한 신호전달을 담당함으로써 후천성 면역반응에 중요한 역할을 한다[12]. Dectin-1의 발현은 TLR을 통한 NF-kB의 활성을 증가시킨다. 또한 대식세포와 수지상세포에서 Dectin-1과 TLR의 협동작용은 interleukin (IL)-12와 tumor necrosis factor (TNF)-α의 발현을 더 증가시키고, Dectin-1은 ROS의 생성에도 관여하는데, 이는 TLR에 의한 염증반응에서도 일어난다[13]. TLR을 통한 MyD88-의존적인 NF-kB 신호전달 경로는 myocardial ischemia/ reperfusion injury를 일으키지만, PI3K/Akt 신호전달은 보호작용을 나타낸다. Glucan phosphate의 처리는 TLR에 의한 활성 신호를 억제하고, PI3K/Akt 신호전달은 활성화시킨다고 알려졌다[14]. Dectin-1 수용체 단백질의 세포질 부위에 있는 ITAM-like motif의 15번째 tyrosine이 Syk kinase로 인산화되면 Dectin-1의 신호전달이 개시된다[15].
Dectin-1은 TLR과 반응하여 임파구 증식과 T cell의 분화를 유도하기도 한다[16]. 현재까지 알려진 포유동물의 TLR은 인간에서는 13종, 마우스는 10종이 알려져 있으며, 모두 미생물 인식수용체로 선천성 면역에서 중추적인 역할을 한다. TLR이 인지하는 리간드는 변형 지질류(세균의 LPS 등), 단백질류(flagellin)와 핵산류(DNA, dsRNA, CpG) 등이 알려져 있다[17]. 효모 유래의 zymosan은 TLR2/6 heterodimer와 반응하여 활성화되며, Saccharomyces속 또는 Candida속 유래의 mannan은 TLR4와 반응한다[18]. 또한 TLR2와 TLR6은 Dectin-1과 함께 작용하여 β-glucan의 신호전달에 관여한다[19]. 예를 들면 TLR2와 TLR6이 zymosan의 자극을 받으면 NF-kB가 활성화되고 TNF-α가 분비되는데 이때 TLR2와 TLR6은 heterodimer가 된다[20].
본 연구에서는 Ganoderma lucidum 유래의 β-glucan이 대식세포주에서 Dectin-1과 TLR류의 발현을 촉진하였으며, 대식세포에서 β-glucan에 의하여 발현이 촉진되는 염증성 매개물질인 macrophage inflammatory protein (MIP)류와 TNF-α 등은 PI3K/Akt 경로와 MEK 신호전달 경로를 경유하여 발현됨을 밝혔다.
재료 및 방법
시험균주 및 β-Glucan 추출
농촌진흥청에서 분양 받은 불로초(Ganoderma lucidum ASI-7004) 자실체에서 분리한 β- glucan 분획을 사용하였다. 건조시킨 불로초 자실체 1 kg을 분말화한 후에 열수로 8~12시간 추출 및 여과한 용액을 농축하여 3배 부피의 냉에탄올을 가하여 β-glucan 분획을 얻었다. 이 분획을 DEAE-cellulose (Cl- form) 칼럼에 증류수로 통과시킨 후, 3배의 냉에탄올을 가하여 13 g의 침전물을 얻었다. 그중 2 g을 Sephadex G-100을 증류수로 통과시켜 정제하여 1.8 g의 β-glucan 분획을 얻었다. 이 분획은 phenol-황산법과 Lowry-Folin법에 의하여 분석한 결과 95%의 다당체와 5%의 단백질로 구성됨을 확인하였으며 이 분획을 본 실험에 사용하였다.
분석 시약
LPS와 polymyxin B (PB)는 Sigma-Aldrich (St. Louis, MO, USA) 제품을 사용하였다. PI3K 억제제인 LY294002와 MEK1/2 억제제인 U0126 역시 Sigma-Aldrich 제품을 사용하였다. RT-PCR에 사용된 IL-1β, IL-6, MIP-1α, MIP-1β, MIP-1γ, TLR-2, TLR-4, TLR-6, TNF-α, GAPDH primer와 cDNA 합성에 사용된 oligo (dT)는 Cosmogenetech (Seoul, Korea) 제품을 사용하였다. Secretion protein인 TNF-α를 측정하기 위해서 사용된 ELISA kit인 OptEIA는 BD Biosciences (San Jose, CA, USA)에서 구입하여 사용하였다. Cell culture에 사용된 Dulbecco’s modified eagle medium (DMEM), penicillin-streptomycin과 fetal bovine serum (FBS)은 Gibco-BRL (Grand Island, NY, USA) 제품을 사용하였다. RNA 분리에 사용된 TRIzol reagent는 Gibco-BRL 제품을 사용하였고, cDNA 합성에 사용한 M-MLV reverse transcriptase는 Promega (San Luis Obispo, CA, USA)제품을 사용하였다. PCR에 사용한 Taq DNA polymerase는 Biotools (Madrid, Spain) 제품을 사용하였고, deoxynucleotide triphosphate (dNTP)는 Cosmogenetech (Seoul, Korea) 제품을 사용하였다.
세포 배양 및 RNA 분리
Mouse monocyte-macrophage RAW264.7 (ATCC, Manassas, VA, USA)를 DMEM medium에 10% 열처리 불활성화(56°C, 30 min)시킨 소태아혈청(FBS; Gibco-BRL)과 penicillin (10,000 units/mL)-streptomycin (10,000 units/mL)을 첨가하여 계대배양 하였고, 37°C, 5% 배양기에서 배양하였다. Total RNA는 6 well plate에 RAW264.7 cells을 배양하여 LPS, PB, β-glucan을 처리하고 TRIzol 시약을 사용하여 분리하였다. RAW264.7 cells을 1 mL의 TRIzol을 각각의 6 well plate에 처리하고 여러 번 pipetting 하여 세포를 분해시키고 1.5 mL tube에 옮겼다. 0.25 mL의 chloroform:isoamylalcohol (24:1)을 첨가하여 15초간 흔들어 주고 ice 상에서 10분간 배양하고, 12,000 xg, 4°C, 15분간 원심분리 하였다. 상등액만 새로운 tube에 옮겨 담고, RNA를 침전시키기 위해서 0.5 mL의 isopropyl alcohol을 넣고 부드럽게 흔들어 주었다. 그 후 ‑20°C에서 30분간 incubated 하고, 12,000 xg, 4°C, 20분간 원심분리 하였다. 상등액을 제거하고 남아 있는 RNA 침전물을 75% ethanol을 1 mL 첨가하여 세척하고 8,000 xg, 4°C, 15분간 원심분리 하였다. 상등액을 제거하고 남아 있는 RNA 침전물을 공기 중에서 10분간 말려주고 RNase-free water (DEPC-water)에 녹였고 ‑80°C에서 보관하였다.
RT-PCR에 의한 mRNA 증폭
Two step RT-PCR을 하였고 M-MLV reverse transcriptase (M-MLV-RT)를 사용하여 RNA를 역전사하여 cDNA를 합성하였다. 최종 부피를 20 µL로 하고 0.5 µg/µL oligo (dT), ddH2O, 2.5 mM dNTP, 5 × reaction buffer (75 mM Tris-HCl, 2 mM MgCl2, 50 mM KCl, 20 mM (NH4)2SO4, pH 9.0), 70°C, 10분간 불활성화시킨 total RNA, M-MLV-RT (200 units)를 첨가하여 42°C에서 1시간 동안 역전사하였다. PCR에 사용된 primers는 합성하여 사용하였고 염기서열은 Table 1과 같다.
Conditioned medium의 제조
6 well plate (total culture medium volume 2 mL)에서 RAW264.7 cells을 전날 1 × 106 cells/mL로 seeding하고 LPS, PB, β-glucan 300 µg/mL을 처리하고 6시간, 12시간, 18시간, 24시간 후에 배양한 배지를 모아서 conditioned medium으로 ELISA로 분석하였다. 그리고 LPS + PB, PB + LPS의 경우 LPS나 PB를 1시간 전에 먼저 처리하고 1시간 후에 다시 LPS나 PB를 처리하였다. LY294002와 U0126은 10 µM로 처리하여 실험하였다.
ELISA 분석
Coating buffer에 capture 항체를 1:250으로 희석하고 96-well plate의 각 well에 100 µL씩 넣고 plate를 밀봉하여 4°C에서 하룻밤 배양하였다. 다음 날 coating buffer를 제거하고 각 well당 300 µL의 wash buffer로 3번 세척한 후, 200 µL/well assay diluent로 plate를 blocking 하고, RT에서 1시간 동안 배양하였다. Assay diluent를 제거하고 각 well당 300 µL의 wash buffer로 3번 세척해 주었다. 각 well에 준비된 standard와 시료를 100 µL씩 넣어 주고 RT에서 2시간 동안 배양하고, 2시간 후 standard와 시료를 제거하고 각 well당 300 µL의 wash buffer로 5번 세척하였다. Working detector (detection Ab + SAv-HRP reagent 모두 1:250으로 희석된 것)를 각 well 당 100 µL씩 넣어 주고 plate를 sealing한 후 RT에서 1시간 동안 incubated 하였다. 1시간 후 working detector를 제거하고 각 well당 300 µL의 wash buffer로 7번 한 후, substrate solution (TMB substrate reagent set)을 1:1로 섞어주고 각 well당 100 µL씩 넣고 plate가 빛에 노출되지 않게 하여 RT에서 30분간 incubated 하였다. 30분 후 각 well에 50 µL의 stop solution (2 N H2SO4 또는 1 M H3PO4)을 넣어 주고, 450 nm에서 흡광도를 측정하였다. 흡광도 값은 450 nm의 흡광도에 570 nm의 흡광도를 빼서 보정하였다.
결 과
대식세포 RAW264.7에서 β-Glucan 수용체인 Dectin-1의 발현
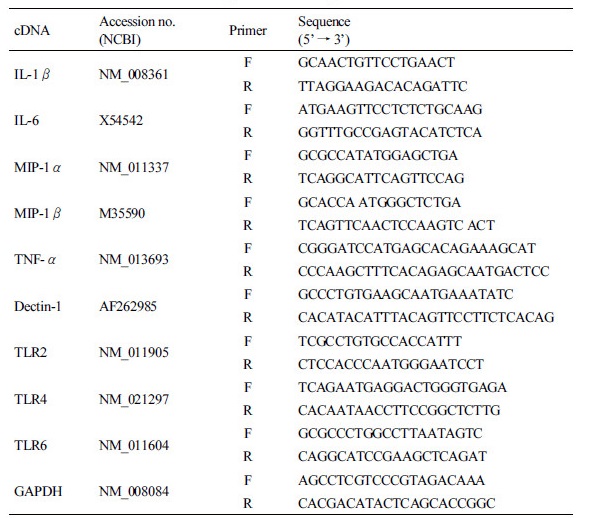
RAW264.7 cell (mouse macrophage)에서 Dectin-1 (β-glucan receptor)의 발현을 알아보기 위해서 불로초에서 분리한 β-glucan을 12시간 처리한 다음, mRNA를 분리하였다. 분리된 mRNA로 cDNA를 합성하고 마우스 Dectin-1 primer를 사용하여 RT-PCR을 통하여 Dectin-1의 발현을 분석하였다. 그 결과, RAW264.7 cell에서 757 bp의 Dectin-1α와 650 bp의 Dectin-1β 두 가지의 isoform의 발현을 확인하였다(Fig. 1). Dectin-1α와 Dectin-1β는 모두 β-glucan의 수용체로서 작용할 수 있다. Dectin-1α는 full length form으로 C-type lectin-like domain (CRD), stalk region, transmembrane region (TM), cytoplasmic tail인 immunoreceptor tyrosine-base activation motif (ITAM)를 가지고 있고, Dectin-1β는 full length form에서 stalk region 부분만 splicing된 형태로 존재한다[21].
β-Glucan에 의한 Dectin-1과 TLR의 발현 유도
β-Glucan을 농도별로 처리하고 LPS를 양성 대조군으로 사용하여 Dectin-1의 발현과 toll-like receptor (TLR)-2, -4, -6을 RT-PCR을 통해서 확인하였다. LPS를 100 ng/mL, β-glucan을 100 µg/mL (β 100)과 300 µg/mL (β 300)을 처리하고 12시간 후에 RNA를 분리하여 cDNA를 합성하고 RT-PCR을 수행하였다. LPS는 그람 음성균의 외막에 존재하는 integral component로 대식세포의 강력한 activator로 endotoxic shock을 유발할 수 있다. Dectin-1의 발현은 LPS를 단독으로 처리했을 경우(172.3 AU, arbitrary unit)는 대조군(186.3 AU)의 Dectin-1 발현과 유사하였지만, β-glucan (100과 300 µg/mL) 처리에 의해서는 각각 19.7% (223.1 AU)와 43.6% (267.5 AU)가 증가하였다. LPS와 β-glucan (100과 300 µg/mL)을 동시에 처리한 경우의 Dectin-1 발현은 β-glucan을 단독으로 처리했을 경우보다 증가하였다(Fig. 2). 외부에서 침입한 병원체에 의해서 자극을 받으면 대식세포는 cytokines을 분비하고 선천성 면역에 중추적인 역할을 하는 TLR-2, TLR-4, TLR-6에 의해서 면역반응이 일어나게 된다. β-glucan에 의하여 TLR-2의 발현은 유도되지 않았으나 TLR-4와 TLR-6은 농도 의존적으로 발현이 증가되었다(Fig. 2).
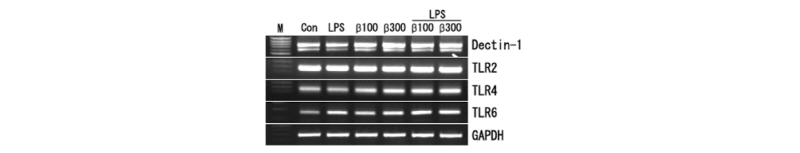
Fig. 2. Modulation of Dectin-1 and TLRs mRNA expression by β-glucan in RAW264.7 cells. RAW264.7 cells were treated with LPS (100 ng/mL) and/or β-glucan (100 and 300 µg/mL) for 12 hr. After the RNA isolation from the treated cells, RT-PCR was carried out for the detection of Dectin-1 and TLRs mRNA expression. TLR, toll-like receptor; LPS, lipopolysaccharide.
β-Glucan에 의한 사이토카인과 MIP-1의 발현 증가
병원체의 자극을 받게 되면 대식세포는 방어 작용을 일으키기 위해서 cytokine과 chemokine을 발현하여 면역반응을 유도하게 된다. 그래서 LPS, LPS 억제제인 PB와 β-glucan의 자극에 의해서 cytokine과 macrophage inflammatory protein-1 (MIP-1)의 유전자 발현에 관해 알아보기 위하여 6시간, 12시간, 18시간, 24시간 별로 LPS (100 ng/mL), PB (10 µg/mL)와 β-glucan (300 µg/mL)을 처리하고 RNA를 분리하여 RT-PCR을 하였다. 역시 LPS와 PB를 같이 처리할 경우, 1시간 전에 LPS나 PB를 먼저 처리하고 1시간 후에 다시 LPS나 PB를 처리하였다. LPS와 β-glucan을 단독으로 처리하였을 때 IL-1β는 12시간 이후부터 발현이 크게 증가하였으며 24시간까지도 발현이 고농도로 유지되었다. 또한 LPS와 β-glucan을 동시에 처리하면 시간이 경과할수록 IL-1β의 발현이 상승작용을 보이면서 증가하였다(Fig. 3A). MIP-1α, MIP-1β, MIP-1γ의 경우 LPS와 β-glucan을 6시간과 12시간을 처리하였을 때 점차 발현이 증가하다가 18시간에서 가장 많이 발현되었으며 24시간에서는 점차 감소되었다. MIP-1의 발현도 LPS와 β-glucan을 동시에 처리하면 상승작용을 보이면서 증가하였다(Fig. 3B~3D). 한편, TNF-α 발현의 경우는 LPS와 β-glucan을 동시에 처리하면 12시간에서 TNF-α를 가장 많이 발현하였고 그 후로 점차 감소하였다(Fig. 3E). 따라서 TNF-α 역시 LPS와 β-glucan을 같이 처리하면 상승작용을 나타내었다. 이 결과를 통해 대식세포는 외부로부터 LPS를 소유한 병원체가 침입하면 가장 먼저 면역반응을 유발하여 TNF-α를 분비하고 TNF-α는 MIP-1과 IL-1β 발현을 유도한다고 추측된다. 또한 LPS와 β-glucan의 공동 처리에 의하여 여러 cytokine과 MIP-1 같은 염증반응에 관여하는 단백질이 상승작용을 일으킴을 확인할 수 있었다.
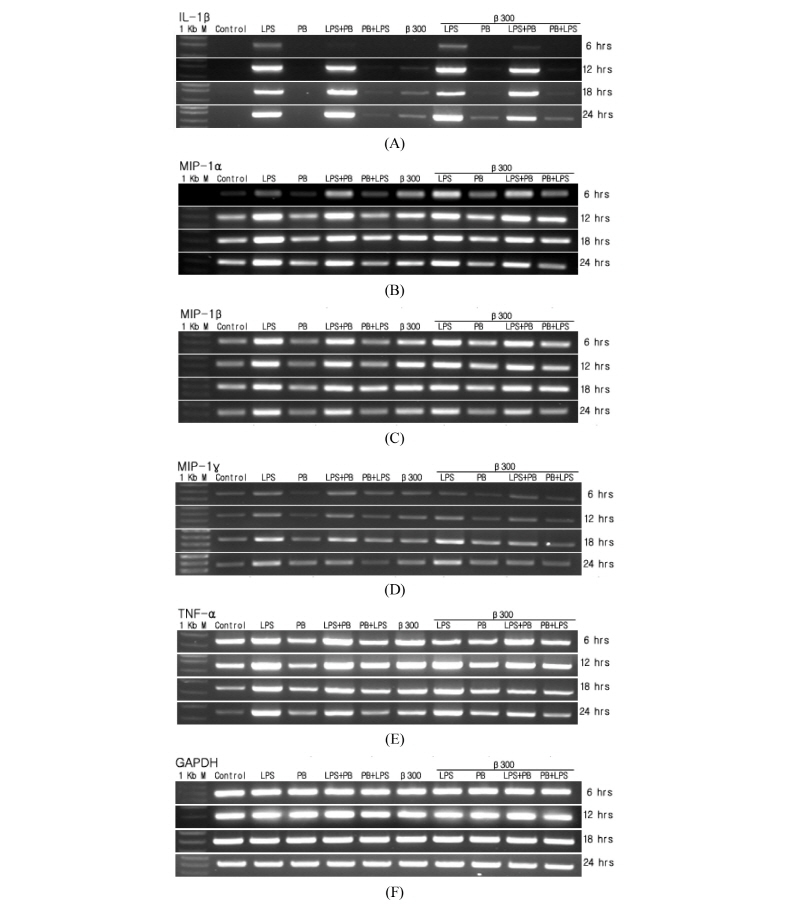
Fig. 3. Time-dependent modulation of cytokine and chemokine mRNA by β-glucan in RAW264.7 cells. RAW264.7 cells were treated with LPS (100 ng/mL), PB (10 µg/mL) and/or β-glucan (300 µg/mL) for 6 hr, 12 hr, 18 hr, and 24 hr. After isolation of the RNA, RT-PCR was carried out. IL-1, interleukin-1; MIP, macrophage inflammatory protein; TNF, tumor necrosis factor; LPS, lipopolysaccharide; PB, polymyxin B.
β-Glucan에 의한 TNF-α의 단백질 발현
LPS, PB와 β-glucan의 자극에 의해서 단백질 수준에서 TNF-α의 발현에 관해 알아보기 위하여 6시간, 12시간, 18시간, 24시간 별로 LPS (100 ng/mL), PB (10 µg/mL)와 β-glucan (300 µg/mL)을 처리한 후에 conditioned medium으로 ELISA assay를 실시하였다. LPS와 PB를 같이 처리할 경우, 1시간 전에 LPS나 PB를 먼저 처리하고 1시간 후에 다시 LPS나 PB를 처리하였다.
먼저 LPS, PB와 β-glucan을 24시간 처리 하였을 때, LPS를 처리한 군은 대조군 (382.76 ± 17.57 pg/mL)에 비하여 636.5% (2436.39 ± 28.51 pg/mL) 증가하였고, β-glucan을 처리한 군은 대조군의 204.69% (783.49 ± 38.17 pg/mL) 증가하였다. LPS와 β-glucan을 같이 처리한 군의 경우, 766.03% (2932.04 ± 23.01 pg/mL) 증가하였다. LPS 처리군(2436.39 ± 28.51 pg/mL)에 비하여, LPS와 PB를 동시에 처리하면 18.9% (1974.79 ± 56.45 pg/mL)가 감소하였다. 그러나 여기서 PB를 먼저 처리하고 1시간 후 LPS를 처리한 군은 LPS와 PB를 동시에 처리한 군에 비하여 67.4% (644.36 ± 27.18 pg/mL)가 감소하였다. 한편 LPS를 1시간 먼저 처리하고 PB와 β-glucan을 나중에 처리하였을 경우, LPS와 β-glucan을 같이 처리한 sample과 거의 비슷하게 TNF-α의 발현이 증가하였다. 그러나 PB와 β-glucan을 같이 처리한 경우, β-glucan을 단독으로 처리했을 때와 거의 차이가 없었고, PB를 1시간 먼저 처리하고 1시간 후에 LPS와 β-glucan을 같이 처리한 경우는 PB와 β-glucan을 같이 처리했을 때보다 대략 1.5배 증가하였다(Fig. 4A). 대식세포에서 분비되는 TNF-α의 단백질 발현량을 6, 12시간, 18시간, 24시간 별로 확인하였다. LPS를 단독으로 처리하였을 때 6시간에 강하게 발현되었고, PB만 단독으로 처리하였을 때는 control과 거의 비슷하게 발현되었다. β-glucan을 단독으로 처리하였을 때는 TNF-α의 발현이 약하게 발현되었고, LPS와 β-glucan을 같이 처리하였을 때 상승작용을 나타내면서 강하게 발현이 되었다. 또한 PB와 β-glucan을 같이 처리하게 되면 β-glucan을 단독으로 처리하였을 때와 비슷하게 TNF-α가 발현되었다(Fig. 4B).
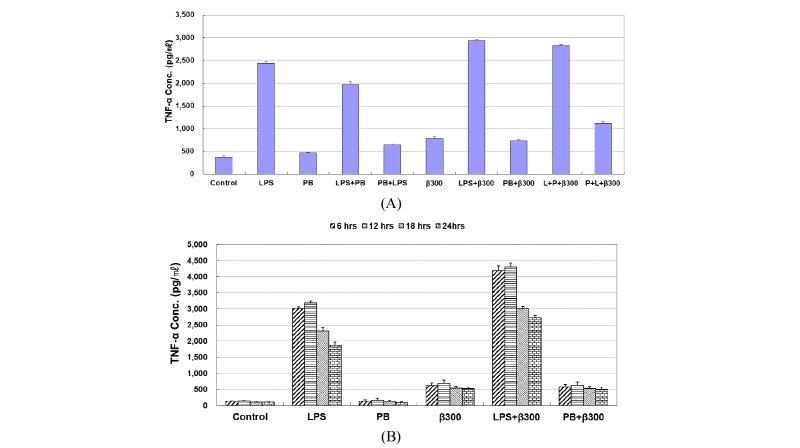
Fig. 4. Induction of TNF-α protein by β-glucan in RAW264.7 cells by ELISA analysis. A, RAW264.7 cells were treated with LPS (100 ng/mL), PB (10 µg/mL), and β-glucan (300 µg/mL) for 24 hr; B, RAW264.7 cells were treated with LPS (100 ng/mL), PB (10 µg/mL), and β-glucan (300 µg/mL) for time-course (6 hr, 12 hr, 18 hr, and 24 hr). TNF, tumor necrosis factor; LPS, lipopolysaccharide; PB, polymyxin B.
MEK1/2 억제제에 의한 사이토카인의 발현 억제
β-Glucan 자극에 의한 Dectin-1과 toll like receptors의 공동 신호전달 작용이 MEK1/2 경로와 연관되었는지 알아보기 위하여 MEK1/2 억제제인 U0126을 0 µM, 5 µM, 10 µM, 25 µM을 사용하여 cytokines과 TNF-α의 유전자 발현을 알아보았다. LPS (50 ng/mL)와 β-glucan (300 µg/mL)을 처리하고 12시간 후에 RNA를 분리하여 RT-PCR 하였다. LPS와 β-glucan을 처리하기 1시간 전에 먼저 U0126을 처리하고 1시간 후에 LPS와 β-glucan을 처리하였다. IL-1β, IL-6, TNF-α 모두 MEK1/2 억제제인 U0126을 무처리했을 때, LPS, β-glucan을 처리했을 경우 이러한 3가지 유전자가 고농도로 발현되었다. 그러나 U0126을 5 µM 처리했을 때 조금씩 감소하였고, 10 µM 이상의 농도에서는 유전자 발현이 억제되었다(Fig. 5A). 1시간 전에 5 µM의 U0126을 전처리하고 1시간 후, LPS, PB, β-glucan을 처리하고 24시간 후에 RNA를 분리하여 RT-PCR을 통해 TNF-α의 유전자 발현을 확인하였다. LPS, PB, β-glucan, LPS + β-glucan, PB + β-glucan 모두 유전자 발현이 감소하고 억제됨을 확인하였다(Fig. 5B). 또한 MEK1/2 경로가 TNF-α의 발현에 미치는 영향을 알아보기 위하여 ELISA assay를 통해 확인하였다. U0126을 0 µM, 5 µM, 10 µM, 25 µM을 사용하여 TNF-α의 단백질 발현을 알아보았다. LPS (50 ng/mL)와 β-glucan (300 µg/mL)을 처리하고 12시간 후에 conditioned medium을 모아서 ELISA assay를 하였다. 유전자 발현과 비슷하게 5 µM을 처리하면 TNF-α의 발현이 감소하였고, 10 µM 이상을 처리하게 되면 TNF-α의 발현이 억제됨을 확인하였다(Fig. 5C). β-Glucan 자극에 의한 Dectin-1과 TLRs의 공동 신호전달 과정에는 MEK1/2 경로가 관여하고 있음을 알 수 있었다.
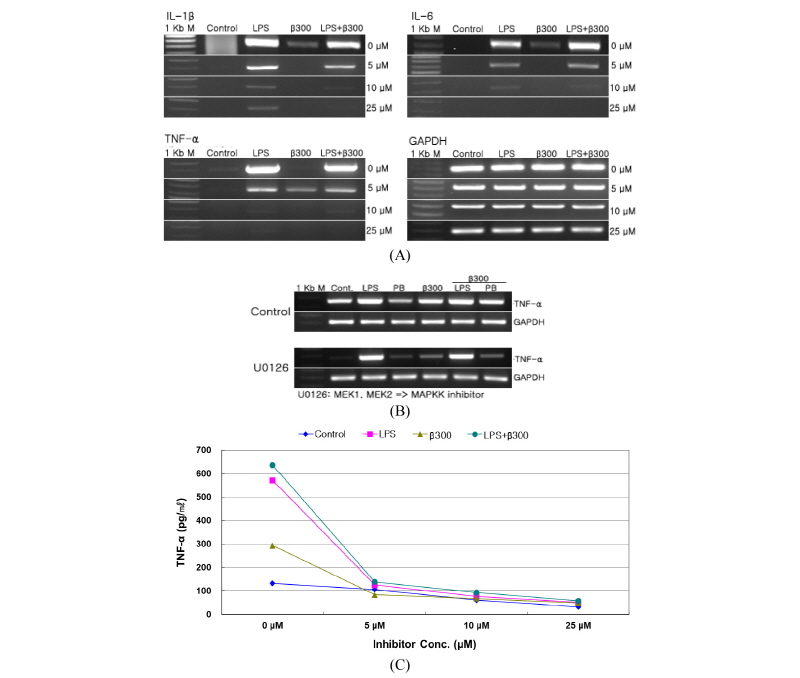
Fig. 5. Inhibition of cytokines by MEK1/2 inhibitor in RAW264.7 cells. RAW264.7 cells were pretreated U0126 and treated with LPS (50 ng/mL), PB (10 µg/mL), and β-glucan (300 µg/mL) for 12 hr. A, RAW264.7 cells were pretreated U0126 in various concentrations (0 µM, 5 µM, 10 µM, and 25 µM) for 1 hr and treated with LPS, PB, and β-glucan for 12 hr. After isolation of the RNA, RT-PCR was carried out; B, RAW264.7 cells were pretreated U0126 (5 µM) for 1 hr and treated with LPS, PB, and β-glucan for 24 hr. After isolation of the RNA, RT-PCR was carried out; C, TNF-α concentrations of the conditioned mediums were measured by ELISA assay. IL, interleukin; TNF, tumor necrosis factor; LPS, lipopolysaccharide; PB, polymyxin B.
PI3K 억제제에 의한 사이토카인의 발현 억제
β-Glucan 자극에 의한 Dectin-1과 TLR의 공동 신호전달 작용이 PI3K/Akt 경로와 연관되었는지 알아보기 위하여 PI3K 억제제인 LY294002을 0 µM, 5 µM, 10 µM, 25 µM을 사용하여 cytokines과 TNF-α의 유전자 발현을 알아보았다. LPS (50 ng/mL)와 β-glucan (300 µg/mL)을 처리하고 12시간 후에 RNA를 분리하여 RT-PCR 하였다. LPS와 β-glucan을 처리하기 6시간 전에 먼저 LY294002을 처리하고 LPS와 β-glucan을 처리하였다. IL-1β, IL-6, TNF-α의 발현은 PI3K 억제제인 LY294002을 무처리했을 때 LPS, β-glucan에 의하여 유전자 발현이 매우 강하게 일어났다. 그러나 LY294002을 10 µM까지 처리했을 때 IL-1β, IL-6, TNF-α의 발현은 서서히 감소하였고, 25 µM의 농도에서는 발현이 완전히 억제되었다(Fig. 6A). 6시간 전에 5 µM의 LY294002을 전처리하고, LPS, PB, β-glucan 처리한 24시간 후에 RNA를 분리하여 RT-PCR을 통해 TNF-α의 유전자 발현을 확인하였다. LPS, PB, β-glucan, LPS + β-glucan, PB + β-glucan 모두 유전자발현이 감소하였다(Fig. 6B). 또한 PI3K/Akt 경로가 TNF-α의 발현에 미치는 영향을 알아보기 위하여 ELISA assay를 통해 확인하였다. LY294002을 0 µM, 5 µM, 10 µM, 25 µM을 사용하여 TNF-α의 단백질 발현을 알아보았다. LPS (50 ng/mL)와 β-glucan (300 µg/mL)을 처리하고 12시간 후에 conditioned medium을 모아서 ELISA assay를 하였다. 유전자 발현과 비슷하게 5 µM을 처리하면 TNF-α의 발현이 감소하였고, 10 µM 이상을 처리하게 되면 TNF-α의 발현이 더욱 감소됨을 확인하였다(Fig. 6C). 그러나 PI3K 억제제를 처리하였을 때는 MEK1/2 억제제를 처리하였을 때보다 cytokines과 TNF-α의 발현이 상대적으로 줄어들지 않았다. 이는 β-glucan 자극에 의한 Dectin-1과 TLRs의 공동 신호전달 과정에는 PI3K/Akt 경로도 관여하고 있지만 MEK1/2 경로가 β-glucan 자극에 의한 공동 신호전달 과정에 더 관여한다고 여겨진다.
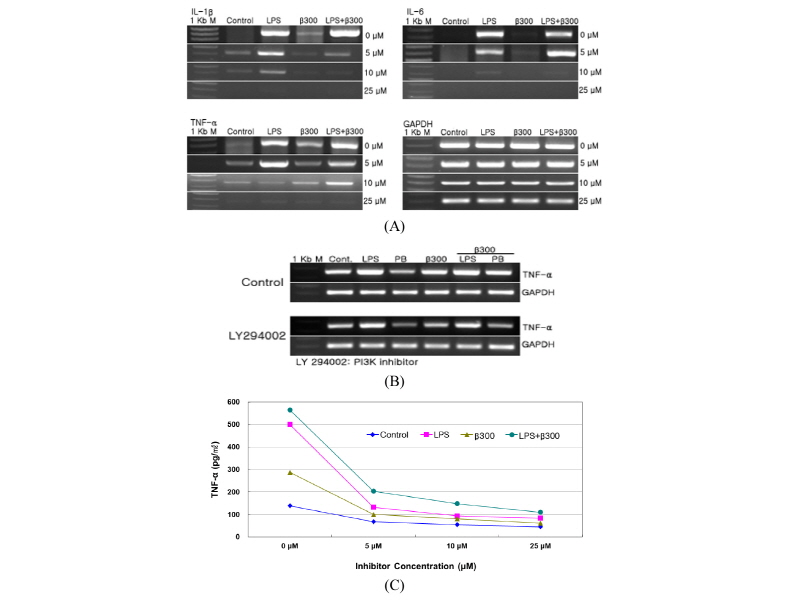
Fig. 6. Expression of immune-related cytokines by PI3K inhibitor in a dose-dependent fashion. RAW264.7 cells were pretreated U0126 and treated with LPS (50 ng/mL), PB (10 µg/mL), β-glucan (300 µg/mL) for 12 hr in cell culture system. A, RAW264.7 cells were pretreated LY294002 in dose-dependent (0 µM, 5 µM, 10 µM, 25 µM) for 6 hr and treated with LPS, PB, β-glucan for 12 hr. After the RNA isolation, RT-PCR was carried out for detection of cytokine mRNA expression; B, RAW264.7 cells were pretreated LY294002 (5 µM) for 1hr and treated with LPS, PB, β-glucan for 24 hr. After the RNA isolation, RT-PCR was carried out for detection of cytokine mRNA expression; C, Collected of conditioned medium, ELISA assay was carried out for detection of TNF-α protein expression. IL, interleukin; TNF, tumor necrosis factor; LPS, lipopolysaccharide; PB, polymyxin B.
PI3K 억제제와 MEK1/2 억제제의 동시 처리에 의한 TNF-α의 발현 저하
β-Glucan 자극에 의한 Dectin-1과 TLR의 공동 신호전달 작용을 알아보기 위해서 PI3K 억제제인 LY294002와 MEK1/2 억제제인 U0126을 5 µM을 처리하여 TNF-α의 단백질 발현을 ELISA assay를 통해 알아보았다. LPS (100 ng/mL), PB (10 µg/mL), β-glucan (300 µg/mL), LPS + PB, PB + LPS, LPS + β-glucan, PB + β-glucan, LPS + PB + β-glucan, PB + LPS + β-glucan을 처리하고 24시간 후에 conditioned medium을 모아서 ELISA assay를 하였다. 각 sample을 처리하기 6시간 전에 먼저 LY294002을 처리하고 5시간 후에 U0126을 처리한 다음, 1시간 후에 각 sample을 처리하였다. 먼저 LPS, PB와 β-glucan을 24시간 처리하였는데 LPS와 β-glucan을 처리한 경우는 control (1.72 ± 0.81 pg/mL)에 비하여 TNF-α의 발현이 각각 21.6배(37.10 ± 1.61 pg/mL)와 4.4배(7.53 ± 1.13 pg/mL) 증가하였고, LPS와 β-glucan을 동시에 처리한 경우 대조군에 비해 43.9배(75.59 ± 1.66 pg/mL) 증가하였다. β-glucan과 LPS 억제제인 PB를 동시에 처리하면 β-glucan 단독 처리(7.53 ± 1.13 pg/mL)에 비하여 1.07배(8.06 ± 0.65 pg/mL) 증가하였다. 또한 LPS를 1시간 먼저 처리하고 PB와 β-glucan을 나중에 처리한 것(35.05 ± 1.30 pg/mL)에 비하여 PB를 1시간 먼저 처리하고 1시간 후에 LPS와 β-glucan을 동시에 처리한 경우는 TNF-α가 76.9% (7.96 ± 1.04 pg/mL)가 감소하였다. PI3K 억제제인 LY294002와 MEK1/2 억제제인 U0126을 5 µM을 처리하고 각 sample을 처리하면 TNF-α의 발현이 억제되었다(Fig. 7). 이 실험 결과를 통해 β-glucan 자극에 의한 Dectin-1과 TLR의 공동 신호전달 작용은 PI3K/Akt 경로와 MEK1/2 경로가 같이 신호전달 과정에 관여하는 것으로 여겨지며, β-glucan의 자극에 의해서 Dectin-1을 통하여 TNF-α가 생성될 때는 두 경로가 모두 관여하지만 MEK1/2 경로를 통해서 TNF-α가 생성된다고 여겨진다.
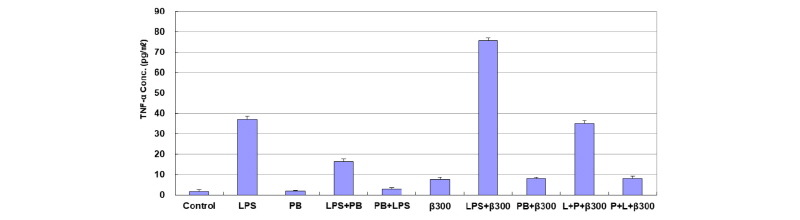
Fig. 7. ELISA analysis of TNF-α by co-treatment of PI3K and MEK1/2 inhibitors. RAW264.7 cells were pretreated with both LY294002 (5 µM) and U0126 (5 µM) for 1 hr and then treated with LPS (100 ng/mL), PB (10 µg/mL), and β-glucan (300 µg/mL) for 24 hr. The conditioned medium was used for the measurement of TNF-α protein expression by ELISA assay. TNF, tumor necrosis factor; LPS, lipopolysaccharide; PB, polymyxin B.
고 찰
지금까지 다당류는 면역세포의 활성을 위한 생물적 조성물로서만 믿어져 왔던 것과는 반대로, 최근에 들어서 이것이 면역조절인자로서의 기능이 있는 것으로서 행동하는 효과를 보인다는 연구 결과들이 제시되고 있다. 면역조절전략(immunomodulation)은 면역반응을 보충하거나 증대시킴으로써 병원체에 대한 반응을 증강 또는 억제시킬 수 있어야 한다[22]. 이러한 기능을 갖는 면역조절인자로 대두되고 있는 물질이 바로 glycan이다. 포도당의 중합체로 된 고분자물질을 glucan이라고 하며, 대부분의 진균류의 세포 표면에 있는 다당체이며, 진균류와 숙주 사이의 상호작용에 관여한다. 또한 당생물학(Glycobiology)의 연구가 활발히 진행됨으로써 질병의 진단과 치료를 위한 작용제로서 응용될 것으로 기대되는 물질이다[23]. 그러나 glucan은 숙주에게 이롭기도 하지만 예상치 못한 부작용도 나타낼 가능성도 있으므로 첨단 분석기술을 활용하여 glucan의 복잡한 구조를 해명하는 과정이 필요하기도 하다[24].
본 연구에서는 Ganoderma lucidum에서 추출한 β-glucan을 마우스의 대식세포주인 RAW264.7 세포에 처리하였을 때 β-glucan의 수용체인 Dectin-1의 발현이 유도되었으며, Dectin-1과 협동으로 작용하는 TLR류 중에서 TLR2, TLR4 그리고 TLR6의 발현이 증가됨을 밝혔다. 또한 β-glucan의 처리에 의하여 염증성 매개물질류인 IL-1β, IL-6, MIP-1류, TNF-α 등의 발현이 촉진됨을 증명하였다. 더 나아가서 본 연구에서는 β-glucan 처리에 의한 염증성 매개물의 발현은 PI3K/Akt 경로와 MEK1/MEK2 신호전달 경로를 경유하여 발현됨을 밝혔다. Macrophage inflammatory protein (MIP-1)은 C-C chemokine 계열에 속하는 단백질로써 활성화된 대식세포에서 분비되고 호중구를 활성화시킨다고 알려져 있다[25].
적응면역(adaptive immunity)은 Th1 반응의 생산에 의해 개시된다. 선천성 면역이 일어나는 동안 TLR은 병원체의 수많은 분자를 인식한다. 면역반응은 TLR이 일차적으로 반응하여 그 후에 전사인자인 NF-kB의 활성을 통해 더욱 활성화된다. 병원체의 자극이 시작되면 TLR은 adaptor protein인 MyD88에 결합한 후, 이후 작용의 활성을 위해 serine-threonine kinase인 IRAK과 결합한다[26]. Adaptor protein인 MyD88을 통한 신호전달경로는 두 가지로 PI3K/Akt와 MEK1을 통해 NF-kB, ERK, Jun/Fos를 활성화시키는 MyD88-의존적 경로와 IKK/TBK1, IRF3를 통한 MyD88-비의존적 경로가 알려져 있다[14]. TNF-α는 면역세포의 기능이나 세포의 증식, 분화, 사멸에 영향을 미치는 스트레스 반응의 결정적인 매개체이다. 이는 caspase를 활성화시킴으로 사멸을 유도할 수도 있지만, NF-κB와 AP-1과 같은 전사인자를 통한 메커니즘에 의해 사멸을 억제함으로 염증 반응을 진행시킬 수도 있다. β-Glucan 자극에 의한 Dectin-1과 TLR의 공동 신호전달 작용에 의한 TNF-α의 발현에 관여하는 신호전달 과정을 알아보기 위해서 PI3K 억제제인 LY294002와 MEK1/2 억제제인 U0126을 처리하여 TNF-α의 단백질 발현을 통해 알아보았다. 각 시료를 처리하기 6시간 전에 먼저 LY294002을 처리하고 5시간 후에 U0126을 처리한 다음, 1시간 후에 각 시료를 처리하였다. 실험 결과, LPS와 β-glucan을 처리한 시료는 TNF-α가 증가하였고 LPS와 β-glucan을 같이 처리한 시료의 경우, 역시 상승작용 경향을 보이며 증가하였다. PB와 β-glucan을 같이 처리하게 되면 역시 약간 증가하였다. PB를 먼저 처리하고 1시간 후 LPS를 처리하게 되면 PB에 의하여 lipid A 결합부위가 차단되어 TLR에 의한 신호가 거의 전달이 되지 않아 TNF-α의 발현이 감소한 것으로 생각된다. LPS를 1시간 먼저 처리하고 PB를 나중에 처리하였을 경우, 서로 경쟁적으로 작용하여 TNF-α의 발현에 영향을 준 것으로 생각된다. 그러나 PB와 β-glucan을 같이 처리한 경우, β-glucan을 단독으로 처리했을 때와 거의 차이가 없었고, PB를 1시간 먼저 처리하고 1시간 후에 LPS와 β-glucan을 같이 처리한 경우는 PB와 β-glucan을 같이 처리했을 때보다 증가하였다. 본 연구 결과를 통해 β-glucan 자극에 의한 Dectin-1과 TLR의 공동 신호전달 작용에는 PI3K/Akt 경로와 MEK1/2 경로가 모두 신호전달 과정에 관여하고 있다고 여겨지며, β-glucan의 자극에 의해서 Dectin-1을 통하여 TNF-α가 생성될 때는 두 경로가 모두 관여하지만 MEK1/2 p 경로의 AP-1을 통한 메커니즘이 TNF-α 생성에 관여된다고 여겨진다.