서론
내생균(endophytic fungi)은 식물에 공생하는 균류이다. 내생균은 식물의 모든 조직 내에서 병증을 일으키지 않고 서식하고 있으며[1], 포식자인 초식동물 혹은 식물에 병을 일으키는 병원성 미생물에 대한 화학적 방어 등의 이점을 제공한다[2, 3]. 특히 주목의 침엽에 서식하는 내생균이 분비하는 taxol과 같이[4], 침엽수에 서식하는 내생균은 항생 혹은 항암 작용을 할 수 있는 물질을 분비하기도 하며[5], 이러한 점에서 연구의 가치가 있다고 생각된다. 본 연구에서는 제주도 한라산에 서식하는 침엽수 잎에서 내생균을 분리하던 중에 구상나무(Abies koreana)와 주목(Taxus cuspidata)의 침엽에서 분리된 국내 미기록종 4종의 형태적 특성 및 계통적 분석에 대해 서술하고자 한다.
재료 및 방법
한라산의 해발 1,300~1,400 m 부근에 서식하는 구상나무와 주목의 침엽 중에서, 외관상 병증이 나타나지 않는 건강한 잎을 채취하여 실험실로 운반하였다. 시료를 1%의 NaClO 용액과 70% EtOH로 표면살균한 뒤 potato dextrose agar (PDA) 배지에 4조각씩 치상하였다. 25℃의 암소에서 3일 이상 배양하면서 균사가 뻗어 나오면 새로운 PDA 배지에 계대하여 순수 분리하였고, 확보된 균주를 다시 PDA 배지와 malt extract agar (MEA) 배지에 3점 계대하여 7일간 동일한 조건으로 배양한 뒤 형태적 특징을 관찰하였다(Tables 1, 2, Fig. 1). 염기서열 분석을 위하여 DNeasy Plant mini kit (Qiagen, Germantown, MD, USA)의 protocol에 따라 균사에서 genomic DNA를 추출한 뒤 균 특이적인 프라이머인 ITS1F와 ITS4를 이용하여 internal transcribed spacer (ITS) 영역을 증폭하였고[6], 프라이머 LR0R과 LR16을 이용하여 28S rDNA를 포함하는 large subunit (LSU) 영역을 증폭하였으며[7], 추가적인 염기서열 분석이 필요한 균주들은 primer 526F와 1567R을 이용하여[8] translation elongation factor (TEF) α-1 영역을 증폭하였다. Annealing 온도는 ITS 영역은 50°C, LSU 영역은 44°C, TEF 영역은 57°C로 설정하여 수행하였다. PCR 산물은 1.5% agarose gel에서 22분간 전기영동을 실시하였고, 전기영동 결과 증폭된 DNA 단편의 크기를 확인한 후 염기서열 분석을 의뢰하였다(SolGent, Daejeon, Korea). 분석된 염기서열은 NCBI 상에서 BLAST를 이용하여 유사도를 확인한 후 각 종들 간의 계통 분석을 통한 유연 관계를 확인하기 위해 MEGA7를 이용하여[9] concatenated alignment를 만든 후, neighbor-joinning 방법으로 계통수를 작성하였다. 분리된 균주는 국립생물자원관(NIBR)에 기탁하였으며, DNA 염기서열은 미국 국립생물정보센터(NCBI)에 제출하였다.
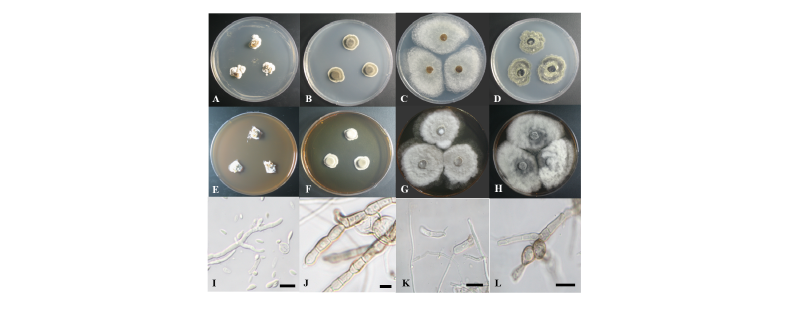
Fig. 1. Colonies of strain 16H321 (Lachnellula hyalina) grown for 7 days on potato dextrose agar (PDA) (A) and malt extract agar (MEA) (E), conidia (I). Colonies of strain 17C006 (Ochrocladosporium elatum) grown for 7 days on PDA (B) and MEA (F), conidiophore (J). Colonies of strain 17C009 (Phacidium lacerum) grown for 7 days on PDA (C) and MEA (G), conidia (K). Colonies of strain 16H339 (Phyllosticta cussoniae) grown for 7 days on PDA (D) and MEA (H), conidia (L) (scale bars = 10 μm).
결과 및 고찰
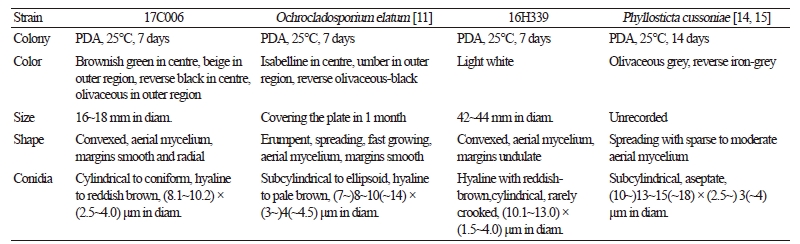
Lachnellula hyalina Dharne, Phytopathologische Zeitschrift 53: 119 (1964)
구상나무의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 크기는 10~12 mm 정도로 매우 느리게 자라고, 균총의 색은 앞면은 전체적으로 옅은 베이지색을 띠고 뒷면은 연한 갈색을 띤다. 균총의 가장자리는 매우 불규칙하며, 균총의 고도는 배지에 납작하게 붙어 있다(Fig. 1A). MEA 배지에서 7일간 배양된 균총의 크기는 11~14 mm 정도로 PDA 배지에서와 마찬가지로 매우 느린 속도로 자란다. 균총의 색은 앞·뒷면 모두 베이지색에 가깝고, 균총의 고도는 배지에 납작하게 붙어 있다. 균총의 가장자리는 매우 불규칙하다(Fig. 1E). 균사 생장 방향의 측면에서 구형 혹은 불규칙한 타원형의 분생자(conidia)가 형성된다. 분생자는 투명한 유리질이며, 격막(septate)으로 분리된다. 분생자의 크기는 (3.4~5.5) × (1.5~2.0) μm 정도이다(Fig. 1I).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, 33°22'03.5" N, 126°32'37.1" E, August 23, 2016, isolated from leaves of Abies koreana, strain 16H321, NIBRFG0000502333, GenBank no. MH734785.
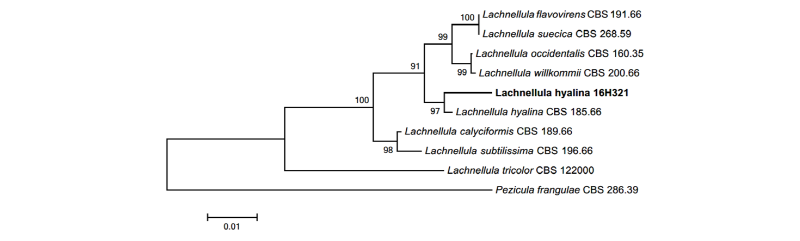
Notes: L. hyalina는 1964년 Dharne에 의해 보고된 종이다. 분생자의 투명한(hyaline) 형태적 특성으로부터 종명이 유래했으며, 스위스에 분포하는 소나무과의 침엽수인 무고소나무(Pinus mugo)의 가지로부터 분리되었다[10]. 본 연구에서 확인된 유리질로 된 분생자의 형태와 크기는 원 기재문의 설명과 일치하였으며, ITS 영역과 LSU 영역의 염기서열의 분석 결과 ITS 영역의 DNA 염기서열은 L. hyalina KC464638.1과 98%의 일치도를 보였고, LSU 영역의 염기서열은 L. hyalina KC492976.1과 99%의 일치도를 보였으며, 모두 같은 계통을 형성했다(Fig. 2).
Ochrocladosporium elatum (Harz) Crous & U. Braun, Studies in Mycology 58: 46 (2007)
주목의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 직경은 16~18 mm 정도이며, 균총의 색은 앞면은 중앙부에서는 짙은 녹갈색을 띠고, 가장자리에는 옅은 베이지색의 띠가 형성된다. 뒷면은 중앙부에서 검은색을 띠고, 바깥쪽은 올리브색이며 가장자리에 앞면과 마찬가지로 베이지색의 띠가 형성된다. 고도는 배지에서 살짝 융기되어 있고, 가장자리는 촘촘한 균사가 방사형으로 뻗어 있다(Fig. 1B). MEA 배지에서 7일간 배양된 균총의 직경은 15~16 mm 정도이며, 균총의 색은 앞면은 전체적으로 밝은 흰색을 띠고 뒷면은 중앙부에서 황갈색을, 가장자리에서 베이지색을 띤다. 균총의 고도는 중앙부에서 볼록 융기되어 있으며, 가장자리의 형태는 균사들이 불규칙하게 뻗어 나가는 형태이다(Fig. 1F). 균사 생장 방향의 측면에서 불규칙한 타원형으로 비대해진 분생자경(conidiophore)이 형성되며, 분생자경으로부터 원추형 혹은 원통형의 투명한 유리질 분생자가 형성된다. 분생자의 색은 적갈색을 띠거나 혹은 무색이고, 분생자의 크기는 (8.1~10.2) × (2.5~4.0) μm 정도이다(Fig. 1J).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, 33°23'08.6"N, 126°32'14.0"E, August 23, 2016, isolated from leaves of Taxus cuspidata, strain 17C006, NIBRFG0000502331, GenBank no. MH734786.
Notes: O. elatum은 2007년 Crous & Braun에 의해 새로 명명되었다. 본래 Cladosporium속에 속해 있었으며, 연한 갈색의 분생자로부터 기인하여, 속명에 황갈색을 뜻하는 그리스어 접두어 Ochro-가 붙어 속명이 새로 정립되었다[11]. 분생자의 형태적 특징은 대체로 원 기재문과 일치하였으며, ITS 영역과 LSU 영역의 염기서열의 분석 결과 ITS 영역의 DNA 염기서열은 O. elatum GU248334.1과 99%의 일치도를 보였고, LSU 영역의 염기서열은 O. elatum EU040233.1과 98%의 일치도를 보였으며, 모두 같은 계통을 형성했다(Fig. 3).
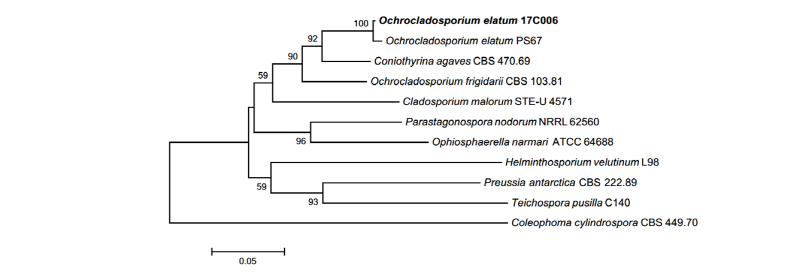
Fig. 3. Neighbor-joining phylogenetic tree based on a combined alignment of both internal transcribed spacer and large subunit sequences. Coleophoma cylindrospora was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Fungal strain isolated in this study is in bold.
Phacidium lacerum Fr., Observationes mycologicae 2: 313 (1818)
주목의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 크기는 42~44 mm 정도이고, 균총의 색은 앞·뒷면 모두 밝은 흰색을 띤다. 균총의 고도는 배지에서 살짝 융기되어 있으며, 가장자리는 공중 균사가 발달하여 물결 모양으로 퍼져 나간다(Fig. 1C). MEA 배지에서 7일간 배양된 균총의 크기는 40~43 mm 정도이고, 균총의 색은 앞면은 흰색을 띠고 뒷면은 베이지색에 가깝다. 균총의 고도는 배지에서 살짝 융기되어 있고, 가장자리는 불규칙하다. 균총의 뒷면에는 중앙을 기준으로 불규칙한 방사형의 주름들이 형성된다(Fig. 1G). 분생자경은 균사 생장 방향을 따라 형성되거나 혹은 분지되며, 전체적으로 적갈색 빛이 감도는 투명한 유리질로 이루어져 있다. 분생자경에서 형성되는 분생자는 투명한 유리질의 길쭉한 원통형이며 초승달처럼 끝이 휘어지기도 한다. 분생자의 크기는 (10.1~13.0) × (1.5~4.0) μm 정도이다(Fig. 1K).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, 33°23'08.6" N, 126°32'14.0" E, August 23, 2016, isolated from leaves of Taxus cuspidata, strain 17C009, NIBRFG0000502330, GenBank no. MH734787.
Notes: P. lacerum은 1818~1823년경 Fries에 의해 보고된 것으로 알려져 있으며, 유럽에 널리 분포하는 구주소나무(Pinus sylvestris)에서 최초 분리된 것으로 보고되어 있다[12, 13]. Phacidium속에 속하는 종들은 길쭉한 유리질의 분생자를 형성하는 것이 특징이며, 본 연구에서 확인된 길쭉한 원통형의 분생자는 Crous 등[12]의 연구와 일치한다. ITS 영역과 LSU 영역의 염기서열의 분석 결과 ITS 영역의 DNA 염기서열은 P. lacerum KU942438.1과 99%의 일치도를 보였고, LSU 영역의 염기서열은 P. lacerum MG720334.1과 99%의 일치도를 보였으며, 모두 같은 계통을 형성했다(Fig. 4).
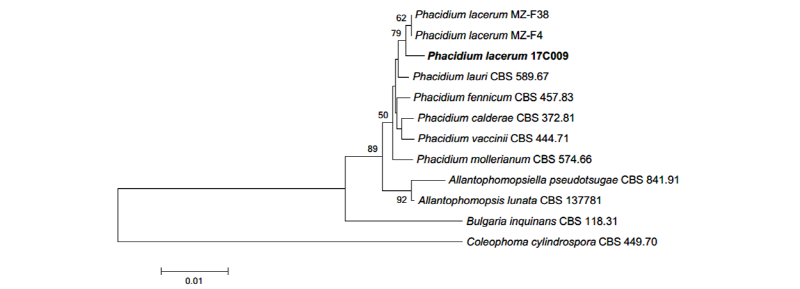
Fig. 4. Neighbor-joining phylogenetic tree based on a combined alignment of both internal transcribed spacer and large subunit sequences. Coleophoma cylindrospora was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Fungal strain isolated in this study is in bold.
Phyllosticta cussoniae Cejp, Bothalia 10: 341 (1971)
구상나무의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 크기는 30~34 mm 정도이고, 균총의 앞면은 연한 올리브색과 어두운 녹색이 섞여 있으며, 뒷면은 전체적으로 회색을 띤다. 균총의 고도는 배지에서 살짝 융기되어 있으며, 가장자리는 불규칙한 물결 형태이다(Fig. 1D). MEA 배지에서 7일간 배양된 균총의 크기는 42~45 mm 정도로 PDA 배지에서보다 빠른 속도로 자란다. 앞면은 전체적으로 흰색을 띠며 뒷면은 중앙부는 검은색을 띠고 가장자리는 흰색을 띤다. 균총의 고도는 중앙부에서는 납작하고 가장자리에서 공중 균사가 발생하여 융기되는 형태이다(Fig. 1H). 균사의 끝부분에서 둥근 형태의 분생자경이 발생하며, 분생자경에서 격막이 없는 투명한 유리질의 계란형 혹은 짧은 타원형 분생자를 형성한다. 분생자의 크기는 (8.5~10.8) × (5.0~6.0) μm 정도이다(Fig. 1L).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, 33°22'03.5" N, 126°32'37.1" E, August 23, 2016, isolated from leaves of Abies koreana, strain 16H339, NIBRFG0000502334, GenBank no. MH734930.
Notes: P. cussoniae는 1971년 Cejp[14]에 의해 보고된 종이다. 남아프리카 공화국의 Cussonia속 목본식물의 잎에서 분리된 것에서 기원하였다. 분생자의 형태 비교는 원 기재문 외에 Wikee 등[15]의 연구를 참고하였고, 본 연구에서 확인된 분생자의 형태가 참고문헌과 대체로 일치하는 것을 확인하였다. ITS 영역과 LSU 영역의 염기서열의 분석 결과 ITS 영역의 DNA 염기서열은 P. cussoniae KF170311.1과 98%의 일치도를 보였고, LSU 영역의 염기서열은 P. cussoniae KF206278.1과 99%의 일치도를 보였으며, TEF 영역의 염기서열은 P. cussoniae KF289223.1과 98%의 일치도를 보였고 모두 같은 계통을 형성했다(Fig. 5).

Fig. 5. Neighbor-joining phylogenetic tree based on a combined alignment of both internal transcribed spacer, large subunit and translation elongation factor sequences. Dothidea ribesia was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Fungal strain isolated in this study is in bold.
적요
제주도 한라산의 구상나무와 주목의 침엽에서 내생균을 분리하였다. 분리된 균주들은 형태적 특성 및 internal transcribed spacer 영역, large subunit rDNA 영역 및 translation elongation factor 영역 염기서열의 계통분석을 통해 종을 동정하였다. 그 결과 4종의 국내 미기록 내생균을 확인하였고, 확인된 종은 각각 Lachnellula hyalina, Ochrocladosporium elatum, Phacidium lacerum, Phyllosticta cussoniae이다. 확인된 4종의 미기록 내생균 균주의 형태적 특성 및 염기서열 계통분석의 결과에 대해 기술하였다.