서론
복령(Wolfiporia cocos, syn. Poria cocos Wolf.)은 버섯류에 속하는 진균류의 일종으로 담자균 아강 다공균목 구멍버섯과 복령속으로, 죽은지 3~5년이 경과한 소나무류(Pinus spp.)의 뿌리 주변에 부정형의 균핵을 형성하는 기생균으로 알려져 있다[1]. 복령의 균핵은 내부 색깔에 따라 육질이 견고한 백복령과 연하고 부드러운 적복령으로 구분하고 맛은 달콤하지만 향과 독성이 없으므로 식품으로 혹은 여러 가지 치료 효과가 있는 약제로 한국을 포함한 동남아에서 많이 사용한다[1, 2].
복령은 여러 종류의 triterpenes와 polysaccharides가 주성분이며 항암작용, 항산화작용, 살선충제, 항고지혈작용, 항세균작용, 항염증작용 그리고 항고혈압작용 등이 다양하게 알려져 있다[3]. 특히 면역증강 및 뇌세포 활성 등의 생리활성도 알려져 있다[4, 5]. 복령의 성분 중에서 U-pachyman, pachymaran, carboxymethyl pachymarna, 그리고 (1,3)-(1,6)-β-D-glucan 등의 다당류는 항산화 효과가 뛰어나고, triterpenes 성분은 산화, 염증 및 췌장암에 효과가 있는 것으로 알려져 있다[4, 6-10]. 복령의 껍질 및 내피 추출물은 elastase와 collagenase 활성을 저해하여 주름 개선과 염증에 효능이 있어 화장품 천연 소재로 활용하고 있다[5].
복령의 다양한 효능은 여러 분야에서 그 사용량이 매년 증가되어 중국으로부터 수입량이 증가하고 있다. 특히 식품의약품안전처의 식품의약품통계연보에 따르면 한약재 수입 상위 10개 품목에 복령이 포함되어 있고, 2008년 이후 수입량이 꾸준하게 증가하고 있다. 국내에서 생산되는 복령의 시장 경쟁력 확보를 위하여 중국산 복령과 국내산 복령에 대한 원산지 판별은 주로 여러 가지 이화학적인 방법으로 성분 분석의 차이점으로 실시하고 있다[11]. 하지만 성분 분석만으로는 한계가 있으므로 보조적인 생물학적 검증법도 함께 제시되어야 한다.
따라서 본 연구에서는 중국산 및 국내산 복령의 약리활성의 차이점을 확인하기 위하여 3T3-L1 세포주를 이용한 지방축적 억제활성 시험 그리고 암세포주를 이용한 Sarcoma 180에 대한 항암활성의 차이점을 비교하였다. 이 중에서 중국산 복령과 국내산 복령은 항암활성에서 차이점을 보였다. 따라서 중국산 복령을 국내에서 인공 재배되는 노지재배 복령 그리고 시설재배 복령과 항암활성을 추가적으로 비교하였다. 복령은 식품으로 사용이 제한되는 버섯임에도 불구하고 유통 중인 중국산 및 국내산 복령추출물에 대한 안전성 시험이 없어 추가적으로 단회 경구 독성시험을 본 연구에서 실시하였다.
재료 및 방법
시료
중국산 복령은 서울약령시장(서울, 중구)에서 유통되는 1 kg 용량의 제품으로 세절 건조 제품 총 10 kg을 구입하여 실험에 사용하였다. 국내산 복령은 강원도산림과학연구원(강원도, 춘천)에서 제공받은 강원도산을 이용하였다. 한편 인공 노지재배 1년산과 2년산 복령은 2017년 3월에 강원도산림과학연구원에서 제공받았다. 인공 시설재배 1년산과 2년산 복령은 류충헌버섯농장(경상북도, 안동)에서 제공 받았다. 제공 받은 모든 복령은 많은 미생물과 접촉이 되어있는 상태이므로 공기살균청정기(Clean Care HAS-5001; EnpuTech, Gwangju, Korea)가 설치된 건조실에서 동일한 조건으로 오염 없이 건조하였다. 건조된 복령은 50 mesh 이하로 균질화하여 시험에 이용하였다. 중국산과 국내산 복령은 음건 세절한 후 50% 에탄올에 3시간 95℃에서 관류하면서 중국산 50% 에탄올 복령추출물(Chinese ethanolic 50% Wolfiporia cocos extract, CPE)과 국내산 50% 에탄올 복령추출물(Korean ethanolic 50% Wolfporia cocos extract, KPE)을 제조하였다. 중국산 및 국내산 50% 에탄올 복령추출물은 최종적으로 회전식 진공감압농축기(N-2110R; Sunileyela, Seongnam, Korea)로 농축 후에 동결건조기(DRC-1000; Sunileyela)를 이용하여 동결건조하였다. 동결 건조된 추출물은 3T3-L1 세포 내 지방축적 억제활성과 Sarcoma 180 암세포주에 대한 항암활성을 구명하기 위해서 dimethyl sulfoxide (DMSO)에 용해시켜 실험에 사용하였다. 중국산 및 국내산 복령추출물을 제조하기 전에 농약잔류분석을 한국분석기술연구소에 의뢰하여 250여종의 농약잔류성분을 신속다성분 동시분석법으로 실시하여 잔류농약이 없음을 확인하였다.
복령추출물의 3T3-L1 세포내 지방축적 억제활성
마우스 유래의 섬유아세포인 3T3-L1 세포 내에서 지방축적 억제활성을 실시하기 전에 적절한 농도를 설정하기 위하여 KPE에 대한 세포독성을 MTT (3-(4,5-dimethylthiazol-2y-1)-2, 5-diphenyltetrazolium bromide)법으로 세포독성평가를 먼저 실시하였다[8]. 세포독성은 KPE 1, 10, 100, 300 그리고 1,000 μg/mL의 농도에서 실시하였다. 처리하지 않은 3T3-L1 전지방세포의 흡광도를 대조군으로 하여 세포 생존율을 계산(% of control)하여 CPE와 KPE의 세포독성을 평가하였다. 세포독성 결과를 확인한 후에 활성 시험에 영향을 주지 않는 농도를 설정하였다. CPE와 KPE의 활성시험을 위하여 KPE은 control (무처리구), 1, 10, 100, 그리고 300 μg/mL의 농도로 3T3-L1 전지방세포에서 지방세포로 분화되는 전 기간 동안 처리하였다. CPE와 KPE의 지방축적 억제활성 비교시험은 300 μg/mL 농도에서 배양시간을 달리하여 비교하였다. 지방축적의 측정은 지방측정키트(AdipoRed assay Reagent; Lonza, Basel, Switzerland)를 사용하였고 측정법은 제조사의 지시서를 참조하였다. 간략하게 설명하면 배지는 2일마다 교체하였고 주어진 시간마다 세포 내 지방의 양을 측정하였다. 세포는 PBS (pH 7.4)로 세척하고 PBS를 200 μL을 넣고 5 μL AdiopoRed 시약을 넣는다. 10분 후에 excitation 485 nm 그리고 emission 572 nm에서 측정하였다. 복령추출물을 처리하지 않은 대조군을 lipid accumulation (% of control)으로 계산하여 복령추출물의 지방축적 억제활성을 평가하였다.
항암활성시험
약용버섯에서 약리활성이 가장 많이 알려진 것은 항암활성이다. 그러므로 CPE와 KPE의 항암활성을 비교하기 위하여 Sarcoma 180 세포주(KCLB no. 40066)를 사용하였다. 배양 및 유지는 RPMI 1640 배지를 이용하였고 배지는 fetal bovine serum (FBS) 10%를 첨가하고, penicillin과 streptomycin을 각각 100 units/mL와 100 μg/mL의 농도가 되게 배양액에 첨가하여 37℃, 5% CO2 조건에서 배양시켰다. 항암활성은 세포 단백질 염색을 이용하여 세포 증식이나 독성을 측정하는 SRB (sulforhodamine B) assay으로 측정하였다[12]. Sarcoma 180에 대한 시험물질의 효과를 평가하기 위하여 세포수의 측정은 시험물질을 처리한 well의 흡광도를 시험물질을 처치하지 않은 음성대조군 well의 흡광도로 나누어 %로 나타내었다. 한편 최근에 복령 수요가 증가함에 따라서 국내산 복령을 인공적으로 노지재배 및 시설재배로 생산하고 있다. 따라서 중국산 복령, 국내산 복령, 노지재배 복령(1년산 복령, 2년산 복령), 시설재배 복령(1년산 복령,과 2년산 복령)에 대하여 위의 방법에 따라 항암활성을 비교하였다.
단회 경구 독성시험
실험동물은 ICR계 마우스이며, 온도 23 ± 1℃, 습도 55 ± 5%, 배기 10~18회/시간, 형광등 명암 12시간 주기, 조도 300~500 Lux의 사육환경에서 사육하였다. 사료는 수퍼피드의 실험동물용 사료를 구입하여 실험동물에 자유로이 공급하였으며, 음수는 1차 증류수를 자유롭게 섭취시켰다. 투여용량의 설정은 예비실험에서 복령추출물을 한계용량인 2,000 ㎎/㎏의 용량에서 사망동물이 관찰되지 않아 한계용량시험의 일환으로 최고용량을 2,000 ㎎/㎏으로 하고, 매체를 투여하는 매체 대조군만을 두었다. 단, 식품의약품 안전처의 '의약품등의 독성시험기준'에는 한계용량에 대한 기준을 참고하였다. 각 군당 투여 마리 수는 암‧수 각 5마리로 정하였다(Table 1). 시험물질을 투여하기 직전 실험동물의 체중 범위는 수컷 34 ± 0.35 g, 암컷 29 ± 1.2 g으로 연령은 5주령이었다. 동물실험을 위하여 실험동물을 구입하기 전에 경북대학교 동물실험윤리위원회의 승인(KNU 2015-20)을 받아 실험을 실시하였다.
시험물질은 동결 건조된 KPE와 CPE을 0.5% carboxylmethylcellulose-ethyl alcohol-tween 80 (v/v/v 8:1:1)에 균질하게 현탁시키고, 12시간 절식 후 투여 직전에 측정한 체중에 따라 시험물질의 투여량을 산출하여 실험동물에 1회 경구투여하였다. 대조군에는 0.5% carboxylmethylcellulose-ethyl alcohol-tween 80 (v/v/v 8:1:1)를 투여하였다. 임상증상 관찰은 투여 후 6시간 동안 매 시간마다 관찰하였으며, 투여 다음날부터 14일까지는 1일 1회씩 동물의 일반상태의 변화, 중독증상의 발현 및 사망유무를 관찰하였다. 시험 종료 후 실험동물을 CO2로 마취하여 복대동맥 절단방법으로 치사시킨 다음 외관 및 내부 장기의 이상 유무를 육안으로 관찰하였다.
통계학적 분석
시험결과는 평균값과 표준편차로 표기하였으며, 통계학적 분석은 일원배치분산분석(one-way analysis of variance, ANOVA)을 실시하였으며 통계학적 유의성이 관찰되는 Duncan’s multiple comparison test를 실시하였다. 이때 통계학적 유의 수준을 P < 0.05로 설정하였다.
결과 및 고찰
생활수준의 향상과 식생활의 변화로 인해 고칼로리 음식의 과다한 섭취, 운동부족, 환경오염, 산업사회의 고도화에 따른 과다한 스트레스 및 의학 발달에 따른 고령화 현상 등으로 인해 질병양상도 점점 생활습관 위주로 서구화되고 있다. 그에 따라 건강식품에 대한 사람들의 관심이 높아지고 질병예방과 질병치료의 효능을 가지는 식품에 관한 연구가 많이 진행되어 있다. 그 중 버섯은 주위에서 손쉽게 구할 수 있고, 예로부터 질병치료에 널리 이용되어 왔으며 여러 연구를 통해 탁월한 항암작용과 항염증작용 그리고 항산화작용이 있다고 알려져 있다[7, 9, 13]. 이러한 생물활성으로 여러 분야에서 사용량이 급증하여 식품의약품통계연보(2011-2015)에 따르면 2014년도 707톤에서 2015년 677톤으로 엄청난 사용량을 보였다. 국내에서 중국산 복령과 국내산 복령의 이화학적 분석 등을 통하여 원산지 판별 연구를 보고하였지만 약리활성에 관한 비교 연구는 많지 않았다. 따라서 본 시험에서는 세포주를 이용하여 지방축적 억제활성과 항암활성을 50% 에탄올 중국산 복령추출물(CPE), 50% 에탄올 국내산 복령추출물(KPE)로 비교하였다. 대량생산을 위한 재배법인 1년산과 2년산의 노지재배 50% 에탄올 복령추출물(50% ethanolic extract of Korean W. cocos cultivated in a landfill, LPE)과 1년산과 2년산의 시설재배 50% 에탄올 복령추출물(50% ethanolic extract of Korean W. cocos cultivated in a facility, FPE)에 대하여 항암활성에 대한 비교도 실시하였다.
에탄올 복령추출물의 세포독성
약리활성 측정 전에 중국산 복령 및 국내산 복령의 농약 성분의 잔류가 있으면 복령추출물을 농축 시 생리활성에 영향을 주기 때문에 한국분석기술연구소에서 250여종의 농약잔류 다성분 동시분석을 실시한 결과 농약 성분이 검출 되지 않았다. 복령에 농약이 없음을 확인 한 후 재료 및 방법에 기술한 방법에 따라 CPE와 KPE를 제조하였다. 대표적으로 KPE을 갖고 3T3-L1 지방세포 내에서 지방축적을 억제하는지 평가하기 위해서 먼저 3T3-L1 세포에서의 세포독성을 평가하여 Fig. 1에 나타내었다. Fig. 1에서 보여주는 것처럼 세포가 완전하게 성장한 상태가 된 3T3-L1 전지방세포에 KPE를 1, 10, 100, 300, 1,000 μg/mL의 농도로 처리하여 24, 48, 72시간 동안 세포생존율을 측정하였다. 그 결과 KPE는 처리 하지 않은 대조군의 세포생존율과 비교하여 1,000 μg/mL에서는 48시간 배양에서 80%의 생존율(p < 0.05), 72시간에서는 78%의 생존율(p < 0.05)을 보였지만, 300 μg/mL이하의 농도에서는 72시간에 94%의 생존율을 보여 3T3-L1 전지방 세포의 생존율에 유의적인 영향을 미치지 않았다. 이러한 결과에 대하여 50% 복령추출물에 대한 근거 자료가 부족하여 최근에 전보[14]에서 보고한 에탄올 목이버섯추출물을 이용하여 3T3-L1 세포주에서 세포독성을 확인한 결과 300 μg/mL까지는 세포독성이 없는 것과 일치하였다. 따라서 이후 지방세포 내의 지방축적 억제활성을 확인하는 실험에서는 1~300 μg/mL 농도 범위의 KPE를 사용하였다.
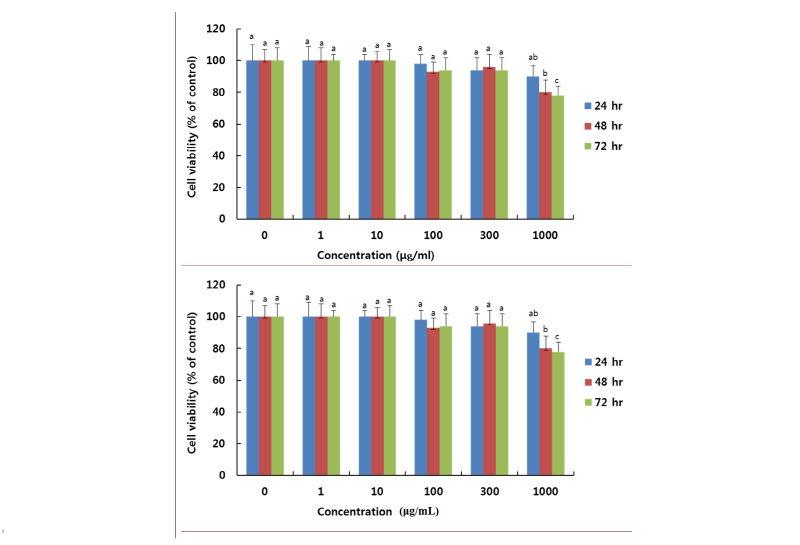
Fig. 1. Cell viability of 3T3-L1 cells 0.5 mM isobutylmethylxanthine (IBMX), 1 μM dexamethasone, 1 μg/mL insulin treated by Korean ethanolic Wolfporia poris extract (KPE) at the indicated concentration (0, 1, 10, 100, 300 and 1000 μg/mL) for 24, 48 and 72 hr. Growth rate was assessed by MTT assay. Data are expressed as percent growth rate of cells cultured in the presence of W. cocos extract, compared with untreated control cells, taken 100%. All values are mean ± SD. Letters with different superscripts are significantly different by ANOVA with Duncan’s multiple range test atp < 0.05 at each time point.
에탄올 복령추출물에 의한 지방축적 억제활성
국내산 50% 에탄올 복령추출물(KPE)에 의한 지방축적 억제활성은 3T3-L1 지방세포모델을 이용하여 평가하였다. KPE의 세포독성 결과를 바탕으로 세포생존율에 영향을 미치지 않는 농도범위(1~300 μg/mL)에서 분화 완료된 후 24, 48, 72, 96, 144시간까지 전 기간 동안 KPE를 처리한 후 세포 내 지방축적 억제활성을 확인하였다. 지방세포로 분화를 유도한 대조군에서는 다량의 지방이 축적되었고 이를 기준으로 KPE를 처리한 3T3-L1 지방세포 내의 지방축적은 10 μg/mL, 100 μg/mL 그리고 300 μg/mL에서 시간 및 농도-의존적으로 감소하였다(Fig. 2). 특히 300 μg/mL의 농도에서 3T3-L1 지방세포 내 축적 된 지방을 정량적으로 분석한 결과 300 μg/mL에서 48시간 55%, 72시간 64%, 96시간 55%, 144시간 50%의 지방축적량이 유의적으로 감소하였다(Fig. 3). Wang 등[6]은 복령에서 다당류를 추출하여 3T3-L1 지방세포에 처리한 결과 흥미롭게 본 연구와는 상반되는 50과 100 μg/mL에서 63.83% 그리고 52.75%의 지방축적을 촉진하였다. 하지만 200 μg/mL에서는 10% 지방축적을 억제하여 본 연구의 그것과 비교 시 지방축적 억제율은 작지만 억제 경향은 같았다. 저농도에서 보여준 상반되는 결과는 시료의 준비가 상이하여 활성성분의 차이점에서 기인하는 것으로 추정되었다. Li 등[15]은 메탄올을 용매로 복령추출물을 준비하였고 주성분으로 triterpenes로 확인하였으며 실험동물에서 항고지혈증 억제작용이 있다고 보고하였다. 유사한 연구로 복령은 아니지만 Park 등[16]은 상엽추출물을 3T3-L1 세포주에 400과 800 μg/mL으로 처리 시 16.98%, 그리고 32.48%로 농도-의존적으로 지방축적 감소를 보였지만 KPE보다는 억제효과가 적었다. 그러나 세포독성은 상엽추출물이 10~800 μg/mL 농도 범위에서 3T3-L1 전지방 세포의 생존율에 영향을 미치지 않았다.

Fig. 2. Cell viability of 3T3-L1 cells 0.5 mM isobutylmethylxanthine (IBMX), 1 μM dexamethasone, 1 μg/mL insulin treated by Korean ethanolic Wolfporia poris extract (KPE) at the indicated concentration (0, 1, 10, 100, 300 and 1000 μg/mL) for 24, 48, 72 and 144 hr. Growth rate was assessed by MTT assay. Data are expressed as percent growth rate of cells cultured in the presence of W. cocos extract, compared with untreated control cells, taken 100%. All values are mean ± SD. Letters with different superscripts are significantly different by ANOVA with Duncan’s multiple range test at p < 0.05 at each time point.
본 연구에서는 중국산과 국내산 복령의 효능 상의 차이를 알아보기 위하여 Fig. 2의 결과를 바탕으로 300 μg/mL의 농도에서 국내산 50% 에탄올 복령추출물(KPE)과 중국산 50% 에탄올 복령추출물(CPE)의 3T3-L1 지방세포에서 지방축적 활성을 비교하여 그 결과를 Fig. 3에 나타내었다. 300 μg/mL의 농도에서 96시간 배양을 실시한 결과 CPE와 KPE는 3T3-L1 세포 내에서 각각 65%와 63%의 유사한 억제활성을 보였다. 이러한 결과는 국내산과 중국산 복령은 모두 자연산으로 소나무 뿌리의 지하부에서 성장하는 버섯이라는 측면에서 자연환경에 크게 영향을 받지 않음으로 유사한 생리활성을 보여준 것으로 추정이 되고 결과적으로, 지방세포 내에서 지방의 축적 예방의 효과는 중국산 복령과 국내산 복령 모두 차이가 없어 원산지 구분에 대한 생리활성법으로는 부적절하였다.
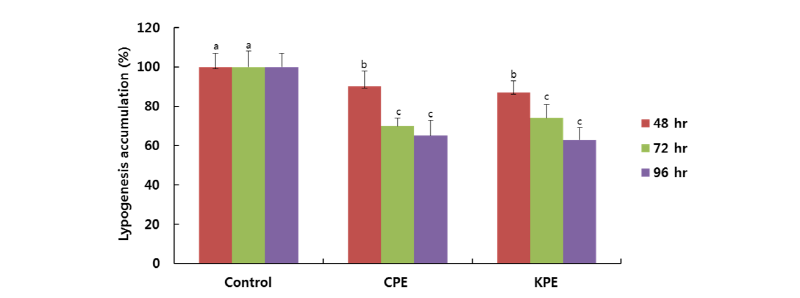
Fig. 3. Comparison of Lipid accumulation in mature adipocytes in the presence of 0.5 mM isobutylmethylxanthine (IBMX), 1 μM dexamethasone, 1 μg/mL insulin treated by Chines and Korean ethanolic Wolfporia cocos extract (CPE and KPE) at 300 μg/mL for 48, 72 and 96 hr. Differentiated 3T3-L1 adipocytes were treated with W. poria extract. Lipid accumulation was evaluated by Oil red O staining. All values are mean ± SD. Letters with different superscripts are significantly different by ANOVA with Duncan’s multiple range test at p < 0.05 at each time point.
항암활성시험
버섯류는 약리활성 중에서 항암활성이 가장 많이 알려져 있다는 것은 주지의 사실이다. 따라서 시중에 유통 중인 중국산 복령추출물(CPE)과 국내산 복령추출물(KPE)에 대하여 항암표준세포주인 Sarcoma 180 세포주를 이용하여 SRB법으로 측정을 하였다. Akihisa 등 [17, 18]은 복령의 항암효과를 증진시키는 성분으로는 25-methoxyporicoic acid A와 triterpene으로 알려져 있다. 본 연구에서는 이들 성분들을 동시에 추출 가능한 50% 에탄올 추출법을 이용하여 시중에 유통중인 국내산 복령과 중국산 복령에 대하여 50% 에탄올을 용매추출물(CPE, KPE)를 제조하여 추출물에 대하여 항암활성을 비교하였다. 항암세포주인 Sarcoma 180 세포주를 이용하여 CPE와 KPE의 항암활성시험을 평가하기 전에 세포독성을 KPE로 먼저 실시하였다(Fig. 4). 그 결과 300 μg/mL까지 90% 이상의 생존율을 보여 세포독성이 없음을 확인하였지만 1,000 μg/mL에서는 CPE는 79%, KPE는 77%의 세포의 생존율을 보였다. 따라서 CPE와 KPE의 항암활성 측정시험은 1~300 μg/mL의 농도에서 실시를 하였다(Fig. 5). Fig. 5에서 보여주는 것처럼 100 μg/mL에서 CPE와 KPE의 항암활성은 대조군과 그것과 비교할 때 64%와 66%의 암세포 성장 억제를 보였지만 유의한 수준은 아니었다. 하지만 CPE와 KPE의 300 μg/mL 농도에서는 KPE는 20%의 생존율로 80%의 성장 억제를 보인 반면 CPE는 36%의 세포 생존율로 64%의 성장 억제를 보여 KPE가 CPE보다 유의성 있는 암세포 성장 억제를 보였다(p < 0.05).
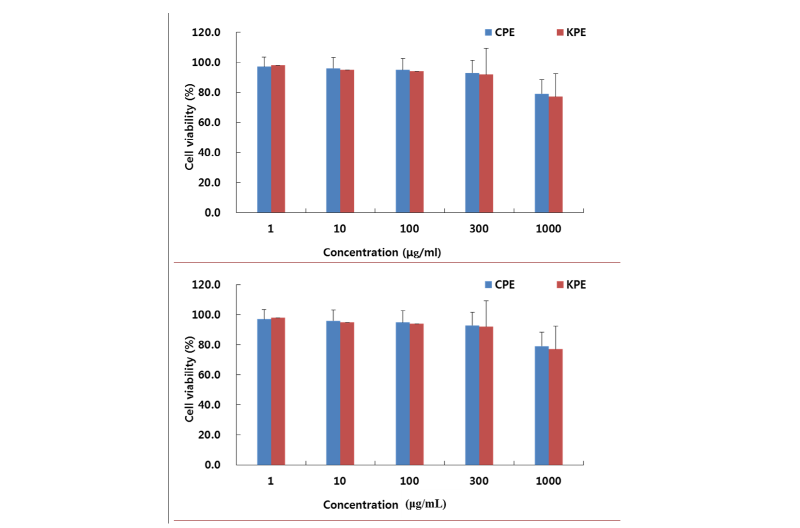
Fig. 4. Cell viability of Sarcoma 180 cells by Chinese and Korean 50% ethanolic Wolfporia poris extract (CPE and KPE) at the indicated concentration (0, 1, 10, 100, 300 and 1000 μg/mL). Growth rate was assessed by MTT assay. Data are expressed as percent growth rate of cells cultured in the presence of W. cocos extract, compared with untreated control cells, taken 100%. All values are mean ± SD. Letters with different superscripts are significantly different by ANOVA with Duncan’s multiple range test at p < 0.05.
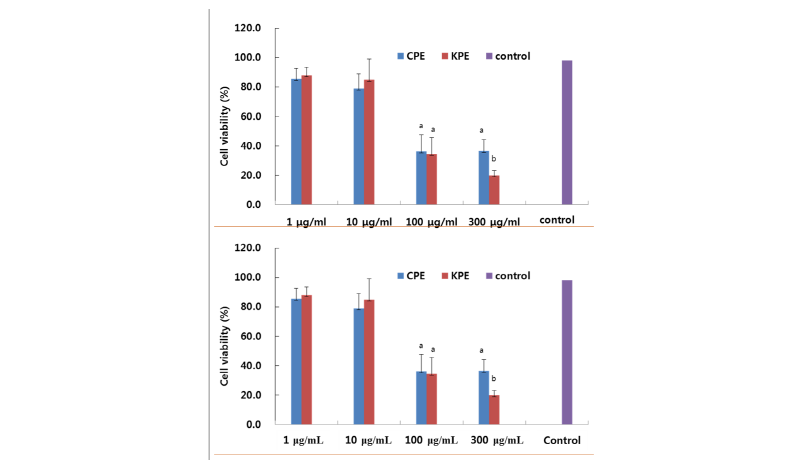
Fig. 5. Comparative anticancer activity of Chinese and Korean ethanolic Wolfporia cocos extract (CPE & KPE) in Sarcoma cell. The anticancer activity was compared at 1, 10, 100 and 300 μg/mL. All values are mean ± SD. Letters with different superscripts are significantly different between Chinese and Korean extract with Student t-test at p < 0.05 at each concentration.
산업적으로 여러 분야에서 복령을 다양하게 이용함으로 공급량의 대부분이 수입에 의존한다. 최근에 전국적으로 복령을 인공적으로 재배하고 품종을 개량하고 있다. 인공재배는 노지재배와 시설재배로 복령을 생산하고 있다. 본 연구에서는 앞에서 실험한 유통 중인 중국산 복령, 국내산 복령을 기본으로 1년산, 2년산 노지재배 복령 그리고 1년산, 2년산 시설재배 복령을 같은 방법으로 추출하여 항암활성을 비교하였다. 따라서 본 연구에서는 국내산과 중국산 복령의 항암활성 차이에 집중하여 추가적으로 CPE, KPE를 기본으로 현재 인공재배 중인 국내산 노지복령 1년산 에탄올 추출물(1-LPE)과 2년산 에탄올 추출물(2-LPE), 국내산 시설복령 1년산(1-FPE) 그리고 국내산 시설복령 2년산(2-FPE) 에탄올 복령추출물을 1~300 μg/mL에서 항암활성을 측정하여 the half maximal inhibitory concentration (IC50)으로 비교하였다. 그 결과를 Fig. 6에 나타내었다. KPE의 IC50가 150 μg/mL로 CPE의 IC50인 175 μg/mL보다 뛰어난 항암효과를 보였지만 유의하지는 않았다. 하지만 2-LPE (IC50, 119 μg/mL), 1-LPE (IC50인 120 μg/mL), 2-FPE (IC50인 143 μg/mL), 1-FPE (IC50인 146 μg/mL)의 IC50로 CPE의 그것보다 각각 1.5배, 1.5배, 1.3배, 1.2배 낮은 수치를 보여 모두 CPE보다 유의성 있는 항암활성을 보였다(p < 0.05). 이러한 결과에서 인공재배인 노지재배 1년산과 2년산 복령 그리고 시설재배 1년산과 2년산 복령의 항암활성은 차이를 보이지 않음으로 재배농가는 사용목적에 따라서 생산량과 원가를 기반으로 복령의 수확시기를 설정할 수 있을 것으로 생각되었다. 하지만 수확 시기별로 19개월 이상 재배한 복령의 추출물이 폐암, 난소암, 피부암 등의 암세포주에서 200 μg/mL 농도에서 상대적으로 높은 항암활성을 보인다고 보고된 바 있다[19]. 이러한 결과의 차이점은 추출법, 자연에서 성장률과 인공재배에서의 성장률에서 오는 차이점으로 생각된다. 위의 결과를 요약하면 복령의 항암활성은 25-methoxyporicoic acid A와 triterpene 성분[15, 16]에서 기인한 것으로 알려져 있으므로 이들 성분 분석과 표준화된 항암활성측정법을 최적화시키면 원산지 검증의 보조 수단으로도 응용이 가능할 것으로 생각되었다.
반수치사량(50% of lethal dose, LD
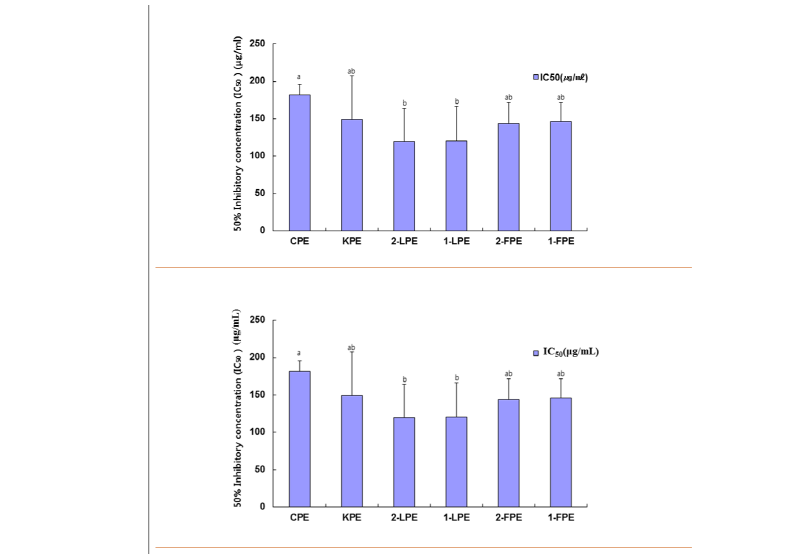
Fig. 6. Comparative anticancer activity of Chinese and Korean ethanolic Wolfporia cocos, 1 years and 2 years landfill (1- and 2-LPE), 1 year facility and 2 years facility W. cocos extract (1- ans 2-FPE). All values are mean ± SD. p = 0.21 value is calculated by Student t-test at p < 0.05 between Chinese and Korean extract (CPE and KPE).
반수치사량(50% of lethal dose, LD
반수치사량(50% of lethal dose, LD
복령은 식품의약품안전처에서 식품의 부원료 목록에 등재되어 있어 원료 배합 시 50% 미만을 사용하고 원료를 혼합할 경우에도 5종류 이하만 혼합 가능하다. 또한 혼합성분의 총량이 제품의 50% 미만(배합수 제외)이어야 한다. 그럼에도 불구하고 현실에서는 복령분말 및 복령추출물은 이 범주를 넘어서 많은 제품에서 활용이 되고 있다. 따라서 현재 시중에서 유통되고 있는 CPE와 KPE의 단회 경구 독성을 실시하여 안전성을 검토하였다. 본 연구에서는 오랫동안 식품 및 식품보조첨가제로 사용되어 온 점을 감안하여 최고 투여용량인 2,000 mg/kg으로 마우스에 대해 단회 경구 독성을 실시하였다. KPE와 CPE을 마우스에 경구투여 후 관찰기간 14일 동안 모든 시험군에서 시험기간 동안 시험물질에 의한 독성증상과 특이할 만한 임상증상도 나타나지 않았다. 시험 종료 후 생존동물의 검시 KPE 그리고 CPE 투여군과 대조군 모두 내부 장기는 육안 상 이상소견이 관찰되지 않았다. 이상의 결과를 종합하여 보면, KPE와 CPE를 마우스에 단회 경구투여 하였을 때 시험물질에 기인한 사망은 관찰되지 않았고 LD50 수치는 암‧수 모두에서 2,000 mg/kg 이상이었다(Table 2). 하지만 식품으로 적용 시에는 단회 섭취보다는 장기적인 꾸준한 섭취가 이루어지기 때문에 아급성 및 만성 독성 검사도 필요한 것으로 생각되었다.
본 연구에서는 대부분 수입에 의존하여 유통되고 있는 중국산 복령(CPE)과 현재 시중에서 유통되는 국내산 복령(KPE)에 대하여 복령의 대표적인 약리활성인 지방축적억제시험과 항암활성시험법을 활성편차가 적은 표준세포주인 3TL-1 세포주와 Sarcoma 180 세포주를 이용하여 비교하였다. 또한, 중국산 복령을 대체할 인공재배 복령도 수확시기별로 항암활성시험을 이용하여 비교하였다. 또한 유통 중인 중국산 복령과 국내산 복령을 단회 경구 독성시험을 실시하였다. 그 결과를 종합하면 중국산 복령과 국내산 복령은 3T3-L1 지방세포에서 지방축적 억제작용의 차이점은 없었으나 Sarcoma 180 암세포주에 대하여 국내산 복령의 일정 농도에서 항암활성이 높은 것이 확인되었다. 또한 인공재배로 생산되는 노지재배 복령과 시설재배 복령의 수확시기별로 Sarcoma 180 암세포주에 대한 항암활성은 차이가 없었다. 특히 유통되는 중국산 복령과 국내산 복령의 추출물은 ICR 계통의 마우스에서 단회 경구투여 시 2,000 mg/kg 이하의 용량에서 어떠한 독성 영향도 유발하지 않아 LD50는 최소한 2,000 mg/kg 이상이라는 것으로 나타났다. 이러한 결과로부터 50% 복령 에탄올 추출물은 in vitro에서 비만억제 작용 및 항암 작용이 있어 기능성 원료 소재 개발에 응용이 가능할 것으로 기대되었다.
적요
본 연구에서는 국내산 50% 에탄올 복령추출물(KPE)과 중국산 50% 에탄올 복령추출물(CPE)의 약리활성 비교를 위하여 전 지방세포주인 3T3-L1 세포주와 암세포주인 Sarcoma 180 세포주를 이용하여 지방축적 억제활성과 항암활성을 비교하였다. 또한 노지재배 및 시설재배의 1년산 복령과 2년산 복령의 50% 에탄올 복령추출물(LPE, FPE)에 대해서도 50% 항암억제활성(IC50)로 중국산 복령과 비교하였다. 추가적으로 현재 시중에서 유통되고 CPE와 KPE의 안전성 자료를 획득하고자 단회 경구 독성시험을 실시하였다. CPE와 KPE를 3T3-L1 세포에 처리 후 48시간 이후에 대조군과 비교 시 지방축적 억제를 보였으나(p < 0.05), CPE와 KPE 사이에서는 지방축적 억제활성의 차이가 없었다. Sarcoma 180에 대한 CPE와 KPE의 항암활성을 비교할 때 시험한 농도에서 유사한 활성을 보였지만 300 μg/mL의 고농도에서는 KPE가 CPE보다 높은 항암활성을 보였다(p < 0.05). 중국산 복령을 대체하고자 인공재배에서 생산된 노지재배 복령(LPE)과 시설재배 복령(FPE)의 항암활성 비교에서 CPE의 항암활성보다 높게 나타났다(p < 0.05). 단회 독성시험에서 CPE와 KPE의 LD50(반수치사량)은 2,000 mg/kg 이상으로 추정되었다. 위의 결과를 종합 시 암세포주인 Sarcoma 180 세포주를 이용한 항암활성측정법은 중국산과 국내산의 원산지 검증의 생물활성검증의 보조수단으로 활용이 가능할 것으로 기대되었다. 국내에서 인공재배 되는 노지재배 복령 및 시설재배 복령은 중국산 복령을 대체하여 수입 감소의 효과를 기대할 수 있으며 지방축적 억제활성 및 항암활성의 기능성 원료로 활용이 가능할 것으로 생각되었다.



