서론
표고(Lentinula edodes)는 담자균문, 담자균강, 주름버섯목, 절편버섯과에 속하는 진균류로서, 봄과 가을 2회에 걸쳐 참나무류, 밤나무, 서어나무 등 활엽수의 마른 나무에 발생한다. 지름이 4~10 cm정도인 둥근 갓은 처음에 반구 모양이지만 점차 펴져서 편평해지며, 갓 표면은 다갈색이고 흑갈색의 가는 솜털처럼 생긴 비늘조각으로 덮여있는데 때로는 터져서 흰 살이 보이기도 한다. 버섯 대는 3~6 × 1 cm이고 나무에 붙어있는 상태에 따라 한 쪽으로 기울어진다. 버섯대 표면은 위쪽이 흰색, 아래쪽이 갈색이고 섬유처럼 질긴 편이다. 이러한 표고버섯은 국내에서는 식용과 약용으로 사용되는데 찜, 볶음 등의 고급 요리에 사용될 뿐만 아니라 약선 요리의 재료로 이용되기도 한다. 특히 국내에서는 이를 건조시켜 국물을 우려내는 데 많이 사용한다. 그리고 소아마비, 종두후 발진, 수종, 위통, 두통, 현훈, 신체 허약에 응용되고, 구루병 감기, 피부염, 혈관 경화, 고혈압, 요실금, 식중독에 효과가 있다[1]. 더욱이 혈액 속 콜레스테롤 축적을 억제하는 유용 성분인 D-Eritadenine이 함유되어 있다고도 밝혀진 바 있어[2], 서구화된 식단 탓에 지속적으로 문제가 되고 있는 고혈압 예방 식품으로 각광받고 있다. 면역 조절 및 항종양 효과가 있다는 lentinan도 함유되어 있다[3]. 그리고 표고의 추출물이 항산화 효과도 있다는 것이 선행 연구에서 밝혀졌다[4]. 이렇게 많은 효능이 있는 만큼 인기도 많아, 국내에서의 표고 생산량은 통계치가 존재하였던 2001 년부터 매해 약 2 천만 kg씩 생산되고 있고, 생산액 또한 매해 2 천억 정도를 유지하고 있다[5].
바이오에어로졸이란 바이러스, 세균이나 진균을 포함한 미생물과 알레르기를 유발할 수 있는 꽃가루 등이 부유하여 기류를 타고 이동되는 공기 중에 존재하는 생물학적 요소이다[6]. 특히 표고 재배사의 경우, 표고 생장에 중요한 온도와 습도로 인해 바이오에어로졸이 존재할 가능성이 크다. 바이오에어로졸인 부유진균의 포자는 전염성 질환을 야기시킬 수 있는 가능성이 있으며, 호흡기 또는 공기와의 직접적으로 접촉을 하는 피부에 호흡기 질환, 알레르기, 아토피 암 등을 유발시킬 수 있다[7-10]. 표고 재배사 내에 이러한 바이오에어로졸이 존재할 경우, 표고를 재배하고 있는 재배자에게 질병을 일으킬 수 있으며, 표고의 병원균으로 알려진 푸른곰팡이가 존재한다면 표고에 병을 일으키거나 표고 재배용 톱밥배지나 원목에 오염을 일으켜 표고균의 정착과 활착을 방해 함으로서 표고 생산성을 떨어뜨릴 수 있다. 또한 버섯 자체를 오염시켜 식품으로서 유통될 시 식품 오염을 야기시킬 수 있다.
현재까지 버섯 재배사의 실내환경은 버섯의 생산과 수확, 수량 등 생산적인 측면에서만 연구되어 왔다. 재배사 실내에서 작업을 하는 사람에게 알레르기를 일으키는 사례가 종종 있었고 푸른곰팡이병 같이 버섯에 피해를 입히는 오염균 또는 병원균이 계속해서 존재해왔다. 선행 연구에서 표고 재배사에서 바이오에어로졸로서 세균 조사를 하였을 때 인체 위해성이 알려진 세균들이 존재하였다[11, 12]. 이 연구는 세균에 국한되어 연구가 된 바, 본 연구에서는 국내 여러 지역의 표고 재배사에서 2년 동안 바이오에어로졸로서 부유진균을 조사하여 인체 유해성 진균, 식물 병원성 진균, 식품에 오염을 줄 수 있는 진균 등이 존재하는지 조사하여 재배사 실내환경 관리 개선을 위한 미생물학적 기초 정보를 얻고자 수행하였다.
재료 및 방법
시료 채집 장소 및 조사 기간
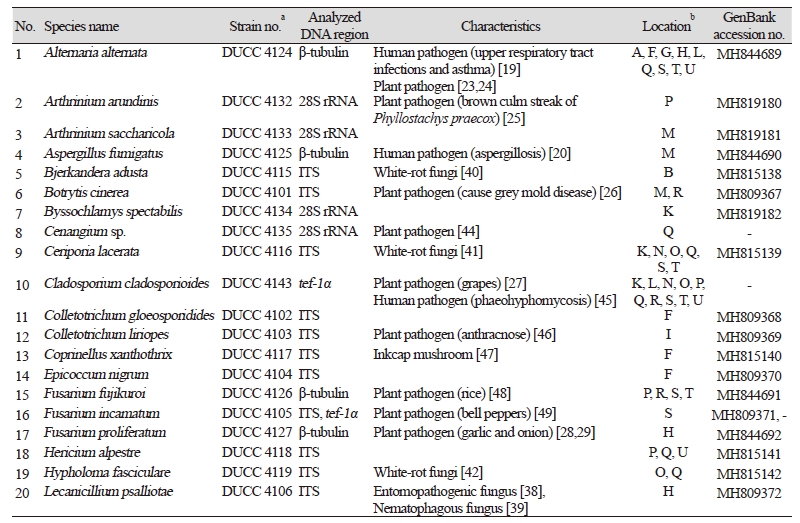
2015년 10월과 11월에 거창, 구미 부여, 여주, 익산, 장흥, 청양에 위치한 10 개 표고 재배사와 2016년 4~6월에 거제, 구미, 군산, 서천, 여주, 익산, 장흥, 청양에 위치한 11 개 표고 재배사 등 총 21 차례 표고 재배사에서 실내 공기 중 부유진균을 채집하였다. 이 중 톱밥배지(sawdust media)를 이용하여 표고를 재배하는 재배사는 10 곳 이였으며 11 곳은 원목(log bed)을 이용하는 재배사였다(Table 1).
|
Table 1. Temperature, humidity, fungal concentration in the indoor air of greenhouses for oak mushroom cultivation investigated in 2015 and 2016 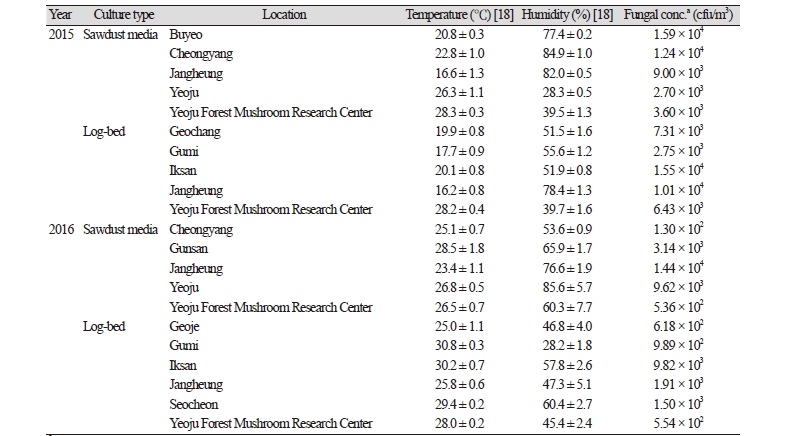
|
|
|
aconc., concentration |
|
시료 채집 및 곰팡이 분리 동정
실내공기 중 진균 농도 측정과 채집은 국제표준인 ISO 16000-18에 기반하여 측정기기 Andersen sampler (Single Stage Ambient Viable Sampler, Model 10-880; Tisch Environmental, Cleves, OH, USA)를 사용하여 충돌법으로 28.3 L/min 유량으로 1 분간 시료를 채집하였다[12]. 재배사 내 3 개의 지점을 선택하고 선택 지점에서 삼각대로 1.3 m 높이를 맞추어 측정기기를 설치하여 부유진균을 3 회씩 반복으로 채집하였다. 사용한 배지는 malt extract agar (MEA; Difco, Detroit, MI, USA)에 세균 증식을 억제하기 위해 streptomycin (100 μg/mL), ampicillin (100 μg/mL), kanamycin (50 μg/mL) 등을 첨가하여 사용하였다. 실내 공기에서 진균을 채집한 배지는 25℃ 배양기에서 5 일간 배양하였고 자라난 진균 colony 수를 계수하여 공기 중 부유진균 농도를 계산하였다. 배지에 자라난 진균의 colony의 모양과 색 등 형태학적으로 다르게 관찰되는 진균 colony를 potato dextrose agar (PDA; Difco, Detroit, MI, USA) 배지에 순수분리 하였다.
순수분리된 진균은 형태적 관찰을 위해서는 광학현미경(Axioskop40; Carl Zeiss, Oberkochen, Germany)으로 포자와 균사를 관찰하였고 필요에 따라 lactophenol blue를 사용하여 염색 후 관찰하고 형태적 동정을 수행하였다. 분자적 동정이 필요한 균류를 위해서는 PDA 배지에서 5~10 일 간 배양하여 배지에 자라난 균사를 수확하고 drilling 방법으로 genomic DNA를 추출하였다[13]. 진균 동정에 사용된 유전자 부위는 internal transcribed spacer (ITS) region, large subunit rDNA (28S rDNA), calmodulin, β-tubulin, translation elongation 1- α (tef-1α) 유전자로 진균 분류 그룹에 따라 각각 진균을 동정할 수 있는 부위를 선택하여 사용하였다. ITS region은 ITS1 primer (5’-TCCGTAGGTGAACCTGCG-3’)와 ITS4 primer (5’-TCCTCCGCTTATTGATATGC-3) [14], 28S rDNA는 LR0R primer (5’-ACCCGCTGAACTTAAGC-3’)와 LR5 primer (5’-TCCTGAGGGAAACTTCG-3’) [15], calmodulin 유전자는 CL1 primer (5’-GARTWCAAGGAGGCCTTCTC-3’)과 CL2A (5’-TTTTTGCATCATGAGTTGGA-3’) [16], β-tubulin 유전자는 BT12 primer (5’-GTTGTCAATG CAGAAGGTCTC-3’)와 T10 primer (5’-ACGATAGGTTCACCTCCAGAC-3’) [13], tef-1α 유전자는 TEF728 primer (5’-CATCGAGAAGTTCGAGAAGG-3’)와 TEF1 primer (5’-GCCATCCTTGGAGATACCAGC-3’) [17]을 사용하여 PCR을 수행하였다. 증폭된 PCR 산물은 Macrogen (Seoul, Korea)에 의뢰하여 염기서열을 분석하였다. 분석된 염기서열의 분자동정을 위해서는 미국 National Center for Biotechnology Information (http://www.ncbi.nlm.nih.gov)의 사이트에서 BLAST 프로그램을 사용하여 DNA 데이터베이스에 등록되어 있는 진균들의 DNA 와 상동성을 비교하였다. 분석된 DNA 염기서열은 GenBank에 등록하였으며 등록번호는 Table 2에 제시하였다.
결과 및 고찰
재배사 내부의 온도·습도와 부유진균의 농도
2015년과 2016년 2년 동안 21 개의 표고버섯 재배사의 온도와 습도를 측정하였을 때, 가장 낮게 측정된 온도는 16.2℃로 2015년에 장흥에 위치한 원목 재배사였고, 가장 높은 온도로 측정된 곳은 2016년 구미에 위치한 재배사로 30.8℃였다 (Table 1) [18]. 습도의 경우 28.2%~85.6% 범위로 측정되었다. 표고버섯 재배사는 표고버섯의 생육과 발생을 위해서 주기적으로 살수를 함으로 재배사 내의 상대습도는 대체적으로 높게 측정되었다. 재배사 내의 온도 범위와 습도 범위는 여러 진균 종이 충분히 서식할 수 있는 환경으로 나타났다.
각 재배사로부터 채집한 시료를 5 일간 25℃ 배양기에서 배양하고 자라나온 colony를 계수하여 공기중에 존재하는 진균 농도를 측정하였다. 가장 낮게 측정된 부유진균의 농도는 1.30 ⅹ 102 cfu/m3였고 가장 높게 측정된 농도는 1.59 ⅹ 104 cfu/m3였다. 원목재배사와 톱밥재배사 간의 부유진균의 농도는 큰 차이를 보이지 않았으며 부유진균의 농도의 차이는 재배방식이 아닌 재배사 관리에 따른 차이로 사료된다. 환경부에서 2018년부터 시행하는 다중이용시설에서의 진균의 실내공기질 권고기준인 500 cfu/m3를 초과하는 경우가 21 차례 재배사 시료채취 중 20 차례 시료에서 나타났다. 이러한 결과는 일반 다중이용시설에 적용되는 기준을 직접 비교할 수는 없지만 버섯 재배사라는 특수환경 시설에서의 측정된 농도는 어찌하든 버섯 재배사 환경이 인체에 유해할 수 있는 조건을 표출할 수 있음을 시사한다. 이러한 농도 측정 결과는 진균 생육에 적정 온도와 습도로 측정된 재배사 내의 환경 조건 결과와 부합된다.
재배사 내 존재하는 진균 동정과 보고된 특성
2년 동안 21 차례 표고버섯 재배사 내 공기 시료 채집분석을 통해 총 450 균주의 진균이 순수 분리되었다. 배지에서의 colony 특성과 광학현미경을 이용한 포자와 균사 형태 관찰 그리고 ITS region, large subunit rDNA, β-tubulin, calmodulin, tef-1α 유전자를 분석하고 분자적 동정을 수행하여 33 속 46 종의 동정하였다(Fig. 1, Table 2). 동정된 진균은 자낭균류 37 종, 담자균류 6 종, 접합균류 3 종으로서 자낭균류가 대부분 차지하였다. 이는 공기 중에 부유할 수 있는 형태가 주로 포자라는 것을 고려하면 분생포자 형성이 많은 자낭균이 공기 중에는 주로 분포할 것이기 때문에 이런 결과가 도출된 것으로 생각된다.

Fig. 1. Photos of the colonies of isolated fungi. A, Alternaria alternata; B, Arthrinium arundinis; C, Arthrinium sacharicola; D, Aspergillus fumigatus; E, Bjerkandera adusta; F, Botrytis cinerea; G, Byssochlamys spectabilis; H, Cenangium sp.; I, Ceriporia lacerata; J, Cladosporium cladosporioides; K, Colletotrichum gloeosporioides; L, Colletotrichum liriopes; M, Coprinellus xanthothrix; N, Epicoccum nigrum; O, Fusarium fujikuroi; P, Fusarium incarnatum; Q, Fusarium proliferatum; R, Hericium alpestre; S, Hypholoma fasciculare; T, Lecanicillium psalliotae; U, Letendraea helminthicola; V, Metarhizium sp.; W, Mucor nidicola; X, Mucor racemosus; Y, Mycosphaerella tassiana; Z, Myrmecridium schulzeri; AA, Myrothecium gramineum; AB, Neopestalotiopsis sp.; AC, Nigrospora oryzae; AD, Paraconiothyrium brasiliense; AE, Penicillium brevicompactum; AF, Penicillium glabrum; AG, Penicillium multicolor; AH, Penicillium ochrochloron; AI, Penicillium qii; AJ, Penicillium raistrickii; AK, Periconia byssoides; AL, Periconia sp.; AM, Phomopsis vaccinia; AN, Pseudocercosporella fraxini; AO, Rhizopus microspores; AP, Sarocladium strictum; AQ, Trametes versicolor; AR, Trichoderma atroviride; AS, Trichoderma harzianum; AT, Trichoderma longibrachiatum.
21 차례 재배사 공기 시료채취 중 11 개 재배사 공기 시료에서 인체 위해성을 지니는 것으로 보고된 진균 4 속 4 종이 존재하였다. 상기도 감염과 천식을 일으키는 Alternaria alternata [19], asgergilosis를 일으키는 Aspergillus fumigatus [20], mucormycosis를 일으키는 Mucor racemosus [21], 장염을 일으키는 Rhizopus microspores가 분리되었다[22]. 또한 식물 병원균으로 보고가 된 Alternaria alternata, Arthrinium arundinis, Botrytis cinerea, Cenangium sp., Cladosporium cladosporioides, Colletotrichum liriopes, Fusarium fujikuroi, Fusarium incarnatum, Fusarium proliferatum, Nigrospora oryzae, Penicillium glabrum, Phomopsis vaccinii, Sarocladium strictum 등 총 13 종이 분리되었다[23-33]. 이들 균류는 버섯 농장의 위치가 주로 농사를 짓는 농촌 지역에 존재하기 때문에 시료를 채취한 시기도 작물이 재배되고 있는 시기였던 바 이들 주변의 작물재배 환경에서 공기를 통해 버섯 재배사 실내로 유입되었을 가능성이 큰 것으로 보인다.
버섯의 재배와 관련하여서는 버섯에 푸른곰팡이병을 유발하는 Penicillium brevicompactum, Trichoderma atroviride, T. harzianum, T. longibrachiatum가 존재하였다[34-37]. 특히 이들 Trichoderma 종들은 표고버섯 재배에 크게 피해를 주는 주요 균이다. 특히 T. harzianum은 가장 큰 피해를 주는 균으로 알려져 있는데 14 개 재배사 시료에서 분리가 되었고 T. atroviride와 T. longibrachiatum는 각각 8 개가 3 개 재배사 시료에서 분리되었다. 이는 표고 재배환경에 표고 해균이 널리 존재함을 보여준다. 농장에 따라 검출된 곳과 검출되지 않은 곳이 있는 등 차이가 있는 것은 분명히 재배사 위생관리의 정도에 따라 차이가 존재할 것으로 생각된다. 조사된 21 개 시료 중 17개 시료에서 버섯에 유해한 Trichoderma종이 검출된 것은 분포 빈도가 매우 높은 것이다. 이는 재배사의 위생관리가 좀 더 개선되어야 함을 보여주는 중요한 결과이다. 그 밖에 곤충 병원성으로 보고된 Lecanicillium psalliotae와 백색 부후균으로 보고된 Bjerkandera adusta, Ceriporia lacerata, Hypholoma fasciculare, Trametes versicolor가 존재하였다[38-43]. 백색 부후균은 원목을 이용하여 표고를 재배하는 재배사에서 표고 골목에 정착할 경우 표고균과 경합하여 표고의 생육을 억제할 수 있고 또한 표고 기질을 분해하여 골목의 수명을 단축시킬 수 있는 바 재배사 환경에서 관리가 필요한 균류이다. 본 연구에서도 주로 원목 재배 방식을 사용하는 재배사 공기 시료에서 분리되었음을 볼 때 재배사 실내의 공기 환경 관리의 필요성을 나타낸다.
본 연구에서 분리된 진균에는 인체에 유해한 종과 식물에 병을 일으키는 종, 버섯에 피해를 주는 종들이 함께 존재한다는 것을 알 수 있었다. 인체에 유해한 종들이 지속적으로 고농도로 존재할 경우 인체의 건강에 영향을 줄 수 있고 표고버섯에 큰 피해를 주는 Trichoderma 종들도 다수 존재한다는 것이 나타났기에 재배사 내 실내공기에 대한 위생적인 관리가 필요하다고 생각된다. 또한 국내 여러 지역에 소재한 표고 버섯 재배사를 중심으로 2년간 서로 다른 시기에 실내 공기를 채집하여 분석한 것으로 버섯 재배사 내의 진균 농도와 종에 대한 광범위한 조사로는 국내외로 처음 보고하는 것으로 향후 균류의 기초연구자료로서 그리고 재배사 관리를 위한 환경 생태 자료로서 그 이용 가치가 매우 높다고 생각된다. 이는 앞으로 더 다양한 종류의 버섯을 재배하는 공간에 대한 분석을 수행하는데 필요한 접근 방법과 도출되는 결과의 비교 자료로서 활용이 기대된다.
적요
공기에 의해 운반되는 바이오에어러졸은 농산물 오염을 널리 일으키는 원인으로 알려져 있다. 육안으로 보이지 않는 진균 포자는 버섯 재배 중에 버섯과 인간의 건강에 해를 끼치는 바이오에어로졸이다. 본 연구는 한국의 표고버섯 재배사 실내의 공기 중에 존재하는 진균의 농도 및 종 분포에 관한 기초 자료를 얻기 위해 수행되었다. 2015년과 2016년에 국내 6 개의 다른 지역에 위치한 13 개의 표고버섯 재배 농장에서 21 차례 실내공기로부터 진균 포자를 샘플링하고 분석하였다. 공기 중 진균 농도는 1.30 ⅹ 102 - 1.59 ⅹ 104 cfu/m3 범위였다. 중요하게도 20 차례의 농장방문 시료 채취 결과에서 진균 농도가 환경부의 실내공기질 권장 기준 농도인 500 cfu/m3를 초과하였다. 총 450 균주의 진균이 분리되었으며 46 속 33 종으로 동정되었다. 이중에 인체 위해균(4 속 4 종)과 식물병원균(10 속 13 종)이 존재하였다. 또한, 버섯 건강에 영향을 미치는 해로운 종인 Trichoderma harzianum, T. atroviride 및 T. longibrachiatum가 21 건 시료 채취 중 17 건에서 빈도 높게 검출되었다. 본 결과는 버섯생산의 재배관리를 위해서 재배사 실내 공기질을 개선해야 한다는 증거를 제시하였다.