서론
내생균(endophytic fungi)은 식물체 내에서 살아가며 병증을 유발하지 않는 균류의 통칭이다[1]. 이러한 공생 관계는 대부분의 초본, 혹은 목본 식물에서 잎과 뿌리 등의 모든 조직 내에서 발견된다[1]. 내생균과 식물 간의 상리 공생 관계는 완전히 밝혀지지는 않았으나, 내생균은 2차 대사산물의 분비를 통해 식물을 외부의 병원체로부터 보호하는 것으로 알려져 있다[2]. 이러한 물질 중 많이 알려져 있는 물질은 주목나무속(Taxus spp.) 식물의 잎에 서식하는 내생균이 분비하는 항암작용 물질인 taxol이 있으며[3], 이와 같이 내생균이 분비하는 물질의 다양한 이용 가치로 인해 식물 내생균에 대한 연구의 필요성이 증가하고 있는 상황이다.
본 연구에서는 식물의 잎에서 분리된 내생균의 다양성 연구를 통해 확인된 6종의 국내 미기록 내생균의 형태적 특성 및 분자생물학적 계통을 기술하고자 한다.
재료 및 방법
균 분리에 이용된 식물 재료는 구상나무(Abies koreana Wilson), 꽝꽝나무(Ilex crenata Thunb.), 층층이풀(Clinopodium chinense (Benth.) O. Ktze) 3종으로, 구상나무와 꽝꽝나무는 제주도 한라산의 해발 1600 m 부근(N33°21'44.8", E126°32'24.0"), 층층이풀은 제주도 서귀포의 이승이오름(N33°21'58", E126°36'14")에서 채집되었다. 병증이 없는 건강한 상태의 잎을 채집하여 폴리에틸렌 백에 담아 48시간 내에 실험실로 운반하였다. 증류수로 세척된 잎 시료를 3%의 NaClO 용액으로 1분간 표면 살균한 뒤 다시 70% EtOH로 2분간 세척하였다. 표면살균 처리된 잎을 적당한 크기로 잘라 potato dextrose agar (PDA) 배지에 4조각씩 치상하였다. 25℃의 암소에서 3~7일간 배양하면서 균사가 뻗어 나오면 새로운 PDA 배지에 계대하여 순수 분리하였고, 확보된 균주를 다시 PDA 배지와 malt extract agar (MEA) 배지에 3점 계대하여 7일간 동일한 조건으로 배양한 뒤 형태적 특성을 관찰하였다(Fig. 1). 염기서열 분석을 위하여 DNeasy Plant mini kit (Qiagen, Germantown, MD, USA)의 protocol에 따라 균사에서 genomic DNA를 추출한 뒤 균 특이적인 프라이머인 ITS1F와 ITS4를 이용하여[4] internal transcribed spacer (ITS) 영역을 증폭하였고, 프라이머 LR0R과 LR16을 이용하여[5] rDNA의 large subunit (LSU) 영역을, 프라이머 Bt2a와 Bt2b를 이용하여[6] beta-tubulin (TUB) 영역을 증폭하였다. Annealing 온도는 ITS 영역은 50°C, LSU rDNA 영역은 44°C, TUB 영역은 55°C로 설정하여 수행하였으며, PCR 산물은 1.5% agarose gel에서 22분간 전기영동을 실시하였고, 각각 target DNA 단편의 크기를 확인한 후 염기서열 분석을 의뢰하였다(SolGent, Daejeon, Korea). 분석된 염기서열은 NCBI 상에서 BLAST를 이용하여 유사도를 확인한 후 각 종들 간의 계통 분석을 통한 유연 관계를 확인하기 위해 MEGA7를 이용하여, ITS와 LSU rDNA 영역의 염기서열을 Concatenated alignment로 제작 후에 neighbor-joining 방법으로 계통수를 작성하였다. 분리된 균주의 생물표본은 국립생물자원관(NIBR)에 기탁하였으며, 연구에 사용된 DNA 염기서열은 미국 국립생물정보센터(NCBI)에 등록하였다.

Fig. 1. Colonies of strain P8 (Diaporthe goulteri) grown for 7 days on PDA (A) and MEA (G), conidia (M). Colonies of strain 17E026 (Diaporthe vaccinii) grown for 7 days on PDA (B) and MEA (H). Colonies of strain 16H073 (Rhizosphaera pini) grown for 7 days on PDA (C) and MEA (I), conidiophore and conidium (N, O). Colonies of strain 16H342 (Valsa friesii) grown for 7 days on PDA (D) and MEA (J). Colonies of strain 17E107 (Xylaria primorskensis) grown for 7 days on PDA (E) and MEA (K), conidia (P). Colonies of strain 16H107 (Zalerion arboricola) grown for 7 days on PDA (F) and MEA (L), conidiophore and conidia (Q, R). PDA, potato dextrose agar; MEA, malt extract agar (scale bar = 10 μm).
결과 및 고찰
본 연구에서 분리하여 동정한 국내 미기록 내생균에 대하여 각 종의 형태적 특징과 염기서열 분석을 통한 계통분석 결과를 아래와 같이 제시하였다.
Diaporthe goulteri, R.G. Shivas, S.M. Thomps. & Y.P. Tan, Persoonia 35: 43 (2015)
층층이풀의 잎에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 직경은 34~35 mm 정도이며, 앞·뒷면 모두 밝은 흰색을 띄고 균총의 고도는 배지에 납작하게 붙어 있는 형태이다. 중앙부에서 가장자리로 균사가 방사형으로 뻗어 나간다(Fig. 1A). MEA 배지에서 7일간 배양된 균총의 직경은 39~40 mm 정도로 PDA에서보다 빠른 속도로 자라며, 색과 균총의 고도는 PDA와 동일하나 균사가 더 조밀하게 생장하며 가장자리가 entire형태를 취한다(Fig. 1G). 분생자의 형태는 초승달 형태로 휘어져 있는 얇고 긴 형태이며, 색은 무색 투명 혹은 연한 갈색이다. 분생자(conidia)의 크기는 12.8~19.5 × 1.2~3.9 μm 이다(Fig. 1M).
Specimen examined: Seoguipo, Jeju-do, Korea, N33°21'58" E126°36'14", April 20, 2017, isolated from a leaf of Clinopodium chinense, strain P8, NIBRFG0000501462, GenBank No. MK159394.
Notes: D. goulteri는 2015년 Shivas 등에 의해 호주에서 보고된 종이며, 해바라기 종자에서 최초로 분리된 것으로 기록되어 있다[7]. Diaporthe속에 속하는 종들은 일반적으로 alpha-conidia와 beta-conidia의 두 종류의 분생자를 만드는 것으로 알려져 있다[8]. 원 기재문에서는 alpha-conidia 한가지의 형태가 기록되어 있었으나[7], 본 연구에서는 beta-conidia가 분생자가 확인되었다. 원 기재문의 alpha-conidia가 투명한 방추형 혹은 원통형인 것으로 기록된 반면[7], 본 연구에서 확인된 분생자는 원 기재문에 기록된 분생자보다 길쭉하며 초승달처럼 휘어지는 형태로 관찰되었다. ITS 영역과 TUB 영역의 염기서열 분석 결과 ITS 염기서열은 D. goulteri MF356583.1과 99%의 일치도를 보였고, LSU 염기서열은 D. goulteri KJ197290.1과 98%의 일치도를, TUB 염기서열은 D. goulteri KJ197270.1과 99%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 2).
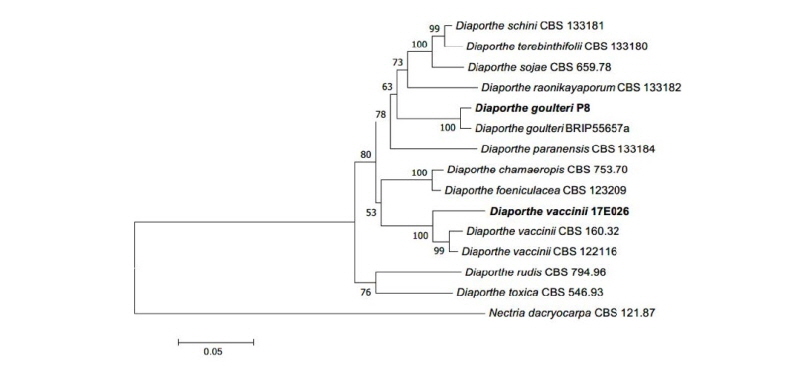
Fig. 2. Neighbor-joining phylogenetic tree based on a combined alignment of internal transcribed spacer, large subunit rDNA, and beta-tubulin rDNA sequences. Nectria dacryocarpa was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Bold letters indicates fungal strains isolated in this study.
Diaporthe vaccini Shear, Technical Bulletin of the U. S. Department of Agriculture 258: 7 (1931)
꽝꽝나무의 잎에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 직경은 45 mm 정도이며 앞·뒷면 모두 전체적으로 흰색을 띠고 균총의 고도는 배지에서 살짝 융기된 형태이다. 중앙부에 비해 가장자리에 균사가 밀집하므로 중앙부는 마치 무색인 것처럼 보인다(Fig. 1B). MEA 배지에서 7일간 배양된 균총의 직경은 45 mm정도이며 색과 형태는 PDA에서 배양된 균총의 형태와 전체적으로 비슷하다(Fig. 1H).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, N33°23'31.8" E126°35'32.1", April 28, 2017, isolated from leaves of Ilex crenata, strain 17E026, NIBRFG0000502329, GenBank No. MK159402.
Notes: D. vaccinii는 1931년 Shear에 의해 최초로 기록된 종이다. 크랜베리(Vaccinium macrocarpon)에서 분리된 것으로부터 종명이 유래되었다[9]. Picea속[10], Phaseolus속[11] 등 다양한 식물에서 내생균으로 분리된 기록들이 존재하며, 항암제로 사용되는 물질인 camptothecin을 분비할 수 있는 것으로 보고되어 있다[12]. ITS 영역과 LSU 영역, TUB 영역의 염기서열 분석 결과 ITS 염기서열은 D. vaccinii KJ739493.1과 99%의 일치도를 보였고, LSU 염기서열은 D. vaccinii AF439630.1과 99%의 일치도를, TUB 염기서열은 D. vaccinii KC843224.1과 99%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 2).
Rhizosphaera pini (Corda) Maubl., Bull. Soc. mycol. Fr.: 171 (1907)
구상나무의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 직경은 10~12 mm 정도이고, 색은 앞면은 올리브색을 띠고 뒷면은 짙은 녹색 혹은 녹갈색을 띤다. 균총의 고도는 배지에 납작하게 붙어 있는 형태이고, 균총의 가장자리는 불규칙하다(Fig. 1C). MEA 배지에서 7일간 배양된 균총의 직경은 14~16 mm 정도이며, 앞·뒷면 모두 검은 빛이 도는 짙은 녹색을 띤다. 균총의 고도는 배지에서 살짝 융기된 형태이고, 균총의 가장자리는 불규칙에 가까운 물결 형태이다(Fig. 1I). 두꺼운 원통형의 분생자경에서 긴 계란형 혹은 타원형의 분생자가 형성되며, 분생자의 색은 연한 황갈색이며 투명하고 크기는 12.5~16.9 × 4.4~4.7 μm 이다(Fig. 1N, O).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, N33°21'44.8" E126°32'24.0", April 21, 2016, isolated from leaves of Abies koreana, strain 16H073, NIBRFG0000502335, GenBank No. MK159396.
Notes: R. pini는 1907년 Maublanc에 의해 Coniothyrium pini Corda에서 수정되었다. 원 기재문에서는 Abies, Pinus, Picea 등의 다양한 속에 속하는 기주 식물의 침엽으로부터 분리된 것으로 기록되었으며[13], 본 연구에서도 Abies속에 속하는 구상나무의 침엽에서 내생균으로 분리되었다. 원 기재문에서는 분생자의 형태에 대해 투명한 타원형(elliptical) 혹은 난형(ovoid)으로 서술했으며[13], 이것은 본 연구에서 확인된 분생자의 특성과 일치한다[12]. ITS 영역과 LSU 염기서열 분석 결과 ITS 염기서열은 R. pini AY183365.1과 99%의 일치도를 보였고, LSU 염기서열은 R. pini KY654326.1과 99%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 3).
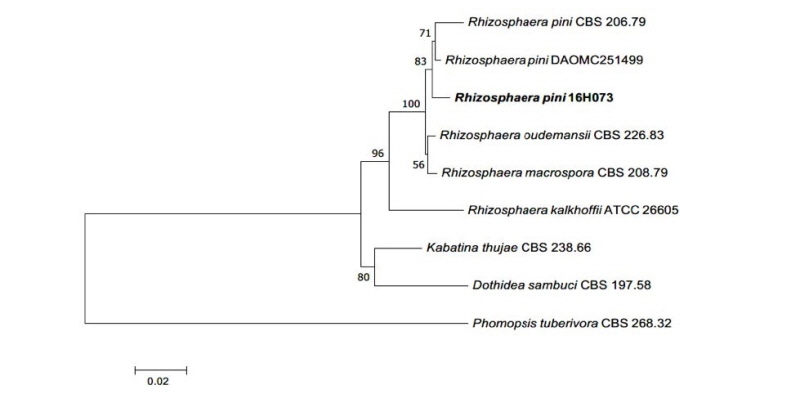
Fig. 3. Neighbor-joining phylogenetic tree based on a combined alignment of internal transcribed spacer and large subunit rDNA sequences. Phomopsis tuberivora was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Bold letters indicates fungal strains isolated in this study.
Valsa friesii (Duby) Fuckel, Jahrbücher des Nassauischen Vereins für Naturkunde 23-24: 198 (1870)
구상나무의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 직경은 32~35 mm 정도이고, 앞뒷면 모두 전체적으로 연한 베이지색을 띠며 시간이 지남에 따라 점점 베이지색이 진해진다. 균총의 고도는 배지에 납작하게 붙어 있는 형태이고, 가장자리는 균사가 구름처럼 흩날리는 형태로 매우 불규칙해진다(Fig. 1D). MEA 배지에서 7일간 배양된 균총의 직경은 31~34 mm 정도이고, 앞면은 중앙부에서 연한 적갈색 혹은 분홍색을 띠고 가장자리는 흰색 혹은 미색을 띠며, 뒷면의 색은 전체적으로 흰색이다. 균총의 고도는 배지에 납작하게 붙어 있는 형태이고, 가장자리에는 조밀한 균사가 방사형으로 뻗어 나가고 있어 entire 형태의 가장자리인 것처럼 보인다(Fig. 1J).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, N33°21'44.8" E126°32'24.0", April 21, 2016, isolated from leaves of Abies koreana, strain 16H342, NIBRFG0000502336, GenBank No. MK159400.
Notes: V. friesii는 1870년 Fuckel에 의해 기록되었다[14]. Valsa에 속하는 종은 침엽수 혹은 관목의 가지에서 주로 분리되는 것으로 보고되며, 기주 식물의 기질(stroma) 속에 자낭각(eprithecia)이 침식되어 서식하는 특성이 있다[15]. V. friesii는 PDA 배지에서 배양될 때 살균성을 가진 물질인 m-cresol을 생산하는 것으로 보고된 바 있다[16]. ITS 영역과 LSU 영역의 염기서열 분석 결과 ITS 염기서열은 V. friesii KM100568.1과 99%의 일치도를 보였고, LSU 염기서열은 V. friesii MH872251.1과 99%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 4).
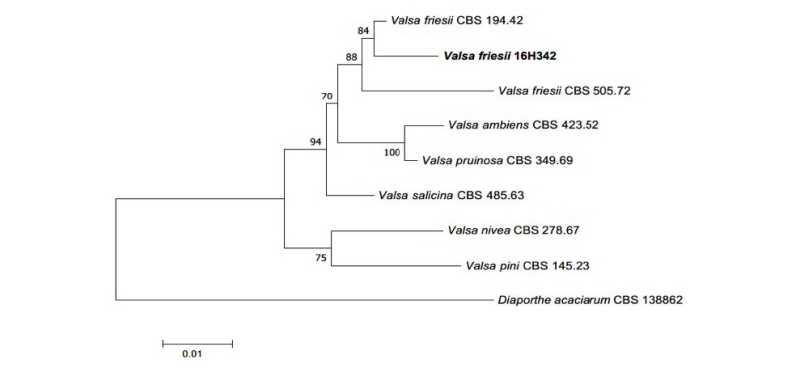
Fig. 4. Neighbor-joining phylogenetic tree based on a combined alignment of internal transcribed spacer and large subunit rDNA sequences. Diaporthe acaciarum was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates. Bold letters indicates fungal strains isolated in this study.
Xylaria primorskensis Y.M. Ju, H.M. Hsieh, Lar.N. Vassiljeva & Akulov, Mycologia 101 (4): 549 (2009)
구상나무의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 직경은 23~27 mm 정도이며, 앞·뒷면 모두 중앙부에서는 연한 갈색을 띠고 가장자리는 흰색을 띤다. 균총의 고도는 배지에서 살짝 융기된 형태이며, 균사가 중앙부에서 가장자리를 향해 방사형으로 뻗어 나가고 있으나 생장 속도가 균일하지 않아 균총의 가장자리는 불규칙한 형태로 확인된다(Fig. 1E). MEA 배지에서 7일간 배양된 균총의 직경은 37~40 mm 정도로 PDA 배지에 비해 매우 빠른 속도로 생장하며, 균총의 색은 앞면은 밝은 흰색을 띠고 뒷면은 진한 상아색을 띤다. 균총의 고도는 배지에 납작하게 붙어 있는 형태이며, 중앙부에서 가장자리를 향해 방사형으로 균사가 뻗어 나가며 간혹 균사가 밀집하여 자라는 부분이 군데군데 확인된다(Fig. 1K). 분생자의 형태는 무색 투명한 반달형 혹은 방추형이고, 크기는 5.5~6.9 × 1.5~2.6 μm 정도이다(Fig. 1P).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, N33°22'11.8", E126°33'27.1", April 18, 2017, isolated from leaves of Abies koreana, strain 17E107, NIBRFG0000502339, GenBank No. MK159401.
Notes: X. primorskensis는 2009년 Y. M. Ju 등에 의해 러시아의 극동 지방에서 최초로 확인된 종이다[17]. 인간 폐암세포에 강한 항암 효과를 보이는 물질인 xylaranic acid를 분비한다는 최근의 연구 결과가 존재한다[18]. 원 기재문에는 분생자에 대해 기술되지 않았으나, 본 연구에서는 분생자의 형태를 확인할 수 있었다. ITS 영역과 LSU 영역의 염기서열 분석 결과 ITS 염기서열은 X. primorskensis KT192367.1과 99%의 일치도를 보였고, LSU 염기서열은 X. primorskensis MG012860.1과 98%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 5).
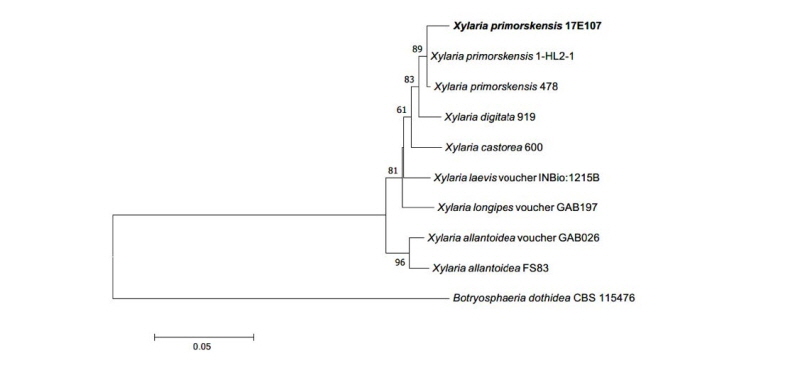
Fig. 4. Neighbor-joining phylogenetic tree based on a combined alignment of internal transcribed spacer and large subunit rDNA sequences. Botryosphaeria dothidea was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Bold letters indicates fungal strains isolated in this study.
Zalerion arboricola Buczacki, Transactions of the British Mycological Society 59 (1): 159 (1972)
구상나무의 침엽에서 분리된 균주이다. PDA 배지에서 7일간 배양된 균총의 직경은 12~14 mm 정도이고, 앞면은 연한 황갈색 혹은 적갈색을 띠고 뒷면은 검은 빛이 도는 어두운 녹색을 띤다. 균총의 고도는 배지에 납작하게 붙어 있는 형태이고 균총의 가장자리는 불규칙하다(Fig. 1F). MEA 배지에서 7일간 배양된 균총의 직경은 11~13 mm 정도이고 앞면은 밝은 크림색을 띠며 뒷면은 전체적으로 검은 빛이 도는 어두운 녹색이고 균총의 가장자리에 얇은 상아색의 띠가 형성된다. 균총의 고도는 중앙부에 기중균사가 밀집하여 배지에서 볼록 융기된 형태이고 가장자리는 불규칙하거나 물결 형태이다(Fig. 1L). 균사 생장 방향의 측면 혹은 절간(internode) 부위에서 분생자경이 형성되는데, 분생자경의 형태는 난형 혹은 타원형이다. 분생자경에서 계란형의 분생자가 형성되며(Fig. 1Q), 대부분은 연쇄상 혹은 포도상으로 붙어 있는 형태로 확인된다. 분생자의 크기는 5.9~9.3 × 3.6~5.5 μm 정도이다(Fig. 1R).
Specimen examined: Mt. Hallasan, Jeju-do, Korea, N33°21'44.8" E126°32'24.0", April 21, 2016, isolated from leaves of Abies koreana, strain 16H107, NIBRFG0000502337, GenBank No. MK159395.
Notes: Z. arboricola는 1972년 Buczacki에 의해 최초로 기록된 종이며, 포자들이 나선형을 이루는 특징이 보고되어 있고 침엽수의 가지에서 분리된 것으로 기록되어 있다[19]. 원 기재문에 기록된 분생자의 형태는 분생자경으로부터 분리되지 않고 서로 뭉쳐 있거나 이어져 있는 형태를 취하는 것으로 기술되어 있고[19], 본 연구에서 관찰된 분생자는 원 기재문의 기술과 일치하는 형태로 확인되었다. ITS 영역과 LSU 영역의 염기서열 분석 결과 ITS 염기서열은 Z. arboricola KU705825.1과 99%의 일치도를 보였고, LSU 염기서열은 Z. arboricola KU705842.1과 99%의 일치도를 보였으며 모두 같은 계통을 형성하였다(Fig. 6).
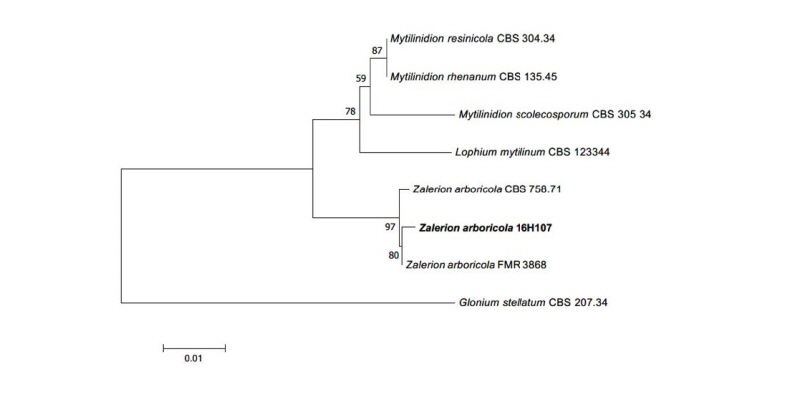
Fig. 4. Neighbor-joining phylogenetic tree based on a combined alignment of internal transcribed spacer and large subunit rDNA sequences. Glonium stellatum was used as an outgroup. Numbers on branches indicate bootstrap values (1,000 replicates). Bold letters indicates fungal strains isolated in this study.
적 요
제주도에 서식하는 다양한 식물의 잎에서 내생균을 분리하였다. 분리된 균주들은 형태적 특성 및 internal transcribed spacer , large subunit rDNA 영역 및 beta-tubulin rDNA 유전자의 염기서열의 계통 분석을 통해 종을 동정하였다. 그 결과 6종의 국내 미기록 내생균을 확인하였고, 확인된 종은 각각 Diaporthe goulteri, Diaporthe vaccini, Rhizosphaera pini, Valsa friesii, Xylaria primorskensis, Zalerion arboricola 이다. 확인된 6종의 미기록 내생균 균주의 형태적 특성 및 염기서열 계통분석의 결과에 대해 기술하였다.

