서론
난초의 종자 발아와 초기 생장에 뿌리에 서식하는 내생균류가 중요한 역할을 한다고 밝혀지면서, 내생균의 군집 및 접종 효과에 관한 연구가 활발히 진행되고 있다[1,2]. 특히 난초과 식물의 뿌리는 난균근균(orchid mycorrhizal fungi), 난내생균(orchid endophytic fungi) 등과 공생관계를 형성하는 것으로 알려져 있다[3]. 균근성인 난균근균은 뿌리 피층에 peloton이라는 코일 형태의 구조물을 형성하며[4], 질소와 인과 같은 무기양분을 토양으로부터 흡수하여 숙주에게 제공한다[2]. 난초 종자의 발아 시 형성되는 원괴체(protocorm)는 땅 속에서 광합성을 할 수 없기 때문에, 유기 탄소의 획득을 난균근균에 의존하는 것으로 알려져 있다[4]. 난초의 분포와 다양성, 풍부도는 주변 서식지 내 상호작용이 가능한 균근성 균류의 존재 유무에 따라 큰 영향을 받을 뿐만 아니라, 그외 난내생균 군집의 다양성에 높은 상관관계를 나타내는 것으로 알려져 있다[5]. 반면 난내생균은 뿌리에 서식하는 비병원성균인데 숙주와의 상호작용과 그 역할에 대해서는 아직 연구가 많이 되어있지 않은 실정이다. 최근 연구에서 난초 뿌리에서 분리된 내생균 Phialocephala fortinii가 지생난인 Dactylorhiza praetermissa의 종자 발아와 유묘의 생장을 촉진시킴이 보고되었다. 이러한 연구 결과를 통해 난초의 초기 생장에 난내생균도 무언가 중요한 역할을 하고 있을 것임을 시사한다[6].
난초과 식물 뿌리에 서식하는 균류와 숙주 사이에 특이성이 있는지에 대한 논쟁은 오랫동안 계속 되어왔다[4]. 난균근균의 경우 관련 연구가 활발히 진행되어 숙주 특이성이 높게 나타난다는 연구결과가 있지만[7,8], 난내생균의 경우 숙주 특이성에 관한 연구는 매우 미미한 실정이다. 특히 본 연구에서 채집한 새우난초 뿌리에 서식하는 내생균류에 대한 국내 연구는 거의 진행된 적이 없으며, 은대난초의 경우도 지역별 차이에 따라 균류의 군집을 비교한 정도의 연구만 진행된 실정이다[9]. 이에 따라 본 연구에서는 환경부 지정 멸종위기 2급 식물로 지정된 새우난초 뿌리를 서로 다른 두 지역에서 채집하고 내생균을 순수분리 하였으며, 은대난초 뿌리 역시 서로 다른 두 지역에서 채집하고 내생균을 순수분리 하였다. 분리된 균주를 대상으로 희귀 난초인 새우난초와 우리나라 전역에 흔히 서식하는 은대난초의 뿌리의 내생균류의 군집 및 다양성을 비교하여 희귀난초 특이적 내생균류가 있는지 확인해 보고자 한다. 이를 통해 희귀 난초의 보존과 복원을 위한 과정에서 공생 내생균류를 활용하는 방안을 마련하고자 한다.
재료 및 방법
시료의 채집 및 내생균류 분리
본 연구에서 새우난초 뿌리는 충남 태안군 안면도(N 36° 49´, E 126° 36´)에서 4개체, 제주도 제주시 조천읍(N 33° 44´, E 126° 56´)에서 4개체를 채집하였으며, 은대난초 뿌리는 충남 가야산(N 36° 50´, E 126° 51´)에서 4개체, 충북 조령산(N 36° 77´, E 128° 04´)에서 4개체를 채집하여 뿌리에 서식하는 내생균류를 순수분리하였다. 채집한 난초의 뿌리는 24시간 이내 균 분리를 실시하였다. 균 분리는 Richardson 등 [10]의 방법을 변형하여 사용하였다. 먼저 외관상 식물병원균에 의한 병증이 없는 뿌리를 흐르는 물로 세척한 후, 70% 에탄올과 3% 차아염소산나트륨(NaClO) 용액으로 차례로 처리하고, streptomycin과 chloramphenicol 용액을 처리하여 표면을 살균하였다. 뿌리 표면의 물기를 제거한 후 약 5 mm 길이로 잘라 4조각을 water agar에 치상하였다. 25℃ 암소에서 배양한 후 균사가 뻗어 나오면 potato dextrose agar (PDA) 배지로 계대 배양하였다. PDA 배지에 계대 배양한 균주는 형태학적 동정을 위해 균총의 색과 모양, 생장 속도, 균사의 형태 등을 육안과 광학현미경(AXIO Imager A1; Carl Zeiss, Oberkochen, Germany)을 통해 관찰하였다.
분자 마커를 이용한 동정 및 군집 분석
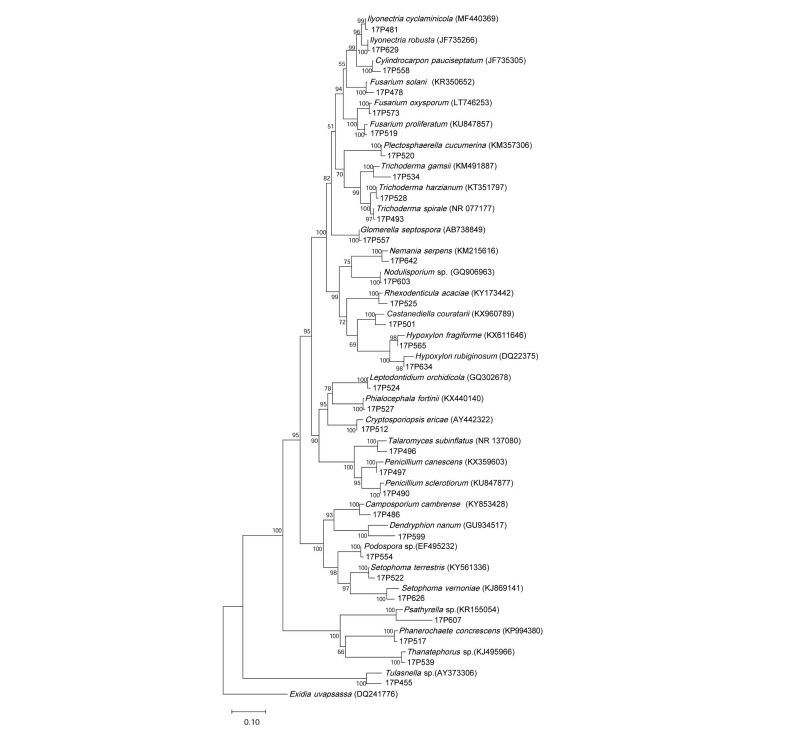
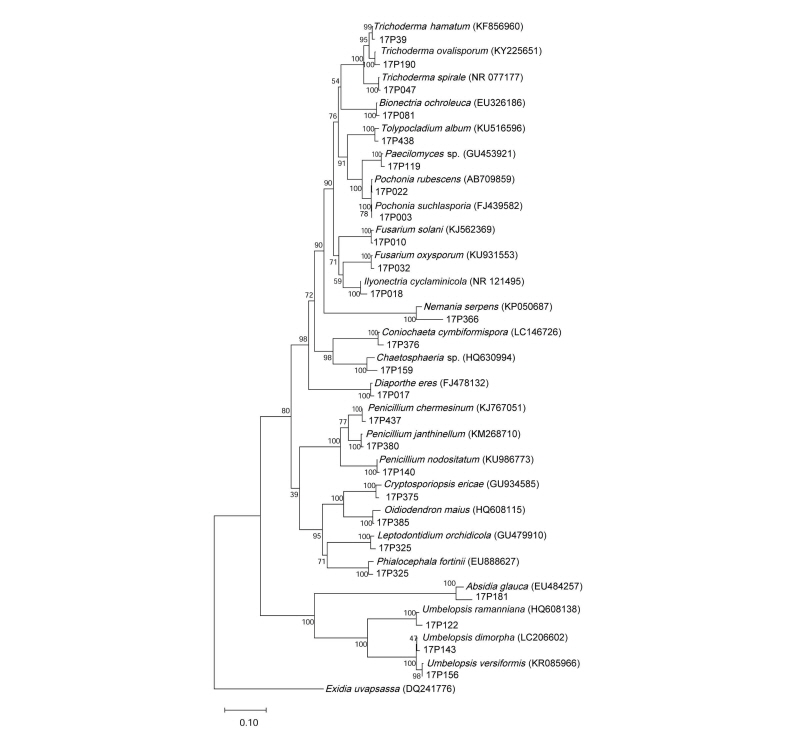
분자생물학적 동정을 위해 순수 분리된 균주의 Genomic DNA를 DNeasy Plant Mini Kit (Quagen, Germantown, MD, USA)를 이용하여 추출하였고, 이 DNA를 주형으로 하여 polymerase chain reaction (PCR)을 진행하였다. PCR 반응 시 균특이적 프라이머인 ITS1F와 ITS4를 사용하여 rDNA 의 internal transcribed spacer (ITS) 부위를 증폭하였다[11]. PCR 조건은 predenaturation 94℃에서 5분 후, denaturation 94℃ 30초, annealing 50℃ 에서 30초, elongation 72℃에서 1분을 1 cycle로 하여 총 30회 진행하였으며, 예상되는 band를 전기영동으로 확인 후 염기서열 분석을 의뢰하였다(SolGent, Daejeon, Korea). 분석된 염기서열은 NCBI 상에서 BLAST하여 similarity를 확인한 후 각 종들 간의 계통을 분석하였다. 계통수 작성을 위해 bootstrap analysis를 통해 1,000 replicates를 선택하고 MEGA6 [12]를 이용하여 neighbor-joining (NJ) tree를 완성하였다.
새우난초와 은대난초에서 분리된 내생균류의 상대수도와 빈도를 구하였으며, 서로 다른 지역 간 내생균류의 유사도지수와 다양성지수(Shannon diversity), 균등도(evenness)를 계산하였으며, 군집 간 종 다양성지수와 종 균등도 등은 SPSS-WIN ver. 12 (SPSS Inc, Chicago, IL, USA)을 이용하여 독립표본 t 검정 분석을 실시하였다.
결과 및 고찰
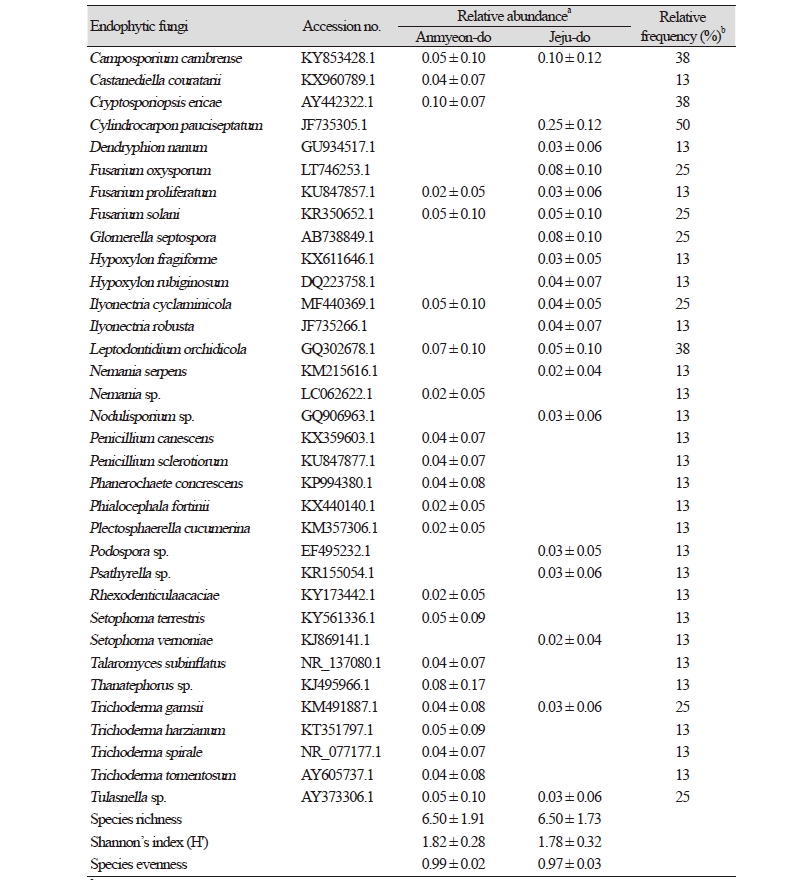
충남 태안군 안면도에서 채집한 4개체의 새우난초의 뿌리에서 152개의 균주를 순수 분리하였으며, 분자생물학적으로 동정한 결과 17속 23종의 서로 다른 내생균류를 확인하였다. 제주도에서 채집한 4개체의 새우난초의 뿌리에서는 168개의 균주가 순수분리 되었으며, 15속 19종의 내생균류를 확인하였다(Table 1, Fig. 1). 서로 다른 두 지역에서 채집한 새우난초의 종 균등도(species evenness)와 종 다양성지수(Shannon’s index, H’), 종 균등도(species eveness)는 유의미한 차이가 없었다(p > 0.05). 균주별로 살펴보면 두 지역 새우난초에서 모두 분리되었고, 높은 상대빈도(relative frequency)를 보인 종은 Camposporium cambrense와 Leptodontidium orhidicola으로 나타났다. L. orhidicola는 난초에 가장 흔히 존재하는 내생균류로 알려져 있으며, 숙주의 뿌리에서 길이생장을 촉진시킨다는 연구결과가 있다. 그외 동정된 균주 중 Phialocephala fortinii는 dark separate endophytes의 일종으로 식물 뿌리 사이에 mycelial connection을 형성하여 광합성 산물을 균사를 통해 운반해 주는 등의 역할을 하는 것으로 알려져 있으며[13], 지생란인 Dactylorhiza praetermissa의 종자 발아와 유묘의 생장을 촉진시켰다는 연구 결과가 있다[6]. 숙주의 질소, 인 등의 무기양분의 흡수 과정을 촉진하는 2종의 난균근균도 발견되었다. Tulasnella sp.는 우리나라 은대난초, 산제비난초 등에서 분리되어 보고된 적이 있으며[9], 지생란에서 가장 많이 발견되는 난균근균 중 하나이다. Thanatephorus sp.는 국내 난초에서 분리된 난균근균 중 처음으로 보고되는 미기록종이며, 국외에서는 Orchis provincialis 등에서 보고되었다[1].
충남 가야산에서 채집한 4개체 은대난초의 뿌리에서 193개의 균주를 순수분리 하였으며, 분자생물학적으로 동정한 결과 16속 23종의 서로 다른 내생균류를 확인하였다. 충북 조령산에서 채집한 4개체를 뿌리에서는 141개의 균주가 순수분리 되었으며, 12속 13종의 내생균류를 확인하였다(Table 2, Fig. 2). 충남 가야산에서 채집한 은대난초에서 분리한 종다양성지수(Shannon´s index, H′)가 충북 조령산에서 채집한 은대난초에서 분리한 내생균류보다 높게 나타났다(p = 0.058). 균주별로 살펴보면 두 지역 은대난초에서 모두 분리되었고 높은 상대빈도(relative frequency)를 보인 종은 Ilyonectria cyclaminicola이다. Ilyonectria속은 인삼 등에서 뿌리 섞음병을 일으키는 병원균으로 알려져 있다[14]. 그 외 분리된 균주 중 Oidiodendron maius은 진달래과 식물에서 공생관계를 형성하는 ericoid mycorrhiza로 알려져 있으며[15], Rhododendron fortune에서 뿌리 내 균근을 형성하며 질소의 흡수를 촉진하는 것으로 알려져 있다[16]. 실험을 통해 추후 종자 발아 및 유묘의 생장을 촉진시키기 위한 내생균류를 순수분리를 통해 다양하게 확보하였다. 가야산 은대난초 4개체, 조령산 은대난초 4개체, 안면도 새우난초 4개체, 제주도 새우난초 4개체의 군집의 유사성을 비교하기 위해 PCA 군집 분석을 실시한 결과, 숙주에 따라 군집의 유사도가 높게 나타났다(Fig. 3). 장소에 관계 없이, 새우난초 8개체에서 분리된 내생균의 군집이 은대난초 8개체에서 분리된 내생균의 군집보다 유사한 특징을 나타내었다. 이를 통해 내생균류의 군집의 차이는 지역적 차이에 의한 영향보다 숙주의 차이에 의한 영향이 더 큰 관계가 있음을 알 수 있다.
희귀난초의 생존과 생장에 밀접한 관계가 있는 내생균류의 확인은 일반 난초보다 희귀 난초가 서식지에서 더 빨리 멸종하는 이유에 대한 중요한 단서를 제공하게 될 것이다. 따라서 희귀 난초와 일반 난초의 뿌리에 서식하는 내생균류의 군집의 다양성 확인은 매우 중요한 기초연구가 될 수 있을 것이다. 희귀난초인 새우난초를 비롯하여, 다양한 난초에 대한 내생균 군집에 대한 연구가 지속적으로 이루어져야 할 것이다.
적요
본 연구에서는 충남, 제주, 경남, 충북 등에서 새우난초(Calanthe discolor)와 은대난초(Cephalanthera longibracteata)의 뿌리를 채취하여 표면살균한 후 내생균을 순수분리 하였다. 분리된 내생균의 형태학 특징을 관찰하고 internal transcribed spacer (ITS) rDNA 영역의 염기서열을 ITS1F와 ITS4 프라이머를 이용하여 분석하였다. 서로 다른 지역에서 채집한 새우난초와 은대난초 이지만, 공통적으로 Leptodontidium orchidcola가 높은 상대수도와 빈도를 나타냈으며, 내생균류의 군집 차이를 분석할 결과, 지역적 차이보다는 숙주에 의한 차이가 더 큰 영향을 미치는 것으로 나타났다.