서론
귀리(Oats, Avena sativa L.)는 중앙아시아지역 원산의 화본과 작물로서 한반도에는 고려시대에 유입된 것으로 추정된다. 1960년대 강원도와 북한지역에서 재배된 기록이 있으나 수확, 도정 등의 문제로 한동안 재배되지 않다가 최근, 보리의 대체작물 혹은 건강기능식품으로서 가치가 인정되면서 정읍, 강진 지역을 중심으로 식용 및 가축 사료용으로 재배되는 면적이 증가하고 있다[1].
귀리에 발생하는 주요 곰팡이 병해는 보리, 밀 등에 주로 발생하는 녹병, 깜부기병, 보리황화위축병, 잎마름병, 붉은곰팡이병 등이 알려져 있다[2]. 특히, 국내에서 발생이 보고되지 않은 Pyrenophora avenae에 의한 귀리 잎마름 및 흑변증상은 전세계적으로 귀리재배지역에서 대부분 보고되고 있다[3]. 국내 귀리에서 발생하는 곰팡이병으로는 관녹병, 줄기녹병, 겉깜부기병, 속깜부기병이 기록되어 있을 뿐 그 외 다른 진균병에 대한 연구는 거의 전무한 실정이다[4]. 본 연구는 2016년 정읍의 한 농가에서 수확하여 보관 중이던 귀리 중 흑변 증상을 보이는 종자로부터 병원균을 분리하여 동정하고, 그들의 유전적 다양성 조사 및 병원성을 검정하였다.
재료 및 방법
귀리 종자 수집 및 및 Pyrenophora sp. 균 분리
수집된 귀리종자를 1% sodium hypochlorite에 2분간 침지하여 표면 소독하였다[5]. 소독된 종자들은 살균수로 2회 세척 후 멸균된 여과지로 물기를 제거한 다음 100개씩 potato dextrose agar (PDA; streptomycin 600 μg/mL)에 올려 놓았다. 25℃ 항온기에서 5일간 배양한 후 단일 colony를 형성한 모든 균총을 PDA에 옮겨 배양하였다. Pyrenophora sp.속 균의 포자형성을 위하여 살균된 oat leaf agar 배지(OLA)상에 올려놓고 균총을 접종한 후 near ultra violet (NUV)를 12시간/1일 조사되는 25℃ 항온기에서 2주간 배양하였다. 형성된 분생포자는 포자현탁액을 조제하여 Water agar에 도말한 후 25℃ 항온기에서 12시간 배양 후 단포자 분리를 실시하였다.
DNA 추출 및 염기서열 분석
Pyrenophora sp. 균주를 PDA 배지에 접종하고, 25℃에서 3~5일간 배양 후 배양 균사체부터 genomic DNA는 Chi 등의 방법[6]을 이용하여 추출하고 −20℃에 보관하면서 실험에 사용하였다. 균 동정 및 유전적 다양성 분석을 위해 internal transcribed spacer region (ITS) rDNA와 glyceraldehydes 3-phosphate dehydrogenase (GPDH) 유전자의 염기서열을 분석하였다. ITS는 ITS1 (5′-TCC GTA GGT GAA CCT GCG G-3′)과 ITS4 (5′-TCC TCC GCT TAT TGA TAT GC-3’) 프라이머[7], GPDH는 gpd1 (5’- 5'-CAA CGG CTT CGG TCG-3’)과 gpd2 (5'-GCC AAG CAG TTG GT-3’) 프라이머를[8] 이용하여 PCR을 실시하였다. 증폭산물은 QIAquick PCR purification kit (Qiagen, Germantown, MD, USA)를 사용하여 정제한 후 염기서열을 분석하였다. 분석된 염기서열은 DNASTAR (Lasergene 8; DNASTAR, Madison, WI, USA)를 이용하여 교정 후, GenBank (accession number MF693022-MF693069, MF537439-MF537486, MH603003 및 MH603004)에 등록하였고, Genbank에 등록된 Pyrenophora sp.속의 염기서열과 상동성 분석을 통하여 균 동정 및 유전적 다양성을 조사하였다. Clustal W 소프트웨어[9]를 이용하여 염기서열을 정렬하였고, 계통수는 MEGA 6.0 프로그램[10]을 사용하여 neighbor-joining법으로 작성하였다.
균학적 특성조사
염기서열 및 계통수 분석을 통해 동정된 P. avenae 균주에 대하여 형태적 특성과 배양적 특성을 조사하였다. 형태적 특성은 앞서 기술한 방법에 따라서 포자를 형성시킨 후 분생포자의 모양과 크기를 조사하였다. 배양적 특성은 각각의 균주를 cork borer (직경 5 mm)로 잘라 새로운 PDA 배지 중앙에 접종한 후, 15℃, 20℃, 25℃, 30℃ 그리고 35℃에서 배양한 후 균사생장, 포자형성 및 균총 특성을 조사하였다[11].
병원성 검정
49개의 Pyrenophora sp. 분리균 중 8개의 균주를 선발하여 귀리에 대하여 병원성 검정을 실시하였다. 선발된 균주는 앞에서 기술된 방법에 따라서 OLA 배지에 포자를 형성시킨 후, hemocytometer를 이용하여 포자현탁액의 농도를 5 ⅹ 105 spores/mL로 조절하였다. 귀리는 온실에서 포트에 파종하여 80일간 재배한 후 개화기 식물체에 분무 접종하였다. 대조구는 동량의 멸균수를 살포하였으며, 실험은 3반복으로 실시하였다. 분무접종 후 식물체는 비닐로 덮고 20℃ 항온기에서 3일간 둔 후 꺼내어 온실에서 유지시키면서 병원성을 조사하였다.
결과 및 고찰
균 분리 및 분자생물학적 P. avenae 동정
정읍의 귀리농가에서 수확 후 도정하여 껍질이 제거된 상태로 보관중인 귀리 종자에서 정상적인 종자(Fig. 1A)와는 다르게 종자표면의 일부 혹은 전체가 갈색이나 흑색으로 변색된 증상을 나타냈다(Fig. 1B). 귀리종자를 표면소독 후 PDA 배지에 치상하여 곰팡이 감염율을 조사한 결과, Pyrenophora sp.속(45%), Alternaria속(15%), Epicoccum속(3%)이 주로 검출되었다(data not shown). 분리된 Pyrenophora sp. 균주의 ITS 부위에 대하여 Genbank 염기서열과의 유사도 분석과 계통수를 작성한 결과, 모든 균주는 두 그룹으로 구분되었다(Fig. 2A). 공시된 49개 균주 중 17OSJe0106과 17OSJe0108 균주를 제외한 47개 균주가 포함된 그룹 1은 호주의 귀리에서 분리된 P. chaetomioides BRIP 10944 균주와 100%의 유사도를 나타냈고, 17OSJe0106과 17OSJe0108 균주를 포함하는 그룹 2는 일본의 귀리속(Avena sp.)에서 분리된 D. avenae CBS 189.29등과 100%의 유사도를 보였다. 두 그룹간의 염기서열 유사도는 99%이며, 5 bp의 염기서열 차이를 나타냈다. 또한, Pyrenophora sp.속의 다른 종들과 ITS 부위 염기서열 유사도는 97% 이하인 것으로 나타났다. 이러한 결과로부터 흑변 증상을 나타내는 귀리에서 분리된 Pyrenophora sp. 균주는 모두 P. avenae (동균이명 P. chaetomioides, 무성세대 Drechslera avenae)로 동정되었다.
종내 유전적 다양성
P. avenae 균주의 종내 유전적 다양성 분석을 위하여 GPDH 유전자 염기서열을 추가 분석하였다. 국내에서 분리된 P. avenae 균주의 GPDH 유전자의 염기서열과 GenBank에 등록된 다른 Pyrenophora sp.종들과 함께 유사도 분석과 계통수를 작성한 결과, 공시된 모든 균주는 P. avenae로 동정되었고, 4개의 유전적 그룹으로 구분되어 ITS보다는 높은 resolution을 확인하였다(Fig. 2B). ITS 계통수에서 그룹1에 속한 47개 균주는 GPDH 계통수에 의해 3개의 그룹으로 세분되었고, 그룹간에 염기서열 유사도는 99~100%, 염기서열은 7 bp의 차이를 나타냈다. ITS 계통수에서 그룹2에 속한 두 균주(17OSJe0106, 17OSJe0108)는 GPDH 계통수 분석에서도 뚜렷하게 다른 그룹으로 구분되었고, 그룹1~3 균주와는 95~96% 의 유사도로 최대 26 bp의 염기서열 차이를 나타냈다. 국내 균주 중 그룹2에 속하는 18개 균주는 Pyrenophora sp. chaetomioides BRIP 10944와 100% 유사도를 나타내었고, 그룹4에 속하는 2개 균주는 D. avenae CBS 189.29와 100%의 유사도를 보였다. 그러나 국내 균주 중 그룹1과 3에 속하는 GenBank에 등록된 외국 균주는 없었다. P. avenae와 Pyrenophora sp. 속의 다른 종들과의 GPDH 유전자 염기서열 유사도는 94% 이하이며, 특히 그룹1~3에 속하는 47개 균주와 비교했을 때 90% 이하의 유사도를 나타냈다. 위의 결과로부터 국내에서 분리된 P. avenae 균주는 유전적으로 4개의 그룹으로 구분되며, 외국에서 보고된 균주가 속해 있는 그룹2와 4뿐만 아니라 속해 있지 않은 그룹1과 3이 존재한다는 것을 확인할 수 있었다.
균학적 특성조사
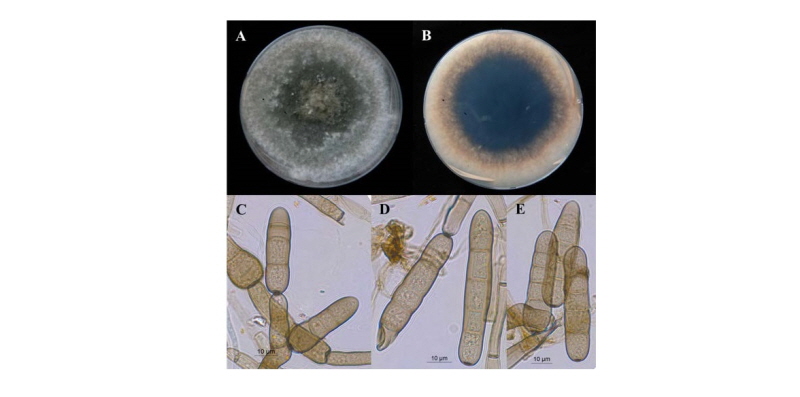
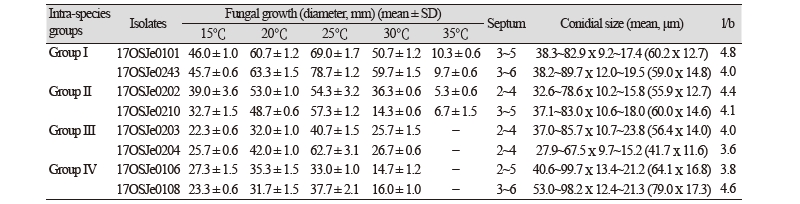
P. avenae의 종내 다양성 분석에 의해 유전적으로 구분되는 4개 그룹에 속하는 대표 균주를 대상으로 형태적, 배양적 특성을 조사하였다. PDA 배지상에서 앞면은 회색~흑색, 표면은 거칠고, 흰색~회색의 큰 균사덩어리(tuft)가 형성되기도 한다. 뒷면은 중앙 부위가 검고, 주변으로 갈수록 올리브~회색~암갈색이고, 일부에서는 tuft로 인하여 흰색이다(Fig. 3A, 3B). 균의 생육은 공시균주 모두 25℃가 최적온도로 나타났으며, 배양속도는 균주 및 온도에 따라 다르게 나타났다(Table 1). 25℃에서 배양속도는 그룹1에 속하는 17OSJe0243 균주가 4.7~11.1 mm/1day로 생육이 가장 빨랐으며, 그룹4에 속하는16OSJe0106, 16OSJe01086 균주가 느리게 생육하는 것으로 나타났다. 그룹3과 4에 속하는 균주는 35℃에서는 생육하지 않았다. 분생자경은 단독이나 그룹으로 발생하고, 대개 원통형으로 직립하거나 굽어있고, 격막이 있으며, 위쪽에서 무릎처럼 굽어있으며(geniculate), 갈색~암갈색이고 정단부로 갈수록 색이 엷어진다. 길이는 1 mm 이하이고, 대개 기부에서 부풀고, 폭은 8~16 µm이다(Fig. 3C, 3D). 분생포자는 대개 단생하며, 연갈색~진갈색, 표면은 매끄럽고, 원통형이고, 굽지 않고 곧으며, 양끝은 둥글고, 대개 2~6개의 pseudosepta를 갖고, 포자 크기는 평균적으로는 41.7~79.0 ⅹ 11.6~17.3 µm(Fig. 3D, 3E)이지만 균주에 따라서 변이가 심하였고, 그룹4에 속하는 17OSJe0106과 17OSJe0108 균주는 다른 균주에 비해 큰 포자크기를 나타냈다. 포자의 기부세포에는 돌출되는 hilum이 없고, 뚜렷하고 납작한 scar를 볼 수 있다. 위의 결과로부터 그룹4에 속하는 균주는 생육속도와 포자크기가 다른 그룹들과 차이가 있다는 것을 확인할 수 있었다. 비록 공시균주간에 형태적, 배양적 특성의 차이가 있음에도 불구하고, 그들의 형태적, 배양적 특성은 Ellis & Walker [10] 및 Sivanesan [11] 에 의해 기술된 P. avenae와 비교적 잘 일치하였다.
병원성 검정
P. avenae의 귀리에 대한 병원성 검정을 실시하였던 바, 공시한 균주는 접종 7일 후 잎과 종실에서 병반 형성이 확인되었다. 잎에서는 초기에 작은 적갈색반점이 형성되며, 반점의 가장자리는 자색이고, 병반 주변부는 황색 달무리(halo)를 형성하였다. 반점은 점차 융합, 확대되어 줄무늬 증상을 나타내며, 심한 경우 고사하였다(Fig. 4A). 종실에서는 받침 껍질(glume)에 적갈색 병반이 형성되었고, 실 모양의 균사가 종실의 표면을 감염하였으며, 황갈색에서 흑색으로 변색되었다(Fig. 4B). P. avenae는 일본, 중국, 호주, 미국, 이탈리아, 남아프리카 등 대부분의 귀리 재배지역에서 발생하며, 잎에 마름, 반점, 줄무늬 증상과 종자 흑변증상을 나타내고, 기주범위는 귀리, 메귀리, 풀귀리 등 귀리속 식물뿐만 아니라 빗살새, 왕김의털, 쥐보리 등 13개 식물에서 보고되어 있다[3]. 미국 남부와 독일의 귀리에 발생하여 최대 30~40%의 피해를 주었으며, 스웨덴과 핀란드에서는 종자전염으로 최대 10%의 손실이 발생한 것으로 보고된 바 있다[12, 13]. 그러나 국내에서는 귀리에서 처음 보고되는 병해로서 “귀리잎마름병”이라 명명할 것을 제안한다.
병원균은 병든 종자나 포장의 기주식물 잔사체에 생존하면서 1차 전염원이 되고, 출수 및 개화기부터 잦은 강우와 높은 습도에서 2차적으로 공기전염하여 확산되는 것으로 알려져 있다[10]. 정읍의 귀리종자에서 P. avenae에 의한 흑변 증상이 심했던 것은 2016년 4월 하순 출수기부터 6월 상순 수확기까지 강우량과 강우일수가 다른 해에 비해 많았던 것이 가장 큰 원인으로 추정되고 있고, 대부분 농가에서 매년 자가채종된 귀리종자를 반복적으로 사용하는 것도 종자전염에 의한 병 발생을 높이는 원인 중 하나로 고려될 수 있다, 세계적으로 작물에 발생하는 Pyrenophora sp.속 종으로는 P. avenae뿐만 아니라 P. dictyoides, P. graminea, P. japonica, P. lolii, P. teres 및 P. tritici-repentis가 보고되어 있다. 따라서 국내 귀리에서는 보리에서 발생이 보고된 줄무늬병균(P. graminea)과 그물무늬병균(P. tere)뿐만 아니라 귀리를 비롯하여 밀이나 보리 등 다양한 기주에서 발생하는 Pyrenophora sp.속 종이 발생할 수 있다. 향후 귀리 재배면적 확대와 더불어 병 발생에 적당한 기상환경이 조성된다면 귀리잎마름병은 큰 피해를 초래할 수도 있기 때문에 병 발생에 대한 모니터링뿐만 아니라 다양한 방제연구가 함께 이루어져야 할 것으로 생각된다.
적요
2017년 1월 정읍의 한 농가 저장창고에서 검게 변한 귀리종자가 발견되었다. 조사된 100개의 종자 중 45개 종자에서 Pyrenophora sp.속 균이 검출되었다. 종자에서 얻어진 모든 균주들은 internal transcribed spacer (ITS) 부위와 glyceraldehyde 3-phosphate dehydrogenase (GPDH) 유전자 염기서열을 기초로 Pyrenophora avenae로 동정되었고, 형태적, 배양적 특성에 의해 확인되었다. ITS와 GPDH 염기서열 기반의 계통수를 통해 P. avenae 균주는 유전적으로 뚜렷한 4개의 그룹으로 구분할 수 있었다. 병원성 검정 결과, P. avenae는 귀리의 종자흑변과 잎마름병을 일으키는 병원균으로 확인되었다. 이것은 한국에서 P. avenae가 귀리잎마름병을 일으킨다는 최초 보고이다.