서론
한국에서 고추는 시설재배로 연중 생산되고 있으며, 노지에서는 5월 중하순부터 재배하여 가을에 수확된다. 최근 매년 전국의 고추 생산량이 감소하고 있는 추세이며, 특히 2007년 이후 재배면적당 생산량이 계속해서 줄어들고 있다. 이러한 고추 생산량 감소의 주요 원인으로 기후 변화에 따른 병해충의 증가를 들 수 있는데 특히 탄저병에 의한 피해로 고추의 생산량이 10~80%까지 감소할 수 있다고 보고 되었다[1]. 고추는 진균병해 외에도 여러 해충의 위험에도 노출되어 있다. 그 중 총채벌레(Thrips palmi)는 고추뿐 아니라 시설재배 오이, 멜론 등 과채류에서 문제가 되는 해충으로 약충과 성충이 식물의 잎, 꽃, 줄기는 물론이고 열매까지 가해한다. 특히 개화 전에는 주로 신초를 가해하여 기형 잎 또는 황화현상을 일으키고, 개화 후에는 꽃을 가해하여 기형과를 형성, 상품성을 떨어뜨려 피해를 입히는 해충으로 알려져 있으며, 세계적으로 최소 12종의 총채벌레가 경제적 피해를 주는 것으로 보고되어 있다[2]. 이러한 병과 해충을 방제하기 위해 이용되는 화학 살충, 살균제의 과도하고 지속적인 사용으로 인해 이에 대한 저항성이 발생하여 방제가 더욱 힘들어지고 더불어 환경오염이 초래되고 있다.
따라서 이러한 문제들을 해결하기 위한 다양한 시도가 이루어지고 있는데, 그 중 생물적 방제제가 가장 주목 받고 있으며 그에 대한 연구 개발이 전 세계적으로 활발하게 이루어지고 있다[3]. 생물적 방제제 중 해충을 안전하게 방제할 수 있는 방법으로 곤충병원성 미생물에 대한 활발한 연구개발이 이뤄지고 있다. 특히, 최근에는 곤충병원성 곰팡이의 살충제로서의 기능뿐만 아니라 생장 촉진제 등 다양한 역할의 보고에 따라 그에 대한 연구 개발이 더욱 활발히 이루어지고 있다[4].
곤충병원성 곰팡이는 대부분 불완전균류의 Hyphomycetes에 속하는 곰팡이로 사람과 동물, 식물에는 무해하나 곤충에만 특이적으로 병원성을 가진다[5]. 곤충의 섭식에 의해 감염되는 곤충병원성 바이러스 및 세균과는 달리 곤충병원성 곰팡이는 곤충과의 접촉에 의해 감염이 시작되고 물리 화학적으로 표피를 침투하여 기주 곤충의 면역작용을 차단, 독성물질을 분비하여 곤충을 죽인다[6]. 또한 감염된 곤충병원성 곰팡이는 기주 곤충의 혈강 내에서 대량 번식하여 기주 곤충의 영양분을 고갈시켜 사망에 이르게 하고 기주 곤충의 치사 후에는 죽은 곤충의 표피에서 포자를 형성하여 2차 감염원으로 작용하는 장점을 가진다. 이러한 곤충병원성 곰팡이는 현재 약 85속 750여종이 알려져 있으며 가장 일반적으로 이용되고 있는 균으로는 Isaria, Metarhizium, Beauveria, Verticillium (=Lecanicillium), Nomuraea, Entomophthora, Neozygites등을 들 수 있다[3, 7].
본 연구에서는 고추 탄저병과 총채벌레의 친환경 동시 방제를 위해 국내 토양에서 분리한 곤충병원성 곰팡이를 이용하여 고추 탄저병균 Colletotrichum acutatum과 오이총채벌레에 살균, 살충효과가 있는 미생물을 선발하여 방제효과를 검정하는 실험을 수행하였다.
재료 및 방법
실험곤충 및 작물
본 실험에 사용된 오이총채벌레는 국립농업과학원 작물보호과 실험실에서 분양받아 3엽기 오이화분을 공급하여 온도 25℃, 광조건 16L:8D, 상대습도 70 ± 5% 조건에서 누대 사육하였다. 실험을 위한 작물로 오이와 고추가 사용되었다. 오이(Joeunbaefdadagioi, Farmhangnong, Seoul, Korea)와 고추(Big Star, Nongwoo Bio, Suwon, Korea)를 자연광 하의 온실에서 검은 화분(분갈이용 화분, 12 cm)에 원예용 상토(Balokeo; Seoul Bio, Eumseong, Korea)로 파종하여 4~5엽기 유묘를 생물검정에 사용하였다.
미생물
선행연구에서 토양에서 분리된 곤충병원성 곰팡이[8]와 국립농업과학원 유기농업과에서 분양받은 고추 탄저병원균(Colletotrichum acutatum)을 감자한천 배지(potato dextrose agar, PDA)에 도말하여 분생포자를 분리 후 10% 글리세롤 용액에 넣어 −80℃에서 보관하였다. 우수 균주 선발을 위해 곤충병원성 곰팡이 13균주는 PDA에 접종하여 25 ± 1℃, 14일간 배양하여 형성된 분생포자를 실험에 사용하였다.
살충효과 생물검정
생물검정을 위해 PDA 배지에 2주간 배양한 포자가 형성된 배지에 5 mL의 멸균된 0.02% Tween 80 용액을 넣고 유리막대로 표면을 긁어 포자를 회수한 후 거즈로 걸러 hemocytometer를 이용하여 계수하고 필요한 농도의 포자현탁액(1 × 107 conidia /mL)을 제조하였다. 1차 생물검정은 오이 총채벌레 성충 10마리가 투입된 직경 50 mm의 오이 잎 절편에 포자현탁액을 살포하여 실시하였다. 포자현탁액 500 μL를 Plexyglass 스프레이 타워(100k PA, 직경 1.5 mm의 polyvinyl acetal cone nozzle, 스파맥스 TC-620X 패키지(Compressors +DH-103 Airbrush; Sparmax, Taipei, Taiwan)를 이용하여 오이 잎의 앞, 뒷면에 살포한 후 상온에서 30분 동안 건조하고 25 ± 1℃, 광조건 16L:8D, 습도 90% 이상으로 5일간 유지하며 매일 사충 수를 관찰하였다. 1차 선발 균주에 대한 2차 생물검정은 오이 총채벌레 약충(부화 후 10일, 2령)을 접종한 semi-pot 형태의 오이 잎을 이용하여 실시하였다. 50 mL 플라스틱 컵에 멸균수를 적신 솜을 채워 넣은 후 직경 80 mm가 되는 오이 잎의 잎자루을 꽂아 실험에 사용하였다. 1 mL의 포자현탁액을 오이 잎의 앞, 뒷면에 각각 살포한 후 상온에서 30분 동안 건조한 뒤, 오이총채벌레 약충 10마리를 접종하여 25℃, 광조건 16L:8D, 습도 90% 이상으로 5일간 유지하며 매일 사충 수를 관찰하였다. 사충은 붓으로 접촉하였을 경우 움직임이 없으며 곰팡이의 포자가 발생한 개체를 계수하였다. 대조구는 0.02% Tween 80 용액만을 처리하였다. 생물검정은 2회 수행되었으며 매 실험마다 3반복으로 수행하였다.
대치배양
고추 탄저병원균에 대한 길항 균주 선발을 위해 대치배양(dual culture)을 실시하여 선발 균주의 식물병원균에 대한 균사생장억제 효과를 확인하였다. 대치배양을 위해 PDA(Difco, Detroit, MI, USA) 배지에서 2주간 배양하여 포자가 형성된 고추 탄저병원균과 곤충병원성 곰팡이의 균총을 직경 5 mm의 cork borer로 떼어내어 실험에 사용하였다. 새로운 PDA 배지의 가운데에 고추 탄저병원균을 치상하고 병원균을 중심으로 양쪽 2.5 cm의 간격에 곤충병원균을 각각 치상하여 25℃에서 배양하며 7일 후 고추 탄저병원균에 대한 곤충병원균의 균사생장 억제율을 조사하였다. 대치배양은 1회, 3반복 수행하였다.
염기서열분석
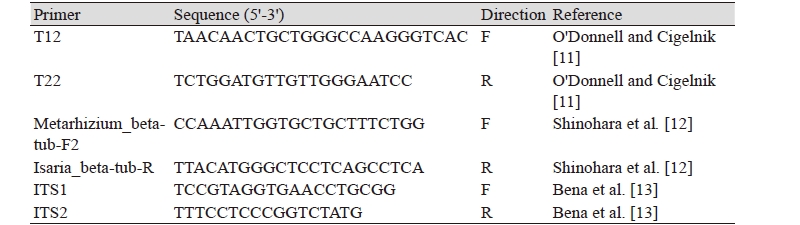
곤충병원성 곰팡이의 genomic DNA 추출을 위해 PDA에서 2주간 배양한 곰팡이 균체에 fungal DNA extraction buffer [0.2M Tris-Cl; pH 7.5, 0.5M NaCl, 10mm EDTA; pH 8.0, and 1% SDS(w/v)]와 phenol-chloroform-isoamyl alcohol (25:24:1)을 처리 한 후 원심 분리하여 DNA를 정제하였다. 정제된 DNA 용액은 냉 에탄올을 이용하여 침전시키고 원심분리 한 후 멸균 증류수에 녹여 실험에 이용하였다. 분리 균주의 분자생물학적 동정을 위해 ITS1, ITS2, Metarhizium_beta-tub-F2, Isaria_beta-tub-R, T12, T22 primer (Table 1)를 사용하여 internal transcribed spacer (ITS1-5.8S-ITS2) 부분과 β-tubulin 부분을 PCR 증폭하였다. PCR 증폭산물은 1.0% agarose gel을 이용하여 전기영동 후 Power Gel Extraction Kit (Dyne Bio, Sungnam, Korea)를 이용하여 정제하였다. 정제된 PCR산물의 염기서열 분석은 제노셀에 의뢰하였고, 그 결과를 DNA Star Seqman을 이용하여 배열하여 MEGA6 프로그램 내의 neighbor-joining 방법을 사용하여 계통분석 및 계통도를 구축하였다[9-13].
형태학적 관찰
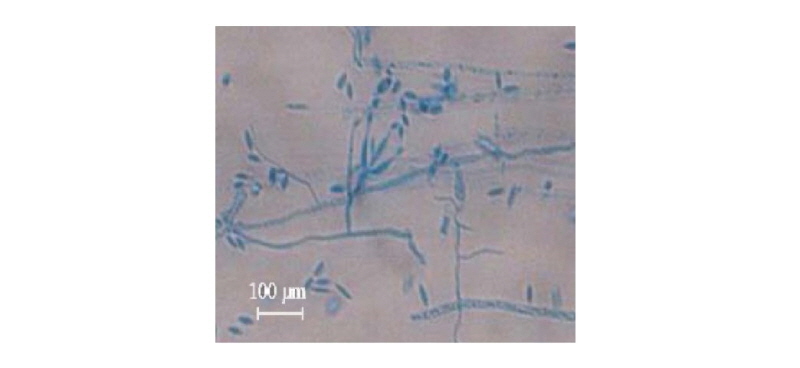
분리 균주의 형태학적 관찰을 위하여 slide grass culture방법을 이용하였다[14]. PDA에서 3~4일간 배양된 균체를 2% water agar위에 놓인 두 장의 멸균 커버슬라이드(지름 22 × 30 mm) 사이에 놓고 25℃에서 7일간 배양 후 위상차 현미경(DE/MZ-12, 400×; LEICA, Microsystems, Wetzlar, Germany)을 이용하여 균사 및 포자의 형태를 관찰하였다.
살균효과 생물검정
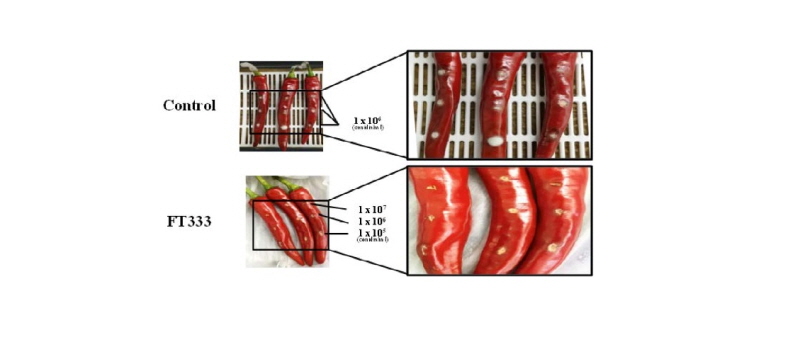
대치배양을 통해 1차적으로 선발된 균주의 고추 탄저병 방제 효과를 검정하기 위해 고추 열매를 이용하여 생물검정 하였다. 고추는 물로 세척한 후 1% 락스에 30초간 침지한 후 70% 에탄올로 표면을 소독하고 건조시켜 준비하였다. 생물검정을 위해 PDA 배지에 2주간 배양한 포자가 형성된 배지에 5 mL의 멸균된 0.02% Tween 80 용액을 넣고 유리막대로 표면을 긁어 포자를 회수한 후 거즈로 걸러 hemocytometer를 이용하여 계수하고 필요한 농도의 포자현탁액(1 × 105, 1 × 106, 1 × 107 conidia /mL)을 제조하였다. 고추 열매 3곳에(위, 중간, 아래) 소독한 핀으로 상처를 내고 10 μL의 탄저병원균 현탁액(1 ⅹ 105 conidia/mL)을 접종한 후 30분간 실온에서 건조시킨 뒤 선발 곤충병원성 곰팡이의 포자현탁액(1 × 105, 1 × 106, 1 × 107 conidia /mL)을 10 μL씩 접종하였다. 접종한 고추 열매는 멸균수에 적신 티슈가 깔린 플라스틱 용기에 넣고 25 ± 1℃에서 14일 동안 저장하며 발병도를 조사하였다. 대조구는 탄저병원균이 처리된 고추 열매에 0.02% Tween 80용액을 처리하였다. 모든 실험은 3회 수행되었으며 매 실험마다 3반복으로 수행하였다.
결과 및 고찰
살충효과
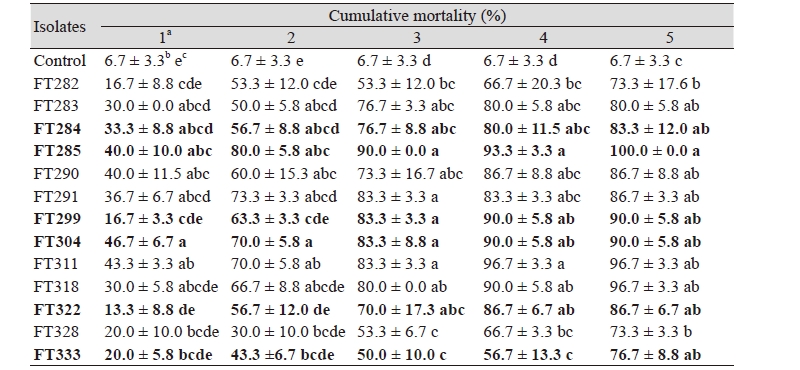
총채벌레 성충에 살충효과가 우수한 곤충병원성 곰팡이를 선발하기 위해 잎 절편을 이용한 생물검정을 실시한 결과 Table 2에서 볼 수 있는 것과 같이 처리 후 5일차에 13균주 모두 70% 이상의 살충률을 나타내는 것을 확인할 수 있었다. 그 중 살충효과와 포자의 색상과 모양을 기반으로 구분된 종의 다양성을 고려하여 FT284, FT285, FT299, FT304, FT322, FT333 균주를 1차 선발하였다. 선발한 6 균주의 총채벌레 성충에 대한 방제효과는 처리 5일째 83.3 ± 12.0%, 100 ± 0.0%, 90.0 ± 5.8%, 90.0 ± 5.8%, 86.7 ± 6.7%, 76.7 ± 8.8%였다(Table 2).
잎 절편을 이용한 생물검정 결과로 1차 선발된 균주의 오이 총채벌레 약충에 대한 방제효과를 semi-pot형태의 오이 잎을 이용하여 검정한 결과 처리 5일째 FT284, FT285, FT299, FT304, FT322, FT333 균주의 살충률은 91.7 ± 3.1%, 78.3 ± 5.4%, 90.0 ± 2.8%, 71.7 ± 5.4%, 60.0 ± 0.0%, 70.0 ± 5.8%였다(Fig. 1).
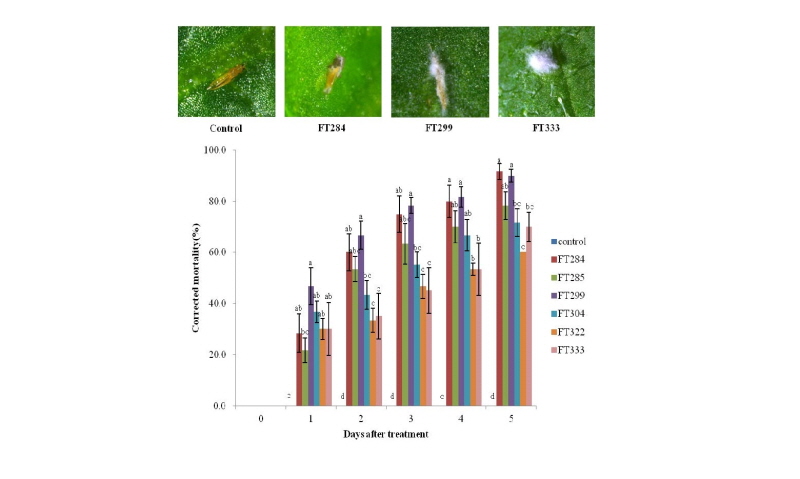
Fig. 1. Control efficacy of first selected isolates against juvenile of thrips. Control was treated with 0.02% Tween 80 (mean ± SE). Spores were observed in the mu㎜ies after bioassay. Data were analyzed using ANOVA (p < 0.001), and the differences were further elucidated using DUNCAN’s multiple range test. Different letters indicate significant differences at p < 0.001 at each time point
포자현탁액 처리 후에 사멸한 오이총채벌레의 약충은 2~3일 후 미이라처럼 딱딱한 형태로 굳어졌으며, 체내에 침입하여 발아된 균사가 오이총채벌레의 표피를 뚫고 나와 충체의 표면이 하얀색의 균사로 완전히 뒤덮였다. 사멸 후 3일 후부터 FT333 균주 처리구는 점차 회색의 포자를 형성하는 전형적인 Isaria 균주의 포자색상을 나타냈고 FT333 균주를 제외한 나머지 5균주들은 하얀색이던 침입 균사의 포자가 어두운 녹색으로 변하기 시작하여 5일후에는 Metarhizium 특유의 색상을 나타내었다.
고추 해충으로 담배나방 등 25종이 보고되어 있으며(KSPP, 1986) 주로 담배나방 등에 대한 생태와 방제 연구가 많이 이루어져왔지만 총채벌레에 관한 연구는 미진한 상황이다. 국내에서의 총채벌레에 대한 연구는 1993년 오이총채벌레와 꽃노랑총채벌레가 국내에 침입한 이후 시설재배작물에서의 총채벌레에 대한 생태, 피해 및 방제방법에 대한 연구가 이루어졌다[15-18].
Ekesi 등[19]의 연구에서 병원성 곰팡이 M. anisolpiae의 총채벌레 방제효과를 확인한 결과 1 × 1011 conidia ha-1의 농도로 처리했을 때 51.6%, 1 × 1013 conidia ha-1의 처리구에서 64.1%의 살충률을 나타내었고, Wraight 등[20]의 결과에서는 Beauveria bassiana와 M. brunneum을 총채벌레에 1.25×108, 4.85×107, 4.75×107 conidia/mL의 농도로 처리했을 때 87~90%, 66%, 73%의 방제효과를 나타냈다. 따라서 본 연구에서 선발한 I. javanica FT333 균주는 다른 연구결과에서 보고된 균주보다 낮은 농도에도 총채벌레의 약충과 성충을 효과적으로 방제하는 것을 확인 할 수 있었다.
살균효과
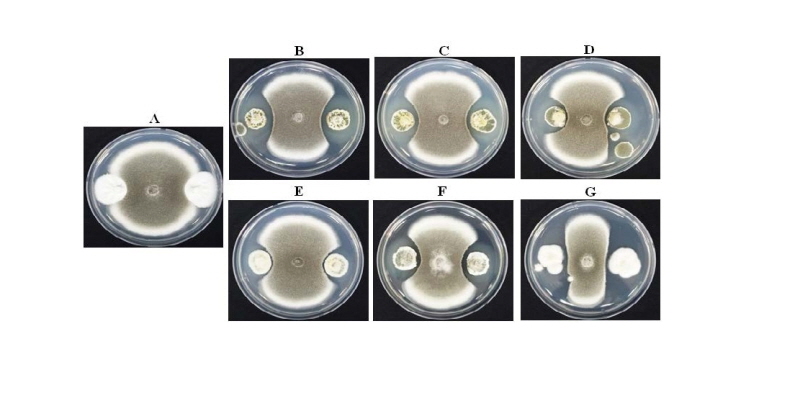
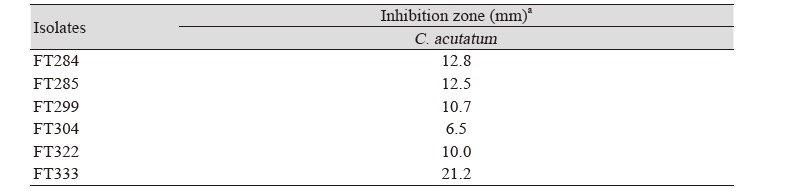
총채벌레에 우수한 살충효과를 가지는 선발 6균주의 고추 탄저병원균(Colletotrichum acutatum)에 대한 항균활성은 대치배양을 통하여 조사되었다. 선발된 6균주에 의해 고추 탄저병원균이 저해되는 정도를 측정한 결과는 Fig. 2와 같다. 대조구의 경우 탄저병원균의 균사가 PDA 배지를 모두 뒤덮었지만 선발된 FT284, FT285, FT299, FT304, FT322, FT333 균주와 대치배양한 탄저병원균의 균사생장이 억제됨을 확인할 수 있었다. 분리 균주 FT284, FT285, FT299, FT304, FT322, FT333에 의한 고추 탄저병균의 균사생장 억제 길이를 측정한 결과(Table 3), 각각 12.8 mm, 12.5 mm, 10.7 mm, 6.5 mm, 10.0 mm, 21.2 mm의 균사생장이 억제되는 것을 알 수 있었다. 이 중 고추 탄저병원균에 대하여 가장 우수한 항균효과를 나타내는 FT333 균주를 최종적으로 선발하였다.
분자생물학적 및 형태학적 동정
최종 선발된 FT333 균주의 분자생물학적 동정을 위하여 ITS 염기서열을 NCBI BLASTN을 이용하여 분석한 결과 Isaria fumosorosea B3(MH414514), I. javanica B2 (MH414513) 균주와 99% 상동성을 나타내었고 β-tubulin 염기서열을 NCBI BLASTN을 이용하여 동정한 결과 I. javanica CHE-CNRCB 307 (KT225606), CHE-CNRCB 324 (KT225602), I. fumosorosea Pfr 97 (EF429306), If116 (JN170102) 균주와 99% 상동성을 나타내었다. 이에 MEGA6 프로그램을 이용하여 ITS (MK212940)와 β-tubulin의 염기서열을 종합하여 계통도를 그린 결과(Fig. 3) I. javanica와 높은 상동성을 나타내었다. 최종 선발 균주 FT333의 형태학적(Fig. 4) 및 분자생물학적 동정 결과를 통해 FT333 균주를 최종적으로 I. javanica로 동정하였고, I. javanica FT333으로 명명하였다. Isaria 균주는 B. bassiana, M. anisopliae와 같이 곤충에 병원성을 가지는 대표적인 곰팡이 중 하나로서 노린재목을 중심으로 전세계적 다양한 해충을 방제하기 위한 살충제로서 사용되고 있다[21].
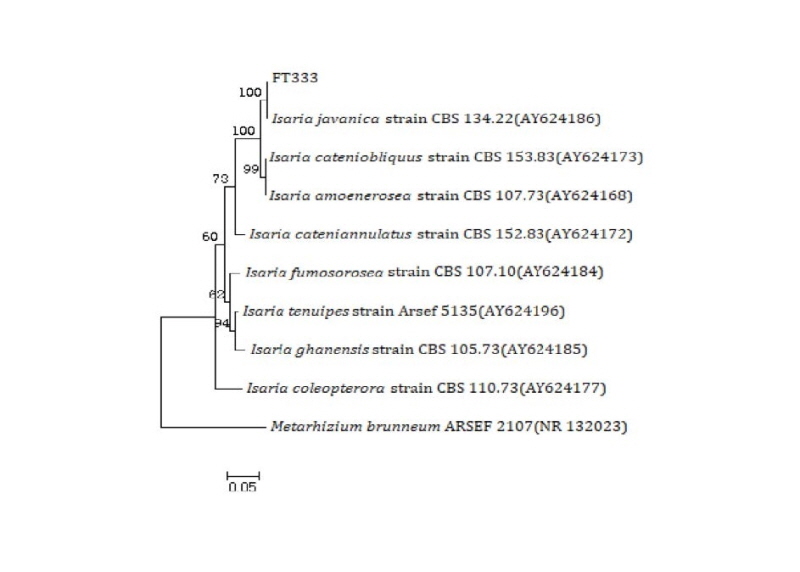
Fig. 3. Phylogenetic tree based on the internal transcribed spacer rDNA and partial β-tubulin gene sequences of isolate FT333 and the type strains of Isaria species. The tree was constructed using the neighbor-joining method and Kimuras two-parameter model. The percentage of replicate groupings in which the associated taxa clustered together in the bootstrap test (500 replicates) is shown above the branches. A sequence from Metarhizitum brunneum is used as an outgroup. ARSEF, Agricultural Research Service Collection of Entomopathogenic Fungal Cultures (Ithaca, NY, USA); CBS, Central Bureauvoor Schi㎜elcultures (Utrecht, The Netherlands). Scale bar = 0.05 substitutions per nucleotide position
고추 탄저병 방제 효과
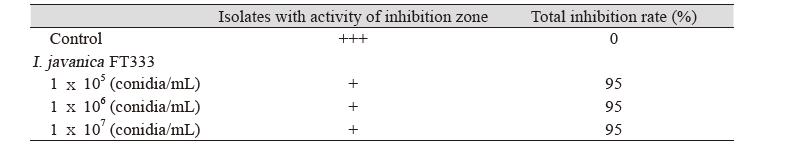
I. javanica FT333의 고추 탄저병에 대한 방제 효과를 검정하기 위하여 고추 열매를 이용한 기내실험을 진행한 결과는 Fig. 5와 같다. 고추 탄저병균만 접종한 대조구는 고추의 90% 이상에 병반이 관찰되었으나 최종 선발 균주 I. javanica FT333 처리구에서는 모든 처리 농도에서 5% 미만의 병반이 관찰되어 95.0% 이상의 방제효과가 있음을 확인할 수 있었다(Table 4).
Yun 등[4]의 논문에 따르면 B. bassiana, M. anisopliae의 배양여과액을 복숭아혹진딧물에 처리했을 때 처리 5일차에 75~80% 살충률을 나타냈고 잿빛곰팡이균과 대치배양한 결과 5.2 ± 0.3e mm, 1.0 ± 0.0bc mm 의 저지원을 나타낸 것으로 곤충병원성 곰팡이의 해충에 대한 살충효과 뿐 아니라 식물병 방제에 대한 가능성을 확인하였다. 본 연구에서 선발한 곤충병원성 곰팡이 I. javanica FT333 역시 오이 총채벌레에 대한 우수한 살충효과뿐 아니라 고추 탄저병에 대해 95.0%의 우수한 방제효과를 나타냈다.
Kang 등[22]에 따르면 고추탄저병에 대해 항균활성을 가지는 Bacillus sp.(1 ×108 cfu/mL) 처리에도 불구하고 고추 탄저병반은 형성되었으며 대조구에 비해 병반의 확대가 억제되는 결과를 나타내었다. 본 연구에서는 선발 I. javanica FT333균주를 1 × 105 conidia/mL의 낮은 농도로 처리하였음에도 고추 탄저병반 형성을 억제하는 결과를 나타내어 단일 항균활성 균주인 Bacillus sp.보다 우수한 항균효과를 나타냄을 확인할 수 있었다. 따라서 이러한 결과들을 바탕으로 I. javanica FT333 균주(KACC no. 93316P)는 고추 탄저병과 미소해충인 오이총채벌레의 동시 방제에 대한 미생물제제로서 유용하게 활용될 수 있을 것으로 생각된다.
적요
고추의 주요 병해충인 총채벌레(Thrips palmi)와 탄저병(Colletotrichum acutatum)을 방제하기 위해 다양한 화학농약이 사용되고 있지만, 농약의 오남용으로 인하여 이에 대한 저항성이 발생하여 방제가 힘들어지고 환경오염을 초래하는 문제가 있다. 그리하여 본 연구에서는 이러한 문제를 극복하고자 총채벌레에 대한 살충효과와 탄저병에 항균력이 우수한 균주를 선발하여 동시 방제의 가능성을 확인하고자 하였다. 토양으로부터 분리한 곤충병원성 곰팡이 13균주(1 × 107 conidia/mL)를 오이총채벌레 성충과 약충에 처리하여 70~100%의 우수한 살충률을 나타내는 6균주를 선발하였다. 선발한 6균주의 항균활성을 검정하기 위하여 고추 탄저병균에 대치 배양한 결과, 항균력이 우수한 FT333 균주를 최종 선발할 수 있었다. 최종 선발된 균주의 형태학적 조사와 internal transcribed spacer, β-tubulin 영역의 염기서열 분석을 통하여 Isaria javanica로 동정하였고, I. javanica FT333으로 명명하였다. I. javanica FT333 (KACC 93316P)의 고추 탄저병균에 대한 방제 효과를 기내에서 검정한 결과(1 × 105, 1 × 106, 1 × 107 conidia/mL) 95% 이상의 방제효과를 나타내었다. 이러한 결과들을 바탕으로 I. javanica FT333 균주가 고추 탄저병균과 미소해충인 오이총채벌레를 동시에 방제하기 위한 미생물제제로서 이용될 수 있는 가능성을 제시하였다.