서론
생물발광(bioluminescence)이란 효소에 의한 산화반응의 결과로 생물체 내에서 빛이 방출되는 현상을 말한다. 생물발광은 세균이나 단세포성 조류를 비롯하여 곤충이나 어류, 강장동물 그리고 균류 등 다양한 생물에서 보고되었다[1-5]. 비록 생물마다 발광의 원인 물질들은 다르지만 생물발광을 일으키는 반응의 원리는 서로 유사하다. 루시페라아제(luciferase)로 불리는 특정 효소가 루시페린(luciferin)으로 통칭되는 특정 기질을 산화하여 불안정한 고에너지 중간체를 만들고, 이 중간체가 분해되면서 빛이 방출되는 것이다[1]. 한편, 각 생물마다 루시페린의 구조가 다르고 루시페라아제의 아미노산 서열 간에 상동성이 발견되지 않았다. 따라서 독립적인 진화를 통해 자연계의 다양한 생물들이 빛을 내는 기작을 획득한 것으로 추정된다[1].
균류에서는 약 80여 종에서 생물발광 특성이 보고되었고[6], 대부분은 담자균문 주름버섯목에 속하는 버섯이다[5,7]. 이들은 뽕나무버섯속(Armillaria)이 속한 Armillaria 계통, 솔밭버섯속(Omphalotus)과 Neonothopanus속이 포함된 Omphalotus 계통, 애주름버섯속(Mycena), 부채버섯속(Panellus), 점질버섯속(Roridomyces)속이 포함된 Mycenoid 계통, 그리고 Mycena lucentipes와 Gerronema viridilucens 두 종이 포함된 Lucentipes 계통으로 구분된다[7,8].
균류의 생물발광 기작은 세균과 달리 오랜 연구에도 불구하고 밝혀지지 않았으나, 최근 10년동안 해당 분야 연구에 많은 진전이 있었다. 균류의 루시페린 및 루시페린의 생합성 기작, 그리고 이와 관련된 유전자들이 구명된 것이다[9-12]. 균류의 루시페린은 3-hydroxyhispidin으로 밝혀졌으며, 이 물질은 히스피딘(hispidin)이 히스피딘 수산화효소(hispidin-3-hydroxylase)에 의해 수산화되어 만들어진다[9-12]. 만들어진 3-hydroxyhispidin은 균류 특이적 루시페라아제에 의해 산화되어 고에너지 중간체를 거쳐 약 530 nm 파장의 녹색 빛을 방출하게 된다[11]. 위에서 서술한 네 계통의 생물발광 균류에서 이와 같은 기작이 공통적으로 존재하는 것으로 보고되었다[7,12].
한편, 화경버섯은 위장 자극을 일으키는 독버섯의 일종으로, 자실체의 형태가 느타리버섯과 유사하여 중독사고를 일으킬 수 있기에 특히 주의가 필요하다. 화경버섯에서 존재하는 독성물질로는 일루딘 S (illudin S)라는 테르펜 (terpene)계열의 화합물이 밝혀졌다[13,14]. 이 물질은 다른 솔밭버섯속(Omphalotus)의 독버섯들에서도 발견되며, DNA 알킬화 기작을 통해 암세포에 높은 세포독성을 나타낸다[15,16]. 이러한 특성을 기반으로 일루딘 S로부터 이로풀벤(irofulven)이 반합성되었고, 새로운 항암제로 임상실험이 승인되기도 했다[17-19].
화경버섯의 또 다른 중요한 특성은 한국에 자생하는 대표적인 생물발광 버섯이라는 점이다. 한국에서는 경기도 광릉에서 처음 보고되었으며[20], 최근에는 개체수 감소로 인해 멸종위기 야생생물로 지정되었다. 화경버섯 균사의 생물발광은 1992년에 발표된 바 있는데, 해당 연구에서 단핵균사에 비해 이핵균사의 생물발광이 높다는 특성이 기술되었다[21]. 그러나 그 밖의 특성에 대해서는 아직까지 알려지지 않았다. 이에 본 연구에서는 한국에서 채집한 화경버섯의 균사를 이용하여 생물발광을 확인하고, 나아가 기계적 스트레스 및 온도 스트레스에 따라 균사의 생물발광이 어떻게 변화하는지 살펴보았다.
재료 및 방법
균주 및 배양
실험에는 국립산림과학원 균주보존실에서 potato dextrose agar (PDA; BD Dfico, MD, USA) 사면배지에 4℃로 보존되어 있는 화경버섯 균주(NIFoS 5378)를 사용하였다. 해당 균주는 2019년 경기도 포천 국립수목원에서 채집한 자실체로부터 분리되었다. 보존된 균주는 PDA 평판배지에 계대하여 25℃ 조건에서 14일간 암배양했다. 이후 생장이 활발한 균사의 가장자리를 다시 PDA 평판배지에 계대하여 8일간 25℃에서 암배양한 뒤 스트레스 처리 및 생물발광 측정에 사용하였다.
스트레스 처리
물리적 손상 스트레스(wounding stress)를 처리하기 위하여 의료용 칼날(Feather, Osaka, Japan)을 이용하여 균사 표면을 자른 후[6] 25℃에서 암배양하며 시간에 따른 생물발광의 변화를 관찰하였다. 저온 스트레스는 4℃, 고온 스트레스는 40℃에 균사를 노출시킴으로써 처리하였다. 각각의 대조군으로는 아무런 처리를 하지 않고 25℃, 암조건에서 배양한 균사를 사용하였다.
생물발광 이미지 촬영
균사의 생물발광을 촬영하기 위하여 ChemiDoc XRS+ (Biorad, CA, USA)를 활용하였다. 촬영 조건은 Image Lab 5.2.1 소프트웨어(Biorad, CA, USA)를 이용하여 조절하였다. 균사의 생물발광은 Application 탭에서 No filter, No illumination 조건을 지정하고, Image Exposure 탭에서 카메라의 노출시간을 10분으로 고정하여 모든 균사에 대해 동일하게 촬영하였으며, Display Options 탭에서 Image Color를 SYBR Green으로 지정하였다. 균사의 명시야(bright field) 이미지는 Application 탭에서 No filter, White epi illumination 조건을 지정하고, Image Exposure 탭에서 카메라의 노출시간을 소프트웨어가 자동으로 최적화하도록 지정하였으며, Display Options 탭에서 Image Color를 Gray로 지정하여 촬영하였다.
결과 및 고찰
화경버섯 균사의 생물발광
생물발광이 알려진 뽕나무버섯(Armillaria mellea), Mycena citricolor, Omphalotus olearius, 부채버섯(Panellus stipticus)을 이용하여 균사 배양 온도에 따른 생물발광 차이에 대해 연구한 결과, 대체로 생장이 활발한 조건에서 균사들의 생물발광 정도가 높다고 알려졌다[22]. 이에 본 연구에서는 화경버섯 균사의 생물발광을 효율적으로 관찰하기 위하여, 생장이 가장 활발한 것으로 알려진 PDA 배지에서의 25℃ 암배양 조건을 기본으로 실험을 진행하였다[23].
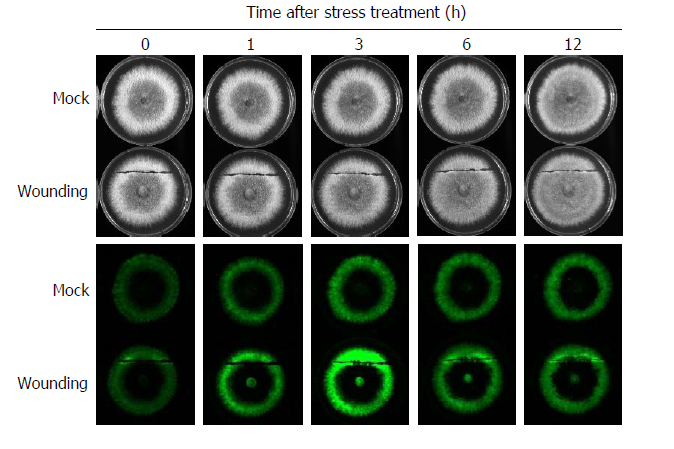
과거 보고[21]에서 알려진 바와 같이, 본 연구에서 사용한 화경버섯 균주의 균사에서도 생물발광 현상을 관찰할 수 있었다(Fig. 1). 흥미로운 점은 균사체의 가장자리 부근에서 중심부에 비해 높은 발광이 관찰된 점이다. 이는 적갈색애주름버섯(Mycena haematopus) 균사에서의 결과와 유사하다[21]. 그러나 뽕나무버섯(Armillaria mellea)이나 부채버섯(Panellus stipticus), Neonothopanus nambi의 균사는 전 영역에서 고른 발광을 보인다는 점과 차이가 있다[6]. 따라서 균사체의 어느 영역에서 생물발광이 높은가는 종의 특성일 가능성이 높다고 생각된다. 그러나 서로 다른 배양조건의 영향일 가능성도 배제할 수 없으므로, 향후 균일한 배양 조건에서 특정 종의 여러 균주들이 일정한 발광 양상을 보이는지 확인함으로써, 균사의 생물발광 영역의 차이가 종의 특성인지 검증할 수 있을 것이다.
스트레스에 의한 생물발광의 변화
뽕나무버섯(Armillaria mellea)과 Neonothopanus nambi의 균사에서 물리적인 손상 스트레스에 의해 생물발광이 증가됨이 알려졌다[6]. 이에 화경버섯도 유사한 반응성을 나타내는지 알아보기로 하였다. 수술용 칼날로 균사에 상처를 낸 뒤 시간에 따른 생물발광의 변화를 살펴본 결과, 화경버섯의 균사에서도 물리적 손상에 의해 생물발광이 증대됨을 확인하였다(Fig. 1). 표면에 상처를 낸 부위에서 생물발광이 가장 강하게 나타났으며, 이는 처리 후 12시간까지 지속되었다. 상처 부위 외에도 균사 전반에서 생물발광 증가를 관찰할 수 있었고, 이는 처리 후 3시간에 최대로 나타났다가 6시간 이후부터는 대조군과 비슷한 정도로 다시 감소함을 알 수 있었다. 이러한 결과는 상처부위에서 시작하여 균사의 다른 부위까지 전달되는 신호 전달 체계가 존재하고, 생물발광이 이 신호 전달 체계에 의해 조절될 수 있을 암시한다.
생물발광은 기본적으로 산화 반응을 통해 일어난다. 따라서 생물이 산화 스트레스에 대한 적응 기작으로 생물발광 기작을 진화적으로 획득하였을 것이라는 주장들이 제기된 바 있다[5]. 실제로 물리적 손상은 세포에 활성산소를 증가시켜 산화적 스트레스(oxidative stress)를 일으킨다고 알려져 있다[24]. 즉, 물리적 손상에 의해 증가된 산화적 스트레스에 대응하기 위하여 생물발광이 증가하였을 가능성이 있는 것이다. 이에 우리는 산화적 스트레스에 대한 대응 기작으로 생물발광 증가가 일어난다는 가설을 확인하기 위하여, 산화적 스트레스를 일으키는 것으로 알려진 또 다른 환경 조건인 온도 스트레스[25]를 처리하고 생물발광의 변화를 살펴보기로 하였다.
예상과 다르게 지속적인 저온과 고온 처리에 의해서 화경버섯 균사의 생물발광이 억제됨을 확인하였다(Fig. 2). 1시간의 짧은 온도 스트레스 처리 후 25℃ 조건에서 배양하며 관찰한 결과에서도 생물발광의 증가는 조사한 시간 내에 나타나지 않았고, 온도 스트레스에 의해 감소했던 생물발광이 점차 대조군과 비슷한 수준으로 회복되는 것만 관찰되었다(Fig. 2). 물리적 손상에 의한 스트레스와 온도 스트레스는 서로 다른 기작으로 화경버섯 균사의 생물발광에 영향을 미치는 것으로 생각된다.
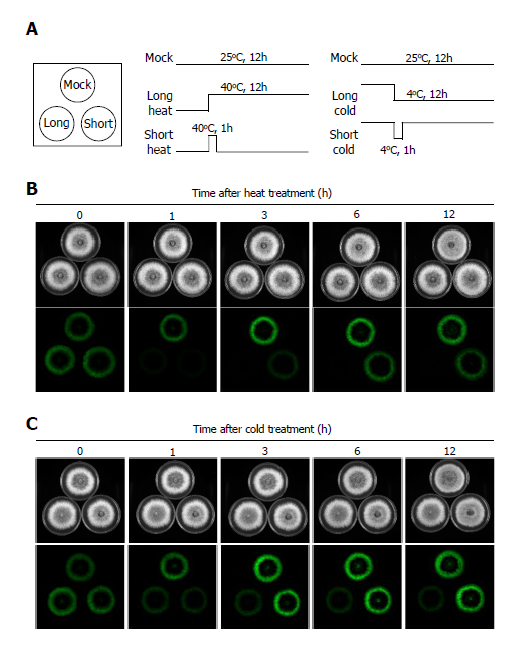
Fig. 2.Effects of temperature stress on bioluminescence of Omphalotus japonicus mycelia. Schemes of temperature treatments were displayed in (A). Mycelia grown at 25℃ were transferred to 40℃ (B) or 4℃ (C) under darkness for stress treatments. To examine the effects of long-term temperature stress, mycelia were incubated at 4℃ or 40℃ for 12h. To examine the effects of short-term temperature stress, mycelia were transferred to 25℃ after exposure to temperature stress for 1h. Images at bright field (top) and at a dark field (low) were acquired at each time points.
한편, 물리적 손상 스트레스는 자연계에서 버섯을 섭취하는 곤충들에 의해 유도될 수 있다. 따라서 물리적 손상에 의해 증가된 생물발광이 이들 곤충과 버섯 간의 상호작용에 관련되었을 가능성이 있다. 식물에서는 포식자에 의한 물리적 손상이 메틸자스몬산(methyl jasmonic acid)과 같은 휘발성 유기화합물의 생성을 촉진하고, 이를 통해 포식자의 천적을 불러일으키는 등의 방어 기작이 촉진됨이 보고되었다[26]. 버섯의 경우, 생물발광에 의해 발생하는 녹색 파장의 LED를 모형 버섯에 비추었을 때 버섯의 포자를 퍼뜨릴 수 있는 곤충들의 방문이 대조군에 비해 증가했다는 보고가 있다[27]. 따라서 곤충에 의한 버섯의 물리적 손상이 생물발광을 촉진하고, 이것이 더욱 많은 곤충들을 유인하여 포자를 퍼뜨리는 데 기여할 수 있을 것이다. 향후 생물발광을 조절하는 기작에 대한 분자생물학적 연구와 더불어 곤충들과의 관계에 대한 생태학적 연구가 이루어진다면, 버섯의 생물발광에 대해 이해하는 데 도움이 될 것이다.
적요
생물발광은 생물체 내에서 빛이 방출되는 현상을 말한다. 이 현상은 루시페라아제(luciferase)에 촉매되는 루시페린(luciferin)의 산화 반응에 의해 나타난다. 생물발광은 균류를 포함하여 다양한 생물 종에서 나타남이 알려져 있다. 현재까지 약 80여 종의 균류에서 생물발광이 관찰됨이 보고되었다. 화경버섯(Omphalotus japonicus)은 한국에 자생하는 대표적인 생물발광 버섯이다. 본 연구에서는 화경버섯 균사의 생물발광에 대하여 조사하였다. 그 결과, 고체 배지에서 자란 화경버섯 균사체의 가장자리 부근에서 중심부에 비해 높은 발광이 관찰되었다. 또한 균사 표면에 상처를 내자 해당 부위에서 강한 생물발광이 관찰되었다. 이러한 생물발광의 증가는 처리 후 3시간에 최대로 나타났다. 다음으로 극단적인 온도 스트레스에 의한 생물발광의 변화에 대해서도 살펴보았다. 그 결과, 외부 자극에 의한 상처 스트레스와 달리 고온이나 저온 스트레스에 의해 균사의 생물발광이 억제됨을 확인하였다. 환경 스트레스에 의해 일어나는 생물발광 변화의 생리학적 및 생태학적 의미를 밝히기 위해 더 많은 연구가 필요할 것이다.