서론
표고(Lentinula edodes)는 사극성의 교배계를 갖는 담자균으로 두 균사 간의 교잡 화합성이 서로 독립적인 A와 B 교배형 유전자좌(mating type loci)에 의해 결정된다[1,2]. 두 균사 간에 A, B 교배형이 각기 서로 다른 경우에만, 균사 융합 이후에 핵 이동(nuclear migration), 핵쌍(nuclei pairing), 꺽쇠연결(clamp connection) 등의 과정이 성공적으로 일어나 교잡이 일어날 수 있다[2,3]. 최근 표고의 교배형에 대한 분자유전학적 연구들을 바탕으로, A 유전자좌는 한 쌍의 호메오도메인(homeodomain, HD) 전사인자를 암호화하고 있으며, B 유전자좌는 페로몬(pheromone)과 페로몬 수용체(pheromone receptor)를 암호화하고 있음이 알려졌다[1,4,5]. 또한 재배종과 야생종에 대한 분석을 통해 다양한 A와 B 교배형의 유전자 서열 또한 밝혀졌으며, B 교배형에 비해 A 교배형의 유형이 매우 다양하다는 특성도 보고된 바 있다[6,7].
사극성의 교배계를 갖는 하나의 이핵균주(AxAyBxBy)는 이론적으로 네 가지의 교배형을 갖는 담자포자를 1:1:1:1 (AxBx:AxBy:AyBx:AyBy)의 비율로 만들 수 있다. 그런데 느타리(Pleurotus ostreatus)와 표고 등 다양한 균류에서 교배형의 편향된 분리비(distorted segregation ratio)가 보고된 바 있다[8-11]. 표고와 같은 담자균에서 담자포자의 교배형에 대한 연구는 담자포자 발생 과정에 대한 학문적 측면에서 중요할 뿐 아니라, 버섯 신품종 육성 측면에서도 교잡 효율에 영향을 미치므로 중요하다. 하지만 표고에서 교배형의 분리비에 대한 기존의 연구들은 모두 균사체의 모양이나 꺽쇠연결 여부와 같은 형태적 특성에만 의존하여 교배형을 결정했다는 실험적인 한계가 있다[10-12].
한편, 특정 유전자좌(gene locus)의 편향된 분리는 해당 유전자좌에 위치한 유전자 또는 그와 연관된 유전자가 담자포자의 발아(germination)나 균사 생장 속도, 균사의 치사율(lethality) 등에 영향을 줄 때 나타날 수 있다[9,13,14]. 예컨대 다양한 균류에서 교배형과 치사 대립 유전자(lethal allele)의 연관이 보고된 바 있다[15-17]. 이 경우 교배형과 연관된 유전자에 의해 균사의 생존율이 영향을 받으므로 균사 집단 구축 시 특정 교배형에 편향된 분리비가 관찰될 수 있다. 담자균인 느타리와 치마버섯(Schizophyllum commune)의 경우, A 교배형이 단핵균사의 생장 속도와 연관되어 있음이 보고된 바 있다[9,18]. 생장 촉진 인자가 특정 교배형과 연관된 경우, 해당 교배형을 가진 균사가 동일한 실험 조건에서 빠르게 자라서, 균사 집단 구축 시 선호될 확률이 높으므로 특정 교배형에 편향된 분리비가 관찰될 수 있을 것이다. 표고의 경우, A 교배형과 단핵균사 생장 관련 양적 형질 위치(quantitative trait locus, QTL)가 연관되었다는 보고는 있었으나[19], 아직까지 교배형과 단핵균사의 생장 속도와의 관계가 실험적으로 증명된 바는 없다.
이에 본 연구에서는, 먼저 세 가지 표고 품종에서 담자포자들을 분리한 뒤, 최근 밝혀진 교배형의 염기서열을 기반으로 개발된 DNA 마커를 활용해서 각각의 교배형을 결정하고 그 분리비에 대해 통계적으로 분석하였다. 나아가 각각의 교배형에 따른 담자포자 유래 단핵균사들의 생장 속도를 비교함으로써 표고에서 관찰되는 교배형의 편향된 분리비의 원인에 대해 알아보고자 하였다. 본 연구는 단핵균사 생장 기작을 이해하고, 효율적으로 버섯 신품종 육성 전략을 세우는 데 도움을 줄 것으로 기대된다.
재료 및 방법
균주 및 담자포자 분리
실험에는 국립산림과학원에 보존된 표고 균주를 사용하였다(Table 1). 각 균주를 이용하여 신갈나무 톱밥배지에서 자실체를 발생시킨 뒤, 균주별로 생육이 건전한 하나의 자실체를 선별하여 담자포자 분리에 사용하였다. 담자포자는 자실체에서 낙하한 포자들을 멸균된 증류수에 모아 포자현탁액을 만든 뒤, 연속희석법(serial dilution method)을 통해 potato dextrose agar (PDA, BD Difco, MD, USA) 배지에 도말하여 분리하였다[20]. 담자포자는 25℃, 암조건에서 배양하였으며, 담자포자 발아율 차이에 의해 단핵균사 집단에 편향성이 생기는 것을 배제하기 위하여 배양 기간을 기존의 보고보다 길게 5-7일간 배양하여 발아시킨 뒤, 균주별로 약 100개씩 분리하여 PDA 배지에서 25℃, 암조건으로 14일간 배양하였다[12,21]. 이후 현미경을 통해 꺽쇠연결이 없음을 확인한 뒤 생장 측정과 교배형 분석에 사용하였다.
균사 생장 측정
담자포자 유래 단핵균사들의 생장 속도 차이를 비교하기 위하여, 교배형 분석으로 단핵균사임이 확인된 균사들에 대해서 생장 측정을 수행하였다. 단핵균사의 가장자리에서 cork borer를 이용하여 6 mm agar plug를 분리하여 PDA 배지에 계대한 뒤 25℃에서 14일간 암배양 후, 균사체의 직경을 측정하고 그 값을 비교하였다. 균주별로 3반복을 실시하고, 하나의 균사체당 직경을 2회 측정하여 그 평균값을 사용하였다.
교배형 분석
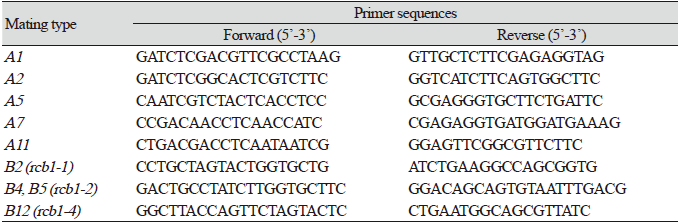
각각의 단핵균사의 교배형은 기존에 보고된 DNA 마커를 이용하여 PCR을 수행함으로써 결정하였다[6,7]. 균주별로 gDNA 추출을 위해 cell scraper (SPL, Seoul, Korea)를 이용하여 배양된 균사체를 모은 뒤, DNeay Plant Pro kit (Qiagen, CA, USA)를 사용하여 제조사에서 제공하는 표준 지침에 따라 gDNA를 분리하였다. 이후 각각의 교배형을 선택적으로 증폭할 수 있는 프라이머(Table 2)와 AccuPower PCR premix (Bioneer, Daejeon, Korea)를 사용하여 C1000 thermal cycler (Biorad, CA, USA)로 PCR을 수행하였다. PCR은 94℃에서 5분 변성 후, 94℃에서 30초, 60℃에서 30초, 72℃에서 30초로 35회 반복하고, 72℃에서 7분간의 추가 반응 조건으로 진행하였다. PCR 증폭 여부는 1.5% 아가로스 젤 전기영동으로 확인하였다.
통계 분석
균주별로 담자포자의 교배형의 분리가 1:1:1:1로 일어나는지 확인하기 위하여 카이제곱검정을 수행하였다. 교배형별 생장 속도에 대한 통계분석은 SPSS 프로그램(SPSS version18, SPSS IBM, NY, USA)을 이용하였다. 네 가지 교배형에 따른 생장 속도 차이를 비교하기 위해서는 일원배치 분산분석(one-way ANOVA)을 수행했으며, A 또는 B 교배형에 따른 생장 속도 차이를 비교하기 위해서는 Student’s t-test를 수행하였다.
결과 및 고찰
교배형의 분리비
최근 밝혀진 표고 교배형 결정 유전자 서열을 바탕으로 개발된 DNA 마커를 활용하여 세 가지 표고 균주에 대해 담자포자 유래 단핵균사들의 교배형을 결정하였다[6,7]. 그 결과, 태향고(NIFoS 4317)에세서만 네 가지 교배형이 1:1:1:1의 이론적 분리비로 관찰되었으며, 산조701호(NIFoS 2462)과 산마루2호(NIFoS 2925)에서는 1:1:1:1의 비율에서 벗어난 편향된 분리비(distorted segregation ratio)가 확인되었다(Table 3). 이와 같이 버섯 담자포자 유래 단핵균사들의 교배형의 분포가 균주에 따라 다르게 나타나는 현상은, 표고와 느타리에서 교배 실험 및 꺽쇠연결 여부 확인을 통해서 보고된 바와 일치한다[8-12].
Table 3. Distribution of four mating types in basidiospores from different cultivars.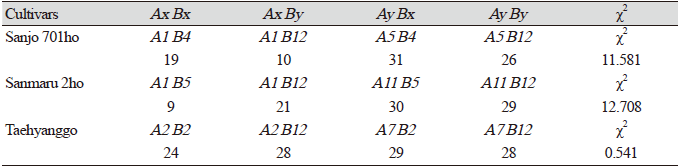
|
|
χ2 (0.05, 3) = 7.815, χ2 (0.01, 3) = 11.345. |
한편, 표고에서는 담자포자 교배형의 불균일한 분포가 주로 모균주의 교배형(parental mating type)이 재조합 교배형(recombinant mating type)보다 우세하게 나타나기 때문으로 보고된 바 있다[11]. Cheng과 Lin의 연구에 따르면, 조사한 17 균주의 표고 중 8 균주에서 담자포자 교배형의 불균일 분포가 나타났으며, 불균일 분포를 보인 8 균주 중 7 균주에서 모균주의 교배형이 재조합 교배형보다 통계적으로 우세하게 나타났다[11]. 하지만 본 연구에서 분석한 세 균주의 표고 모두에서는 모균주의 교배형과 재조합 교배형의 빈도 간에 통계적으로 유의미한 차이가 발견되지 않았다(Table 4). 적어도 본 연구에서 분석한 산조701호와 산마루2호에서 담자포자의 교배형의 분리비가 편향되어 나타난 원인이 모균주 교배형의 우세한 선택 또는 발생 때문은 아닌 것으로 보인다. 이러한 차이가 실험 균주의 차이 때문인지, 기존 연구에서 사용한 교배형 결정 방법의 한계 때문인지 밝히기 위해서는 보다 많은 균주에 대한 추가적인 분석이 필요할 것이다.
담자포자의 교배형 쏠림 현상은 버섯 신품종 육성에 있어서도 중요하다. 다양한 버섯의 신품종 육성을 위해서, 우수한 품종의 담자포자 유래 단핵균사를 활용한 단핵균사-단핵균사 간의 교배 혹은 이핵균사-단핵균사 간의 교배가 현재도 널리 쓰이고 있다[20-24]. 이 때, 성공적인 교배가 일어나기 위해서는 서로 화합 가능한 교배형을 가진 균사의 확보가 필요한데, 특정 교배형 쏠림으로 인해 화합 가능한 교배형을 가진 단핵균사를 얻는 데 어려움이 생길 수 있는 것이다. 더구나 표고의 A 교배형에 대한 선행 연구에 따르면, 한국, 중국, 일본의 표고 균주들이 주로 A1을 비롯한 몇 가지 A 교배형만을 가지고 있음이 확인되었다[6]. 즉, 육종의 재료로 쓰일 수 있는 균주들의 A 교배형이 한정적인 상황에서, 이들의 담자포자 교배형이 불균일한 분포를 보일 경우, 활용할 수 있는 단핵균사의 종류가 매우 제한적일 수 있는 것이다. 따라서 향후 교배형의 불균일한 분포가 일반적인 현상인지, 어떠한 기작을 통해 일어나는지, 나아가 해당 현상을 억제 혹은 증진할 수 있는 방법이 있는지에 대해서도 연구할 필요가 있을 것이다.
Table 4. Distribution of parental and recombinant mating types in basidiospores from different cultivars.
|
|
aParental mating types of Sanjo 701ho are not reported. χ2 (0.05, 1) = 3.841. |
교배형과 생장 속도 상관관계
다음으로는 교배형이 균사 생장 속도에 영향을 주어서 교배형의 편향된 분리가 일어나는지 알아보고자 교배형별 균사 생장 속도를 비교 분석하였다. 먼저, 각 균주마다 네 가지 교배형별 균사 생장 속도를 비교한 결과, 산조701호에서는 네 가지 교배형 간에 통계적으로 유의미한 차이가 없었으나, 태향고에서는 A 교배형에 따라 균사 생장 속도에 차이가 있음이 확인되었다(Fig. 1A). 다음으로 A와 B 교배형별 균사 생장 속도를 비교한 결과, 산마루2호와 태향고에서 기존의 QTL 연구 결과와 일치하게 A 교배형과 균사 생장 속도의 상관관계가 확인되었으며 세 균주 모두에서 B 교배형과 균사 생장 속도는 관계가 없음이 확인되었다(Fig. 1B and 1C). 따라서 균주에 따른 차이가 있을 수 있으나 단핵균사의 생장 속도에 영향을 주는 유전인자가 A 교배형과 연관되어있을 가능성이 높게 나타났다.
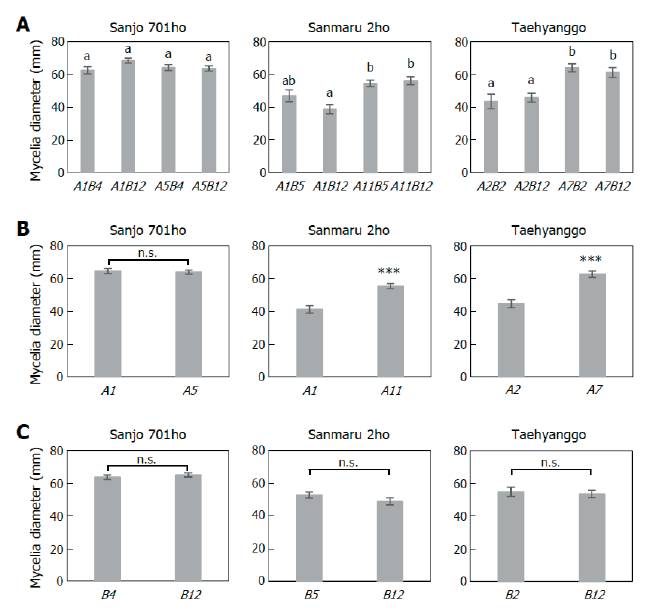
Fig. 1. Dependence of mycelial growth rate on A mating type. Mycelia diameter of basidiospore-derived monokaryons harboring each mating type was measured after 14 d of growth at 25℃ under dark conditions. Bars, standard error. (A) Mycelia diameter of monokaryons with four different mating types. The letters, a and b, indicate statistically significant differences based on one-way ANOVA with Tukey’s HSD test (p<005). (B and C) Mycelia diameter of monokaryons with different A (B) or B mating types (C). Asterisks indicate statistically significant difference using Student’s t-test (***, p<0.001). n.s.,not significant.
하지만 A 교배형과 균사 생장 속도의 관계 때문만으로 담자포자의 편향된 분리비가 나타나는 것은 아닌 것으로 판단된다. 왜냐하면 교배형과 균사 생장 속도 간에 상관관계가 나타나지 않은 산조701호에서도 교배형의 불균일 분포가 관찰되었고, 태향고에서 생장이 빠른 교배형 그룹(A7)이 생장이 느린 교배형 그룹(A2)보다 더 많이 분리되지 않았기 때문이다(Table 3; Fig. 1). 따라서 표고 담자포자 교배형의 불균일 분포에는 교배형에 따른 균사 생장 속도 차이 외에 다른 요인이 더 큰 영향을 주는 것으로 생각된다.
한편, 본 연구에서 분석한 세 균주 중 산조701호에서만 A 교배형에 따른 균사 생장 속도 차이가 나타나지 않았다(Fig. 1B). 이는 다른 균주들과 달리, 균사 생장에 영향을 주는 인자가 산조701호의 두 모균주 간에 차이가 없었기 때문일 수 있다. 해당 인자는 A 교배형과 연관된 유전자일 수도 있고, A 교배형이 암호화하는 HD 전사인자일 수도 있을 것이다. 한 가지 주목할만한 것은, 다양한 표고 균주에서 빈번하게 확인된 A1 교배형의 HD1 전사인자의 발현량이, 빈도가 낮은 다른 A 교배형의 HD1 전사인자의 발현량보다 높다는 것이다[6]. 본 연구에서 사용된 균주 중 산조701호만이 가장 빈번하게 관찰되는 두 가지 A 교배형(A1 과 A5)을 가졌고, 다른 균주들은 빈도에 차이가 나는 A 교배형을 가졌다. 이러한 차이가 영향을 미쳤는지 알아보기 위해, 향후 균주별로 A 교배형에 따라 HD1 전사인자의 발현량에 차이가 있는가 확인하고, 그 차이가 균사 생장 속도와 상관관계가 있는지를 살펴볼 필요가 있을 것이다. 만일 HD1 전사인자의 발현량과 균사 생장 속도에 상관관계가 있다면, 해당 전사인자가 균사 생장에 영향을 주는 유전자들의 발현을 조절하는 데 중요할 것으로 예상할 수 있다. 이러한 후속 연구는 교배형이 단핵균사 생장 속도에 영향을 주는 기작을 밝히는 데 도움이 될 것이다.
표고 QTL 연구 결과에 따르면, A 교배형이 본 연구에서 확인한 단핵균사 생장 속도뿐만 아니라, 이핵균사 생장 속도와 갓 직경, 갓 무게, 대 길이와 같은 자실체 특성과도 연관되어 있음이 보고된 바 있다[19,25,26]. 따라서 A 교배형 및 그 주변 영역의 유전자들에 대한 후속 연구를 통해 표고의 균사 생장과 자실체 특성 결정 기작에 대한 이해를 높일 수 있을 것으로 기대된다. 이러한 연구는 표고의 생장과 자실체 발생을 분자생물학 관점에서 이해하는 데 도움이 될 뿐 아니라, 효율적으로 표고 신품종을 육성하는 데에도 기여할 것으로 기대된다.
적요
표고는 사극성의 교배계를 갖는 담자균의 일종으로, 표고의 교배형은 A와 B라 불리는 서로 독립된 두 유전자좌에 의해 결정된다. 이론적으로 하나의 이핵균주는 네 개의 서로 다른 교배형을 갖는 담자포자를 1:1:1:1의 비율로 만들 수 있다. 과거 연구 결과에 따르면, 표고 담자포자에서 교배형이 편향된 분리비로 나타남이 보고되었다. 하지만 이러한 결과들은 꺽쇠연결과 같은 형태학적 특성만을 기반으로 교배형을 결정했다는 한계가 있다. 이에 본 연구에서는 교배형의 편향된 분리비가 표고에서 일반적인 현상인지 보다 명확하게 알아보기 위해서 최근에 보고된 DNA 마커를 활용하여 세 가지 표고 품종들의 담자포자에 대한 교배형 분석을 수행하였다. 그 결과 교배형의 편향된 분리비가 과거 보고와 일치하게 균주 특이적인 특성임을 확인하였다. 분석한 세 품종 중 한 품종을 제외하고 나머지 두 품종에서 편향된 분리비가 관찰된 것이다. 다음으로는 각 담자포자 유래 단핵균사들의 생장 속도와 교배형의 상관관계를 분석하였다. 그 결과 표고 단핵균사의 생장 속도는 B 교배형과는 관계가 없고, A 교배형과 관계가 있음을 확인하였다. 따라서 A 교배형 유전자좌에 존재하는 호메오도메인 전사인자 혹은 A 교배형 유전자좌와 연관된 유전자들이 단핵균사의 생장에 영향을 줄 것으로 보인다. 버섯 신품종 육성에서 교배형의 중요성을 고려할 때, 본 연구는 효율적인 신품종 육성 전략을 세우거나 단핵균사 생장 기작을 이해하는 데 도움을 줄 것으로 기대된다.
Acknowledgement
This work was supported by the Golden Seed Project of ‘Breeding of new strains of shiitake for cultivar protection and substitution of import [213007-05-5-SBH10]’ provided by the Ministry of Agriculture, Food and Rural Affairs, Ministry of Oceans and Fisheries, Rural Development Administration and Korea Forest Service.