서론
맥류의 붉은곰팡이병은 Fusarium graminearum species complex에 속하는 균들에 의해 발생되며 이들은 주로 개화기에 침입, 낟알을 쭈그러들게 하여 품질과 수량을 떨어뜨리고, 종종 데옥시니발레놀(deoxynivalenol, DON), 니발레놀(nivalenol, NIV)과 이들의 아세틸 유도체 및 제랄레논(zearalenone)과 같은 독소를 생성하여 식품과 사료의 안전성을 위협한다[1].
우리나라에서 붉은곰팡이병은 보리, 밀 뿐 아니라 벼와 귀리 등에도 발생하며, 우점하는 원인균은 DON을 주로 생성하는 F. graminearum보다 NIV를 생성하는 F. asiaticum인 것으로 보고되었다[2-4]. 농촌진흥청에 따르면 맥류 붉은곰팡이병의 발병률은 2002년 54.7%, 2012년 8.2%, 2016년 6.7%, 2018년 16.2%, 2021년 7.0%로 조사되었고, 특히 출수기부터 등숙기까지의 연속된 강우가 피해를 유발하는 것으로 나타났다. 전세계적으로 붉은곰팡이병의 방제에는 비기주작물과의 윤작, 저항성 품종의 재배 및 등록된 살균제 살포 등의 종합적 방법이 권장되어 왔다[5]. 그러나 국내 맥류 주산지에서는 대부분 기주작물인 맥류와 벼를 윤작하고 있으며, 저항성이 높은 품종이 없어 약제 방제에 의존하고 있는 실정이다. 현재 등록된 방제 약제로는 보리에 hexaconazole 입상 수화제 등 8종이, 밀에는 fludioxonil 액상수화제 등 4종이 있으나, 실제 맥류 재배 농가에서는 보리와 밀에 함께 등록되어 있는 captan 수화제와 difenoconazole·propiconazole 유제를 주로 사용하고 있다. 이 중 propiconazole은 thiophanate–methyl 또는 tebuconazole과도 합제로 보리의 붉은곰팡이병에 등록되어 있다. Propiconazole과 같은 triazole계 탈메틸화 저해제(demethylation inhibitor, DMI)는 곰팡이의 세포벽 합성에 중요한 역할을 하는 에르고스테롤의 전구체인 라노스테롤의 14-C 탈메틸화를 저해하며, 광범위한 곰팡이에 효과적이다[6]. 그러나 최근에는 몇 가지 triazole계 저항성 병원균이 보고되면서 방제에 어려움을 겪고 있는데 prochloraz에 대한 벼 키다리병균(Fusarium fujikuroi)의 저항성이 국내외에서 보고되었으며[7-10], propiconazole에 대해서도 복숭아와 자두의 잿빛무늬병균(Monilinia fructicola)과 잔디의 동전마름병균(Clarireedia sp.) 등이 지속적인 노출에 의해 감수성이 낮아졌다는 보고가 있다[11-13].
붉은곰팡이병균의 triazole계 살균제 저항성은 2000년대 후반 중국에서 tebuconazole과 prochloraz[14], 독일에서 propiconazole[15] 저항성 균이 보고된 바 있고, tebuconazole에 적응된 붉은곰팡이병 균주가 azole계에 특이적 교차 저항성을 보였다는 보고가 있다[16]. 또한 미국에서도 triazole계 살균제가 밀에 광범위하게 사용된 2000년 이후에 분리된 균주가 1981-1999년 균주보다 metconazole과 tebuconazole에 대한 감수성이 절반으로 감소하였다는 보고[17]와 2014년 tebuconazole 감수성이 저하된 균주가 보고된 바 있다[18].
붉은곰팡이병균의 살균제 저항성은 방제 효과의 저하로 인한 수량감소뿐만 아니라 곰팡이독소의 생성으로 인해 안전성도 떨어뜨리므로 맥류 붉은곰팡이병균 집단의 감수성 변화를 모니터링하는 것이 반드시 필요하다. 본 연구에서는 국내 맥류 재배면적의 80% 이상을 차지하는 전남북 지역에서 2010-2016년과 2020-2021년에 분리한 붉은곰팡이병균을 동정하고 독소화학형을 분석하였으며, 방제 약제로 많이 사용되는 propiconazole에 대한 감수성 정도를 조사하여 연도별 저항성 변이를 분석하고, 저항성 기준을 설정하였다.
재료 및 방법
붉은곰팡이병균의 분리, 동정 및 독소화학형 분석
전남북 지역의 보리와 밀에서 2010년부터 2016년까지 분리하여 보존 중인 124개 균주와 2020년과 2021년에 분리한 350개 균주를 대상으로 실험을 수행하였다. 5월 하순경 지역별 맥류 포장에서 무작위로 이삭을 수집하였으며, 낟알을 분리하여 1% 차아염소산나트륨으로 표면소독하고 멸균수로 2회 헹군 다음 감자한천배지(potato dextrose agar, PDA)에 치상하여 25℃에서 5일간 배양하였다. 자라난 균총을 카네이션잎배지(carnation leaf agar)에 옮겨 배양하여 포자를 형성시킨 후 단포자를 분리하였고, 20% glycerol 용액으로 포자현탁액을 만들어 -80℃에 보관하며 실험에 사용하였다. 종 동정과 B type trichothecene 독소화학형은 TEF (translation elongation factor 1-alpha)와 TRI12 유전자를 각각 이용하여 결정하였다[19].
맥류 붉은곰팡이병균의 propiconazole에 대한 약제반응 조사
Propiconazole (a.i. 25%, EC)에 대한 붉은곰팡이병균의 감수성 정도는 한천희석법을 이용하여 균사생장 억제 정도를 조사하여 비교하였다. 연도별 분리 균주를 PDA배지에 접종하여 25℃에서 5일간 배양한 후 활발히 자라는 균총의 선단부를 cork borer (직경 5 mm)로 절단하였다. 약제는 멸균수에 용해하여 PDA 배지에 최종 농도가 각각 500.0, 100.0, 20.0, 4.0, 0.8, 0.16 μg/mL가 되도록 첨가하였고, 절단한 균총은 배지 중앙에 접종하였다. 균주당 각 농도별 2반복으로 하고 최소 2회 실험하였다. 접종한 plate를 25℃ 암상태에서 5일동안 배양한 후 직경을 수직으로 2회 조사하고 접종원 크기를 뺀 다음 평균을 구하였다. 측정된 균총의 직경과 약제를 첨가하지 않은 PDA 배지에서의 균총 직경을 비교하여 균사생장 억제율(%, [1-(약제 배지에서의 균총 직경/무처리 배지에서의 균총 직경)]×100)을 계산하였다. SigmaPlot version 12.3 (Systat Software Inc., San Jose, CA, USA) 프로그램을 이용하여 균사생장을 50% 억제하는 농도인 Half maximal effective concentration (EC50) 값을 계산하였고, 균사생장억제율과 EC50값을 기준으로 저항성 균주와 감수성 균주를 구분하였다.
결과 및 고찰
실험 균주의 동정 및 독소화학형
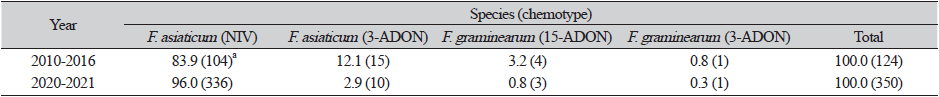
전남북 지역의 보리와 밀에서 분리한 균주들의 종 구성과 독소화학형은 Table 1과 같다. 2010년부터 2016년까지의 124개 균주 중에서는 니발레놀을 생성하는 F. asiaticum (F. asiaticum-NIV)이 83.9% (104개), 3–아세틸 데옥시니발레놀을 생성하는 F. asiaticum (F. asiaticum-3–ADON)이 12.1%(15개), 15–아세틸 데옥시니발레놀을 생성하는 F. graminearum (F. graminearum-15–ADON)이 3.2%(4개), 3–아세틸 데옥시니발레놀을 생성하는 F. graminearum (F. graminearum-3–ADON)이 0.8%(1개)로 나타났다. 2020년부터 2021년에 분리한 350개 균주 중에서는 F. asiaticum-NIV가 96.0%(336개), F. asiaticum-3–ADON이 2.9%(10개), F. graminearum-15–ADON이 0.8%(3개), F. graminearum-3–ADON이 0.3%(1개)로 나타났다. 이는 2001년 전남북을 포함한 남부 지역 벼에서 분리한 붉은곰팡이병균의 97%가 F. asiaticum-NIV였다는 결과[20]와 유사하며, 이 등[2]도 2009년 국내 벼에서 분리된 253개 붉은곰팡이병균의 95%, 특히 전남북 지역 분리균의 98.9%가 F. asiaticum-NIV라고 하면서 이 균이 벼를 선호한다고 하였다. 이러한 경향은 밀과 벼가 윤작되는 중국 남부에서 밀 분리균의 97%가 F. asiaticum였으며[21], 일본의 밀과 보리에서 분리된 균주의 82.2%가 F. asiaticum이었고 그 중 약 70%가 NIV형이었다는 보고[22]와 같이 중국, 일본 등에서도 유사하다. Lee 등[3]은 F. asiaticum-NIV가 국내 벼, 보리, 밀 등의 곡류에 우점하며, F. graminearum에 비해 유성생식 능력은 떨어지나 벼에 대한 병원성이 더 강한데 이는 F. asiaticum-NIV가 맥류와 벼의 윤작체계에 적응한 결과로 보인다고 하였다. 본 연구에서 F. asiaticum-NIV가 절대다수로 종 및 독소화학형에 따른 propiconazole 감수성의 차이를 보기는 어려웠다. 향후 분리 지역 및 기주를 확대하여 이를 살펴보는 것이 필요할 것으로 생각된다.
붉은곰팡이병균의 propiconazole에 대한 감수성
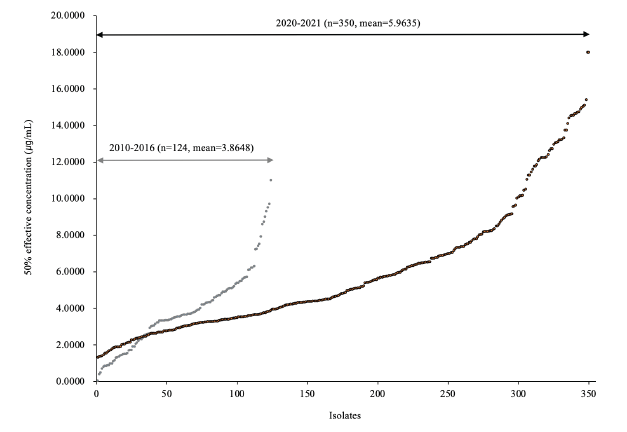
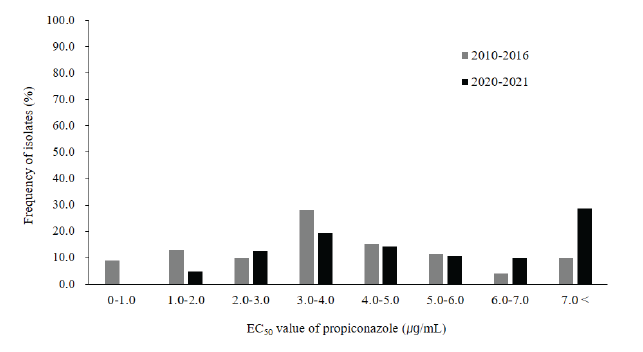
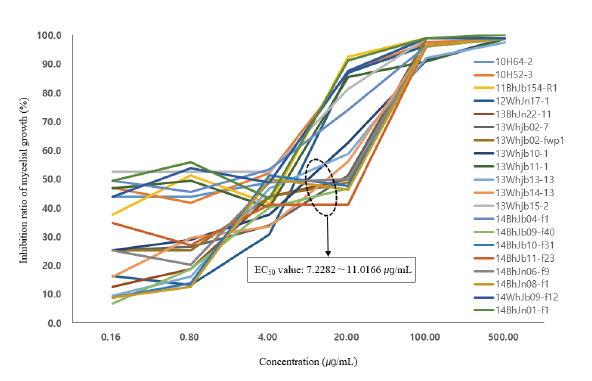
분리 균주를 대상으로 균사생장을 50% 억제하는 농도인 EC50 값을 구하여 그래프로 나타낸 결과 2020-2021년 분리 균주의 EC50 값의 범위가 2010-2016년 분리 균주에 비해 크게 넓어진 것을 볼 수 있었다(Fig. 1). 즉 2010-2016년 분리 균주의 최소값은 0.0180 μg/mL, 최대값은 11.0166 μg/mL인데 비해 2020-2021년 분리 균주의 경우 최소값이 1.3104 μg/mL, 최대값은 17.9587 μg/mL로 나타났다. 또한 2010-2016년 분리 균주의 평균 EC50 값은 3.8648 μg/mL인데 비해 2020-2021년 분리 균주는 5.9635 μg/mL였다. EC50 값의 범위별 분포도에서는 2010-2016년에는 3.0-4.0 μg/mL에 분포하는 균주 비율이 가장 높았으나 2020-2021년에는 1.0 μg/mL 이하의 균주가 없고 7.0 μg/mL보다 큰 균주의 비율이 가장 높았다. 이러한 결과들로 볼 때 전남북 지역 붉은곰팡이병균의 propiconazole 저항성이 증가하고 있는 것으로 판단되었다(Fig. 2). 붉은곰팡이병균의 triazole계 저항성 정도에 대해서는 중국에서 2007-2008년 분리된 159개 균주 중 tebuconazole과 prochloraz에 대한 EC50 값이 각각 6.235 μg/mL와 4.575 μg/mL인 균주 등 3개가 저항성을 보였다고 하였다[14]. 반면 일본에서는 2012년까지 붉은곰팡이병균의 메트코나졸에 대한 저항성은 발견되지 않았다고 하였다[23]. Talas 등[15]은 독일에서 2008년 분리된 균주의 propiconazole에 대한 EC50 값의 범위가 5.4-62.2 μg/mL, 평균 EC50 값은 22.2 μg/mL라고 하였으며 이는 붉은곰팡이병에 대한 저항성이 약한 듀럼밀의 재배로 인한 잦은 약제 살포 때문이라고 하였다. 국내에도 붉은곰팡이병에 강한 저항성을 가진 품종이 없어 약제 살포 효과가 낮았을 것으로 생각되나 그로 인한 살포 횟수의 증가가 있었는지는 조사가 필요할 것으로 판단된다.
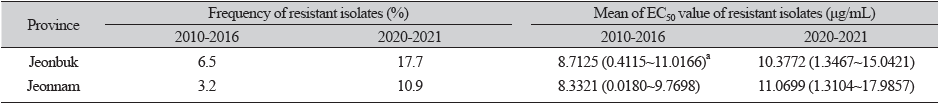
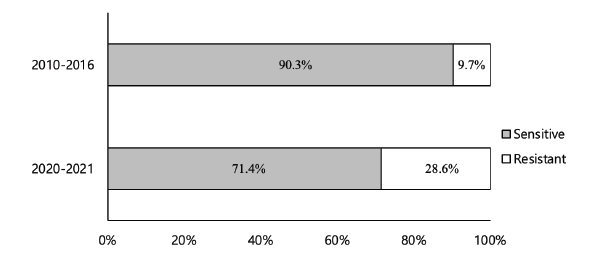
분리 균주의 propiconazole에 대한 저항성 기준을 설정하기 위하여 2010년부터 2016년에 분리한 균주의 균사생장 억제율을 그래프로 나타낸 결과 12개 균주가 저항성으로 그룹화되었으며, 이들의 EC50 값의 범위는 7.2282-11.0166 μg/mL로 조사되었다(Fig. 3). 또한 이 균주들은 약 7 μg/mL의 propiconazole 농도에서 균사생장 억제율이 50% 이하로 나타나 이 농도를 저항성 기준으로 하는 것이 타당한 것으로 생각되었다. 이를 기준으로 했을 때 2010-2016년 분리 균주 중 저항성의 비율은 9.7%였으나 2020-2021년 분리 균주 중에서는 28.6%로 3배 가까이 증가하였다(Fig. 4). 지역별로 보면 전북과 전남 지역 모두 2010-2016년보다 2020-2021년에 저항성 균주 비율이 3배 정도 증가하여 유사한 경향이었다(Table 2). 지역 간에는 전북지역 분리 균주의 저항성 비율이 2010-2016년 6.5%와 2020-2021년 17.7%로 전남지역의 3.2%와 10.9%에 비해 높았으나, 평균 EC50 값은 큰 차이가 없어 이는 조사된 균주 수에 차이가 있었기 때문으로 생각되며 향후 더 많은 균주에 대해 조사할 필요가 있을 것으로 보인다.
Propiconazole은 difenoconazole과 합제로 맥류 붉은곰팡이병에 2010년 등록되었으나 벼 잎집무늬마름병에는 2002년, 이삭누룩병에는 2007년에 등록되었다. 또한 thiophanate-methyl과 합제로 보리 붉은곰팡이병에 2017년 등록되었으나 벼의 잎도열병과 깨씨무늬병 및 잎집무늬마름병에는 2010년, 이삭누룩병에는 2011년에 등록되었다. 이와 같이 propiconazole 합제가 2010년, 2017년에 맥류에 등록되었기 때문에 그 이전에는 사용되지 않았을 것으로 보이지만, 우리나라 대부분의 맥류 재배지는 벼와 이모작을 하고 있어 동일한 재배 포장에서 벼를 대상으로 사용되었을 것으로 추정되며, 해당 지역의 맥류 붉은곰팡이병균의 저항성 발현에 영향을 주었을 것으로 판단된다. Becher 등[16]은 동일 계통 살균제의 지속적인 사용으로 인해 붉은곰팡이병균의 감수성이 줄어들었다고 하였다. 박 등[24]은 2012년 김제와 익산 지역의 밀 재배포장에서 약제들의 붉은곰팡이병 방제효과를 조사한 결과 difenoconazole·propiconazole 유제가 90% 이상의 방제가를 보였다고 하였는데, 이는 그 당시에는 저항성 균의 분포가 높지 않았기 때문으로 추정된다. 그러나 본 연구에서 저항성 균의 분포가 증가한 것으로 판단되기 때문에 propiconazole 합제로 등록된 살균제에 대한 맥류 재배포장에서의 방제효과도 조사할 필요가 있다.
본 연구는 국내 붉은곰팡이병균의 살균제 저항성에 대한 첫번째 보고이다. 비록 조사 연도나 분리 지역이 적은 한계가 있으나 분리시기가 다른 균주들 간의 살균제 저항성의 차이를 볼 수 있었다. 국내 보리나 밀에 등록된 살균제인 difenoconazole, tebuconazole, hexaconazole, metconazole 또한 같은 DMI 계통으로 병원균의 triazole에 대한 노출이 많아 이들 약제에 대한 감수성 변화 및 교차저항성 등도 살펴볼 필요가 있다. 특히 우리나라 벼-맥류 형태의 이모작을 고려할 때, 동일 계통의 약제에 지속적으로 노출될 수 있는 조건이므로 국내 붉은곰팡이병 등록 약제의 저항성 모니터링을 지속적으로 수행하고, 다른 활성 기작을 갖는 약제를 선발하는 등 약제 저항성에 대한 효과적인 관리방안 마련을 위한 노력을 병행하여야 할 것이다.