서론
에르고티오네인은 많은 식물과 동물에서 발견되는 안정적이고 강력한 항산화제이다[1]. 식품에서의 지질 산화는 품질과 풍미를 저하시키고 색상, 질감 및 영양가의 변화에도 영향을 미치며[2], 살아있는 유기체에서 발생하는 지질 산화 과정에서 생성되는 활성산소가 건강 손상과 노화 촉진의 원인이 되는 것으로 잘 알려져 있다[3]. 또한 동맥경화와 흡연 그리고 당뇨병에서 지질 과산화에 대한 저항성과 상관관계가 있다고 알려져 있다[4].
탁월한 항산화, 항염증 효과 등으로 인해 최근 에르고티오네인은 과학계에서 주목을 받고 있다[5]. 이러한 역할로 인해 다양한 질환과 수명과도 밀접한 관계가 있는데, 연구에 따르면 에르고티오네인 섭취율이 낮으면 만성 신경계 질환의 발병율이 높아지고 기대 수명 역시 짧아진다[6]. 일반적으로 사람들은 주로 에르고티오네인을 고기와 버섯을 통해 섭취하는데[7], 고기보다 버섯이 월등히 높은 에르고티오네인 함량을 보인다[8]. 대표적으로 잎새버섯, 양송이, 느타리, 새송이 그리고 표고 등이 에르고티오네인을 가지고 있는 것으로 보고되었고, 이들 중 표고버섯은 우리나라 대표적인 식용 버섯으로 전체 버섯 생산량의 약 15.4%를 차지하며 두번째로 많은 양의 에르고티오네인을 함유하고 있다[9].
표고는 원목과 톱밥을 사용하여 생산된다. 톱밥재배는 원목재배에 비해 월등히 짧은 재배 기간을 가지고 활엽수 자원을 완벽히 사용할 수 있으며 재배과정을 기계화할 수 있는 등의 장점이 있다. 현재까지 국내에 다양한 톱밥재배 표고 품종이 존재하지만 이들의 특성이나 성분을 비교 분석한 연구 자료는 부족한 실정이다.
본 연구에서는 24개 표고 품종을 동일한 환경과 배지 조건에서 자실체를 발생시키고 형태적 특성과 에르고티오네인을 분석하여 형태적 특성이 우수하고 높은 에르고티오네인 함량을 가지는 기능성 표고 신품종 육종 등에 기초자료를 축적하기 위해 연구를 수행하였다.
재료 및 방법
표고 균주
실험에 사용된 균주는 국립산림과학원에서 출원한 표고품종 10개(산림10호: NIFoS 169, 산백향: NIFoS 2778, 산마루1호: NIFoS 2924, 밤빛향: NIFoS 3404, 산산향: NIFoS 3420, 설백향: NIFoS 3876, 산장향: NIFoS 4167, 태향고: NIFoS 4317, 만추향: NIFoS 4329)와 산림조합중앙회 산림버섯연구소에서 출원한 표고품종 15개(산조701호: NIFoS 2462, 산조702호: NIFoS 2463호, 참아람: NIFoS 2464, 산조704호: NIFoS 2465, 산조705호: NIFoS 2466, 산조706호: NIFoS 2467, 산조707호: NIFoS 2468, 산조709호: NIFoS 2470, 산조710호: NIFoS 2471, 산조711호: NIFoS 5663, 산조712호: NIFoS 5664, 산조713호: NIFoS 5665, 산조715호: NIFoS 5666, 산조716호: NIFoS 5667, 산조717호: NIFoS 5668)이다. 모두 톱밥재배용 품종으로 국립산림과학원에 보관되어 있는 균주를 사용하였다. Potato dextrose agar (PDA; Difco, Detroit, Mi, USA) 평판배지에 보관 균주를 접종하고 25℃에서 7일 간 성장한 균사 가장자리를 다시 PDA 평판배지에 계대 배양하여 25℃ 배양실에서 20일간 배양한 뒤 접종원으로 사용하였다.
톱밥배지 제작 및 배양
실험에 사용한 톱밥 배지 재료는 참나무톱밥 85% (상수리나무와 신갈나무 1:1, w:w)에 밀기율 15%의 비율로 혼합하였고 함수율을 65%로 조절하여 약 2.2 kg 사각배지(20 cm×15 cm×10 cm)를 제작하였다. 121℃에서 90분간 고압 멸균하여 만든 사각배지에 10 mm×10 mm 크기의 균사체 조각을 4개씩 접종하였다. 24개 균주를 접종한 모든 사각 톱밥 배지는 CO2 1,000 ppm, 온도 25℃ 배양실에서 암배양 60일, 명배양(300 Lux) 40일로 총100일 배양 후 발생실(온도 18±1℃, 상대습도 85±5%)에서 발생작업을 실시하였다.
자실체 특성 조사
100일간 배양이 완료된 톱밥배지는 비닐봉지를 개봉하여 발생을 진행하였고 발생실 내부온도 18℃, 습도 80%를 유지하였다. 생육중기의 자실체를 배지와 근접하여 절단하여 수확하였다. 수확한 자실체는 표고버섯 갓과 대를 분리하였고 품종 출원을 위한 UPOV (The International Union for the Protection of New Varieties of Plants, 국제 신품종 보호 연맹) 지침에 따라 갓의 직경 및 두께, 대의 길이 및 굵기, 주름살 넓이를 측정하였고[10], 색차색도계(chromameter CR-10 konica Minolta, Japan)를 사용하여 L (lightness), a (redness), b (yellowness)값을 측정하였다.
에르고티오네인 함량 조사
자실체 형태적 특성 조사가 완료된 표고 자실체는 55℃의 건조기에서 3일 동안 건조시키고 막자사발과 막자를 이용하여 고운 가루로 만들었다. 에르고티오네인 추출은 Kim 등[11]이 사용한 방법을 바탕으로 수행하였다. 1 g 건조 표고 가루를 20 mL의 추출 용액(10 mM dithiotreitol [DTT], 100 μM betaine in ethanol, 100 μM 2-mercapto-1-methyl-imidazole [MMI] in 70% ethanol)에 침지하여 1시간 초음파 처리하고 다시 1시간동안 와류하였다. Sodium dodecyl sulfate (SDS) 4 mL를 첨가 후 25℃, 3,000 g에서 10분동안 원심분리 한 뒤에 상층액을 40℃에서 5 mL로 증발시키고 0.2 μm CA 필터(3 mm, Lida, Kenosha, WI, USA)에 여과시켰다. Ultimate3000 HPLC (Thermo Dionex, Germering, Germany)을 사용하여 분석하였고, Inno C-18 컬럼(4.6 × 250 mm, 5 μm; Youngjinbiochrom, Seongnam, Korea)을 사용하였다. 트리에틸아민 1 mL/L와 30% 아세토니트릴 30 mL/L가 포함된 인산염(0.5 M)이 용리제로 사용되었고, 이동상의 유속은 1 mL/min로 10 μL를 주입하여 수행하였다. 254 nm의 파장에서 모니터링 하였고 Authentic L-ergothioneine (Sigma, St. Louis, USA)을 사용하여 표준곡선을 계산하고 에르고티오네인 함량을 정량화하였다.
통계분석
자실체 형태적 특성과 에르고티오네인 함량 결과값의 품종별 상관관계를 알아보기 위하여 SPSS 프로그램(PASW Statistics 18; SPSS INC., Chicago, IL, USA)으로 분산분석 후 Tukey test에 의해 p<0.05 수준에서 사후분석 및 검증하였다.
결과 및 고찰
품종별 자실체 특성
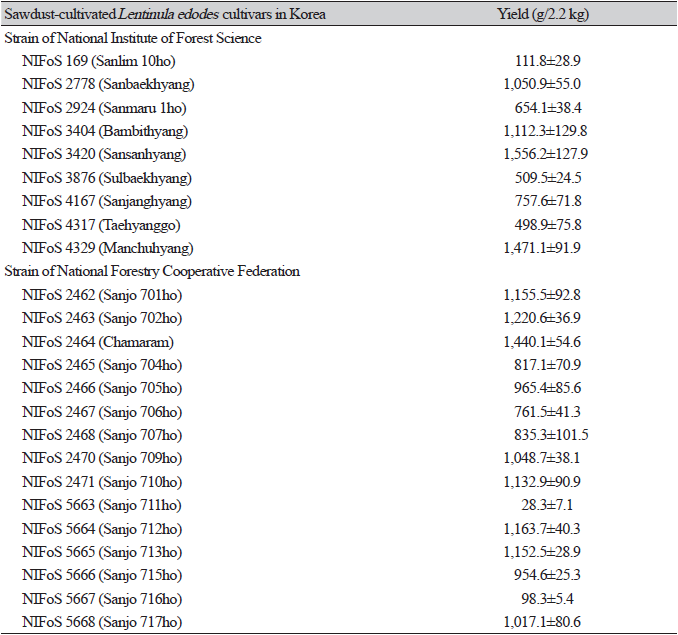
국내 표고 톱밥재배용 품종 24개를 동일한 조건으로 접종, 배양하여 자실체를 발생시켰다(Fig. 1). 2.2 kg 사각배지에서 모두 자실체가 발생했다. 그러나 산조711호의 경우 다른 계통과 달리 발이는 됐지만 일반적인 자실체의 형태로 발달하지 않고 기형인 상태로 자라며 크게 성장하지 못하는 특징을 보였으므로 자실체 형태적 특성조사에서는 제외시켰다. 또한 산조712호 자실체의 갓은 동일조건에서 유일하게 화고가 발생하는 특징을 보였다. Table 1의 자실체 생산량은 산림과학원에서 개발한 만추향이 1,471.1 g/2.2 kg 으로 가장 높았고 반대로 산조716호는 98.3 g/2.2 kg으로 약 15배 적은 생산량을 보이며 품종간 편차가 큰 것을 확인 할 수 있었다. 일반적으로 산림조합 개발품종을 재배하는 경우 봉형 배지를 하우스에서 재배하는 방식을 많이 사용한다[12]. 본 연구에서는 사각배지를 판넬재배사 내 선반에 올려 재배하였고 발생실 온도를 18±1℃, 상대습도 85±5%로 고정하여 발생시켰다. 품종별 생육 특성에 따라 자실체 발이 및 생장에 영향을 받은 것으로 사료된다.
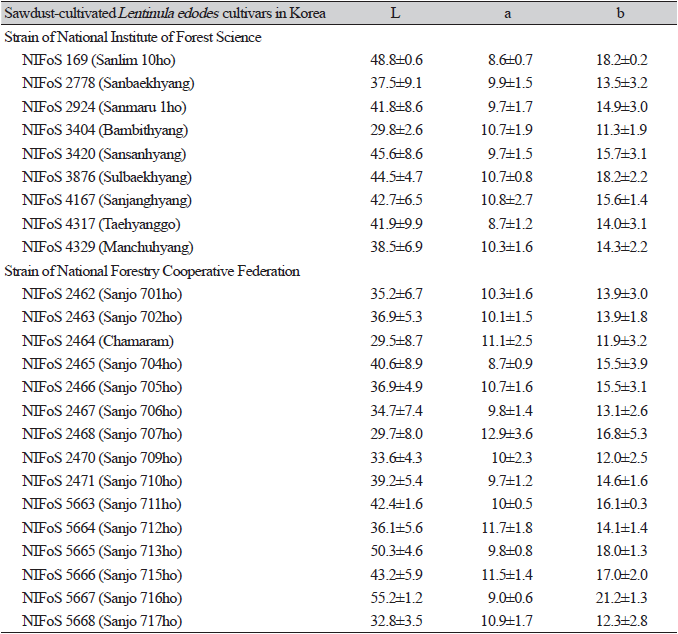
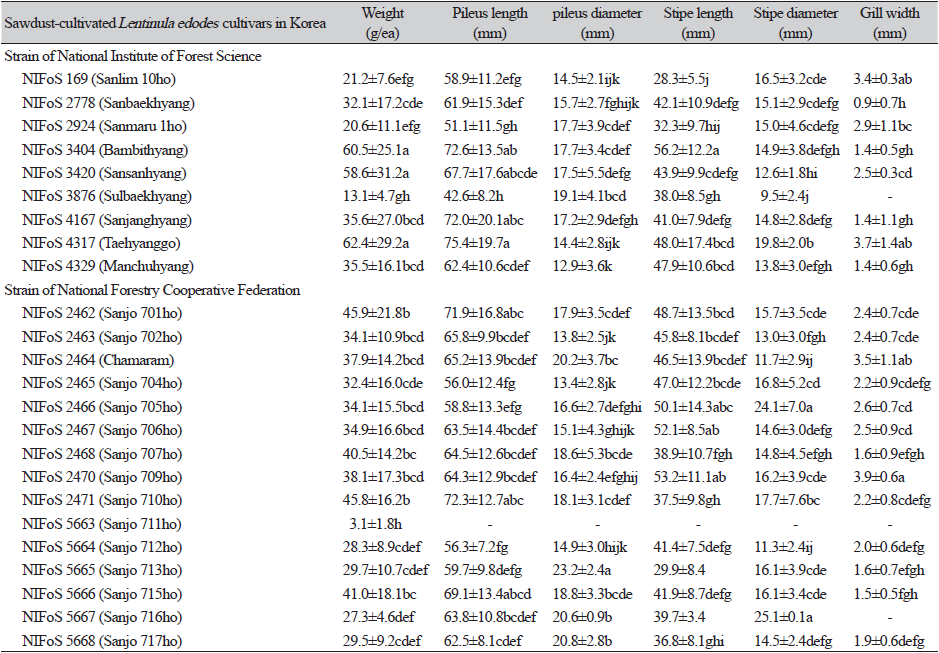
자실체 갓을 색도계로 측정한 결과는 Table 2와 같다. 명도값을 나타내는 L값은 참아람이 가장 낮았고 산조716호가 가장 높게 나타났으며 적색과 녹색의 정도를 나타내는 a값은 산조707호, 황색과 청색의 정도를 나타내는 b값은 산조716호이 가장 높게 나타났다. 표고 자실체의 갓 직경, 갓 두께, 대 길이, 대 굵기, 주름살 넓이를 조사 결과는 Table 3에 나타내었다. 갓 직경은 태향고가 가장 컸으며 설백향이 가장 작았다. 갓 두께는 산조713호가 가장 두꺼웠고 만추향이 가장 얇았다. 대의 길이는 밤빛향이 가장 길었으며 산림10호가 가장 짧았고, 대 굵기는 산조705호가 가장 두껍고 설백향이 가장 얇았다. 주름살 넓이는 산조709호가 가장 넓었으며 설백향과 산조716호에는 주름살이 존재하지 않아 측정이 불가했다.
자실체 부위별 에르고티오네인 함량
에르고티오네인은 무색 무취의 다소 특이한 베타인 아미노산으로 L-히스티딘으로부터 중간 전구체인 헤르시닌을 거쳐 시스테인에서 유래된 황의 결합을 통해 생합성되며[13], 생물에 따라 합성경로에는 약간의 차이를 보이기도 한다[14]. 버섯에서는 현재까지 팽이버섯과 잎새버섯에서 에르고티오네인 생합성에 관여하는 효소가 확인되었다[15,16]. 표고 에르고티오네인 합성에 관여하는 효소는 아직까지 밝혀지지 않았으므로 분자 매커니즘에 대한 이해와 연구가 필요하다. 생체 내 에르고티오네인의 대표적인 역할은 항산화제, 항염증제, 방사선에 대한 보호제 그리고 질병예방 등이 있으며 이러한 이점으로 매우 가치있게 여겨진다[13].
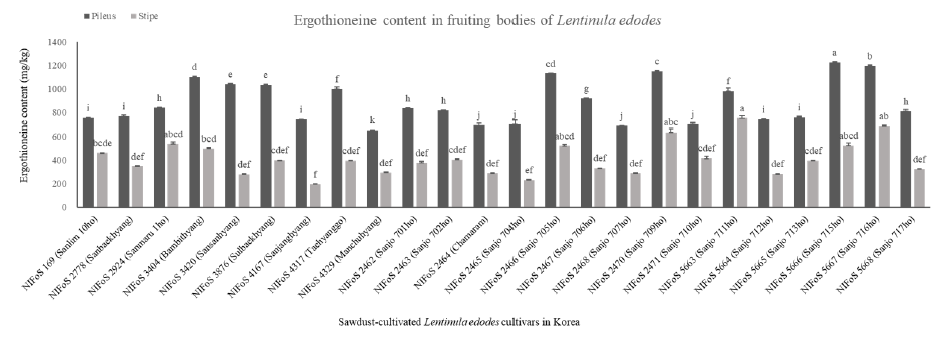
본 연구에서는 국내 톱밥재배 품종 24개의 자실체 갓과 대를 분리하여 각각의 에르고티오네인 함량을 분석하였다. 그 결과 품종마다 에르고티오네인 함량이 상이한 것을 확인 할 수 있었다. 품종간 기능성 물질 함량 차이는 기존의 표고버섯의 성분과 항산화 특성 분석 연구를 통해 확인됐다. 5가지 표고품종(산림2호, 산림4호, 산림5호, 산림7호, 산림9호)의 일반성분, 아미노산, 무기산, 아미노산 그리고 유리당 분석 연구와[17], 9가지 품종(다산향, 천백고, 풍년고, 수향고, 백화향, 천장1호, 천장2호, 산림5호, 산림7호)의 항산화 활성을 비교한 결과를 통해 품종별 차이를 확인하였다[18]. 또한 버섯 자실체 부위별로도 기능성 물질의 함량 차이가 존재했다. 베타글루칸의 경우 자실체 갓보다 대에서 높은 함량을 확인 할 수 있었지만 표고 자실체의 에르고티오네인 함량의 경우 갓 부위가 대 부위보다 약 절반 가량 높은 것을 확인 할 수 있었다. 24개 품종 중 산조715호에서 1,225 mg/kg으로 가장 높은 에르고티오네인 함량이 확인되었고 대 부위는 산조711호에서 753 mg/kg으로 함량이 가장 높았다(Fig. 2).
표고 신품종 육종을 위한 방법에는 이핵균사 일핵균사간의(Di-Mon)교배와 일핵균사간의(mono-mono) 교배법이 있다. Di-Mon 교배의 장점은 우선 단포자 분리의 어려움이 줄어들어 편리하며 한쪽 모균주의 단포자가 얻어지지 않을 때에도 교배가 가능하다. 이러한 장점으로 한쪽 모균주가 자실체를 형성하지 않거나 포자를 만들지 않는 경우도 교배에 사용할 수 있다[19]. 국립산림과학원에서 Di-Mon 교잡으로 육종한 표고 품종은 산림7호, 수향고, 천백고, 풍년고 등이 있다[20-23]. 단포자 교배는 Di-Mon교잡에 비해 교잡 확인이 빠르다. 단포자 균주는 이핵균주 생성에 높은 확률로 영향을 주며 자실체 발생과 생산량에 영향이 준다는 보고가 있었으며[24], Ka [25] 등은 우량하다고 판단되는 균주에 일정 특정 단포자가 반복적으로 포함되는것으로 확인하였다. 이로 미루어보아 단포자는 자실체 품질에 영향을 미치는 것을 확인 할 수 있었다. 또한 기존의 연구에서 단포자 교잡으로 얻은 11개 균주에서 자실체를 발생시키고 에르고티오네인 함량을 확인한 결과 모균주보다 높은 에르고티오네인 함량을 가지는 교잡균주를 확인할 수 있었고 이를 통해 기능성 물질 역시 단포자에 의해 영향을 받는다는 사실을 확인할 수 있었다[11]. 이번 실험을 통해 확인된 생산량이 높고 자실체의 형태가 우수한 품종과 에르고티오네인 함량이 높은 균주간 교잡을 통해 에르고티오네인 함량이 높고 형태적으로도 우수한 교잡 품종 육성이 가능할 것으로 기대한다.
ACKNOWLEDGEMENT
This study was supported by the Golden Seed Project of ‘Breeding of new strains of shiitake for cultivar protection and substitution of import [213007-05-5-SBH10]’ provided by the Ministry of Agriculture, Food and Rural Affairs, Ministry of Oceans and Fisheries, Rural Development Administration and Korea Forest Service and a grant from the General Project (FP0800-2020-01) of the National Institute of Forest Science, Republic of Korea.