서론
과수화상병은 식물병원세균 Erwinia amylovora에 의해 발생하는 병해로 세계적으로 사과와 배 재배 지역에 막대한 피해를 입히고 있는 중요한 병이다[1]. E. amylovora는 검역상 금지병원균으로 지정되어 있으며, 국내에서는 2015년 경기도 안성시 배나무 과원에서 처음으로 발생이 보고된 이후 매년 지속적으로 발병되고 있다[2]. 현재 화상병 발생지역에서 병이 발생한 과원은 발생주율이 5% 이상일 경우 해당 과원의 기주식물을 전체 매몰하는 공적 방제를 시행하고 있어[3], 국내에서 재배, 생산하고 있는 사과와 배 산업에 피해가 누적되고 있는 실정이다.
화상병 방제를 위해서는 동절기에 형성된 궤양의 제거 및 동제(구리제) 처리 등을 통해 과원 내 전염원을 줄이고, 개화기에 적절한 약제를 처리하여 감염을 방지해야 한다[4]. 특히 적절한 개화 시점에 항생제를 처리할 경우 방제 효과가 높기 때문에 개화기 약제 살포는 화상병 방제에서 매우 중요하다. 하지만 지속적으로 많은 양의 항생제를 살포하면 항생제 저항성 균주가 발생하게 되어 방제 효과가 크게 감소할 수 있다는 점이 우려되고 있다[5,6]. 이러한 이유로 기존 항생제를 이용한 화학적 방제의 대안으로써 생물적 방제 방법이 제시되고 있다.
현재 세계적으로 화상병 방제에 이용되고 있는 미생물 제제로는 Bacillus subtillis strain QST713, Pseudomonas fluorescens strain A506, Pantoea agglomerans strain E325, P. vagans strain C9-1, Aureobasidium pullulans strain DSM14940, strain DSM14941 등이 알려져 있다[1,7]. 특히 A. pullulans는 멜라닌을 생성하여 검은색의 균총을 형성하는 특징을 가지는 흑효모로, 토양과 식물체 표면에 흔히 부생하며 다양한 식물병원균에 길항 능력이 있는 것으로 알려져 있다[8,9]. A. pullulans는 주로 사과 수확 후 저장 중 Penicillium expansum, Botrytis cinerea 등의 진균에 의해 발생하는 부패병을 억제하기 위해 이용되어 왔다[10]. 최근 해외에서 사과 과실로부터 분리된 2종의 A. pullulans 균주(DSM14940, DSM14941)가 사과 꽃에서 화상병 감염을 억제하는 효과가 확인되었고, 현재 Blossom protectTM (bio-ferm, Tulln, Austria)라는 제품으로 상용화되어 화상병 방제에 이용되고 있다[11]. 그러나 국내에서는 아직 화상병 꽃 감염에 대해 방제효과를 나타내는 A. pullulans 균주가 분리되었다는 보고는 없다.
현재 국내 화상병 방제용으로 등록된 미생물제제는 Bacillus 속의 3개의 균주와 박테리오파지가 있으며 대부분이 원제를 해외에서 수입하는 실정이다. 따라서 특정 종류의 길항 세균에 치중된 화상병 방제용 미생물제제의 다양화가 필요하며, 국내에서 분리된 균주를 활용한 미생물제제의 제품화에 대한 요구가 대두되고 있다.
본 연구는 국내 배나무 꽃에서 분리한 효모의 형태적 특성 및 유전자 염기서열 분석을 통해 종을 동정하고, 사과와 배의 미숙과와 꽃사과의 꽃을 대상으로 화상병 발병 억제효과를 확인하고자 수행하였다.
재료 및 방법
배나무 꽃에서 효모 균주 분리 및 동정
2021년 3월에 전북 완주군 국립원예특작과학원 내 배나무 포장에서 효모균의 분리 및 동정을 위해 꽃이 달린 배나무 가지를 100점 수집하였다. 효모균 분리는 배나무 꽃을 70% 알코올에 30초간 침지 한 후 1% NaOCl에 5분 침지하여 표면 소독을 실시하였고, 표면 소독 후 멸균수로 3번 세척하고 건조하여 시료를 준비하였다. 배나무 꽃의 암술머리 시료를 멸균수 100 μL에 담가 마쇄한 후, 그 중 10 μL를 YPD (yeast extract-peptone-dextrose; BD DifcoTM, Sparks, MD, USA) 배지에 획선도말하여 2일간 27℃에서 배양한 후 효모균을 분리하였다. 분리된 효모균은 PDA (potato dextrose agar; BD DifcoTM, Sparks, MD, USA) 배지 중앙에 치상하여 14일간 배양하였고, 현미경상에서 효모균의 단포자를 분리하여 PDA 사면배지에 획선도말한 후 10℃에 보관하며 실험에 사용하였다. 분리한 효모균의 동정을 위하여 PDA 배지에 치상한 후 25℃에서 14일간 배양한 균총으로부터 균사와 포자의 형태 및 크기를 현미경으로 조사하였다.
Aureobasidium속 효모의 분자계통학적 분석
효모균의 유전적 동정을 위해 효모균의 핵산(전체 genomic DNA)을 추출한 후 바이오닉스(Bionics, Seoul, Korea)에 염기서열 분석을 의뢰하였다. 핵산 추출은 효모균이 자란 배지 절편을 20 mL의 PDB (potato dextrose broth; BD DifcoTM, Sparks, MD, USA) 배지에 넣어 25℃에서 14일간 배양하였고, 균사체를 회수하여 동결건조한 후 잘게 마쇄하였다. 이후 DNA 추출 키트(Maxwell® RSC PureFood GMO and Authentication Kit, Promega AS1600, Madison, Wisconsin, USA)를 사용하여 DNA를 분리하였다. Large-subunit (LSU) 26S ribosomal DNA의 D1/D2 영역과 internal transcribed spacer (ITS) 영역을 NL1 (5'-GCATATCAATAAGCGGAGGAAAAG-3'), NL4 (5'-GGTCCGTGTTTCAAGACGG-3') 프라이머와[12] ITS1 (5'-TCCGTAGGTGAACCTGCGG-3'), ITS4 (5'-TCCTCCGCTTATTGATATGC-3') 프라이머[13]를 이용하여 PCR 증폭하고 염기서열을 확보하였다. 이후 MEGA version 7.0.26에서 maximum likelihood tree로 bootstrap 횟수를 1,000반복으로 설정하고 Juke-Cantor model로 선택하여 계통수를 작성하였다.
Aureobasidium pullulans MHAU2101의 E. amylovora에 대한 생육 억제 효과 검정
A. pullulans MHAU2101를 14일간 PDA에서 배양한 후 멸균수를 붓고, scraper로 긁어 OD600에서 0.5로 조정하여 현탁액을 제조하였다. E. amylovora TS3128은 TSA 배지에서 단일 콜로니를 분리한 후 10 mM MgSO4에 OD600에서 0.5로 조정하여 접종원(세포현탁액)을 제조하였다.
사과와 배의 미숙과는 표면을 70% 알코올로 소독하고 멸균수로 3회 세척한 후, 상처 접종을 위해 멸균된 200 μL 파이펫 팁으로 1 cm 깊이로 찔러 2-3개의 구멍을 내었다. 그중 1-2개의 구멍에는 A. pullulans MHAU2101, 다른 하나의 구멍에는 멸균수를 각각 2 μL씩 넣어 25℃에서 2일간 배양하였다. 그 후, E. amylovora 접종원을 미숙과의 모든 구멍에 2 μL씩 접종한 뒤 접종한 미숙과는 플라스틱 상자에 넣고 뚜껑을 닫아 25℃에서 7일간 배양하여 접종 부위 주변의 수침상 및 갈변화 정도와 세균분출액 생성 여부를 확인하였다.
Aureobasidium pullulans MHAU2101의 화상병 꽃 감염 방제 효과 검정 및 꽃에서 E. amylovora의 밀도 변화 조사
꽃사과 꽃에서 효모균의 화상병 방제 효과를 확인하기 위해 미숙과 검정 실험과 같은 방법으로 효모균 현탁액(OD600=0.5)을 제조하여, E. amylovora 접종 2일 전 꽃사과 한주 당 20 mL씩 분무 처리하였다. 대조 약제로 스트렙토마이신 수화제는 희석배수 2,000배로 물에 희석하여 E. amylovora 접종 1일 후 꽃사과에 한주 당 20 mL씩 분무 처리하였으며, 처리 효과를 비교하기 위해 E. amylovora 접종 2일 전 동일한 양의 멸균수를 분무한 꽃사과를 무처리구로 설정하였다.
E. amylovora TS3128 접종원은 10 mM MgSO4에 1×106 cfu/mL 농도로 현탁하여 꽃이 만개한 꽃사과에 한주 당 20 mL씩 분무 접종하였고, 접종 후 꽃사과는 25℃로 유지되는 생장실에서 5일간 보관하며 병 발생을 유도하였다. 접종 5일 후 처리구당 100개 이상의 꽃에서 수침상 및 갈변, 세균분출액 생성 여부를 기준으로 꽃 감염률을 조사하였고, 방제가는 아래와 같이 계산하였다.
방제가(%)=(1–처리구 꽃 감염률/무처리구 꽃 감염률)×100
효모균 처리에 따른 꽃 부위별 E. amylovora의 밀도를 조사하기 위해 효모균 처리구와 무처리구에서 암술머리를 포함한 암술대와 화통을 채집하였다. 이후 시료에서 핵산을 추출(Plant DNA extraction kit, Qiagen, Hilden, Germany)한 후 과수화상병 진단 키트(HelixDtecTM EAEP-T100, NanoHelix, Daejeon, Korea)로 real time PCR 검정을 수행하였다. 실험 방법은 제조사의 실험방법에 따라 수행하였다.
통계분석
A. pullulans MHAU2101의 화상병 꽃 감염 방제 효과 검정 시 처리구와 대조구는 완전임의배치법으로 배치하였고, 처리구는 5반복으로, 대조구는 3반복으로 수행되었다. 통계분석은 R 4.0.4 패키지(R Core Team, 2021)와 RStudio 1.4 (Rstudio, 2021)를 사용하여 수행되었다. 꽃 감염률은 평균값에 대한 표준편차를 표시하였고, 평균 간 비교는 Duncan’s multiple range test (DMRT)로 수행하였다(p≤0.05).
결과 및 고찰
배나무 꽃에서 분리된 효모균의 동정
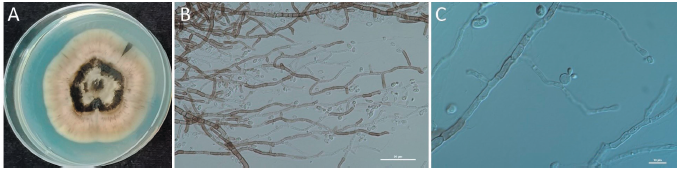
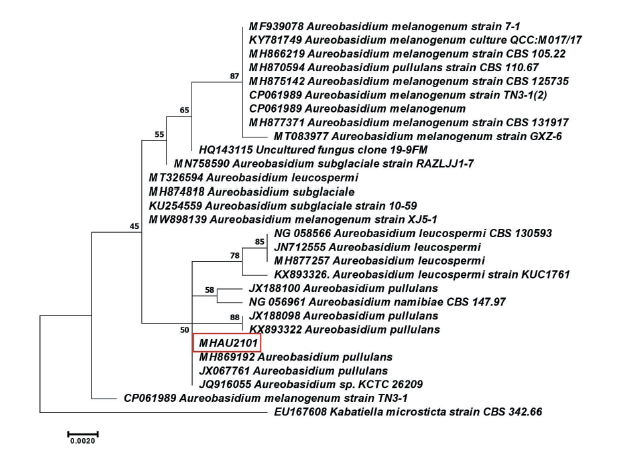
배나무 꽃에서 분리된 효모균의 PDA 배지에서의 형태적 특성을 조사한 결과, 배양 초기에는 크림색 내지 옅은 분홍색으로 자라다가 시간이 지나면 어두운 색소를 형성하는 것으로 나타났다(Fig. 1A). 또한 현미경상에서 어두운 색소를 가진 균사와 swollen cell에서 출아포자(blastospore)를 형성하는 것을 관찰할 수 있었다(Fig. 1B and 1C). 분리된 효모 균주의 동정을 위해 large-subunit (LSU) 26S ribosomal DNA의 D1/D2 영역의 염기서열을 분석한 결과, A. pullulans와 같은 그룹을 형성하였고, 같은 그룹 내 99.8-100%의 상동성을 나타내었다(Fig. 2). ITS영역의 염기서열을 분석한 결과 역시 A. pullulans와 동일한 그룹으로 나타났으며, 같은 그룹 내 99.6-100%의 상동성을 보였다(데이터 미제시). Aureobasidium속 균은 배양 초기에 크림색, 옅은 분홍색 내지 연갈색을 띠는 균총의 형태를 보이다가 후기로 갈수록 멜라닌을 형성하면서 점차 어두운 색의 균총을 형성하는 것으로 알려져 있다[14]. 이전 연구에서 A. pullulans는 PDA나 MEA (malt extract agar) 배지에서 3주 이내에 분홍빛을 띤 균총이 점차 검게 변한다고 하였는데[15], 본 연구에서 분리한 균주도 2주 정도에 균총이 검게 변한 것을 볼 수 있었다. 그러나 Kim 등[16]은 국내 전라도 지역의 꽃에서 분리한 A. pullulans균주 중에는 7일내에 이미 검은색을 띠는 균주가 있는 것으로 보아 변종이 많은 Aureobasidium속은 형태적 특성과 생리적 특성 및 LSU, ITS 영역의 유전자 분석 등 다각적인 방법을 통해 동정해야 한다고 하였다. 본 연구에서 A. pullulans로 동정 된 균주는 국립농업과학원 미생물은행(http://genebank.rda.go.kr)에 A. pullulans MHAU21 (KACC 93372P)로 기탁하였다.
Aureobasidium pullulans MHAU2101의 E. amylovora에 대한 생육 억제 효과 검정
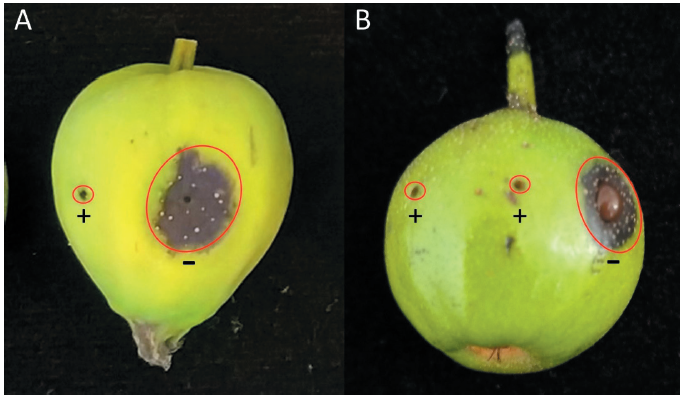
A. pullulans MHAU2101 또는 멸균수 처리 2일 후 E. amylovora를 접종하여 7일간 배양한 결과, 사과와 배의 미숙과 모두 멸균수를 처리한 접종 부위 주변에서 수침상이 형성되고 갈색 또는 검은색의 병반이 나타나며 세균분출액이 관찰되었다. 그러나 A. pullulans MHAU2101을 처리한 경우에는 접종 부위 주변에 수침상 및 갈변 증상이 나타나지 않았고 세균분출액 또한 관찰되지 않아, A. pullulans MHAU2101이 E. amylovora에 대해 생육 억제 효과가 있음이 확인되었다(Fig. 3).
생물적 방제 시 처리 미생물제제가 병원균보다 선제적으로 감염 부위에 정착하여 제한된 양분과 서식 장소에 대해 경쟁하는 것이 병원균을 억제하는 주 요인으로 알려져 있다[17,18]. Bencheqroun 등[19]의 연구에 따르면 A. pullulans가 사과 저장 중 P. expansum에 의해 발생하는 부패병을 방제하는 기작은 사과 표면의 양분, 특히 아미노산에 대해 경쟁하여 P. expansum의 분생포자 발아를 억제하는 것으로 보고하였다. 또한 A. pullulans는 E. amylovora보다 기주 식물 표면에 빠르게 증식하여 양분과 서식 장소를 선점함으로써 E. amylovora의 생장을 억제하며, A. pullulans에 의해 조성되는 산성 환경은 이를 더욱 촉진한다고 알려져 있다[20].
본 실험 결과 역시 사과와 배의 미숙과에 처리된 A. pullulans MHAU2101이 과실의 상처 부위에 선제적으로 정착하여 증식하였고, 이후 접종된 E. amylovora와 서식 장소 또는 양분에 대해 경쟁하여 E. amylovora의 생육을 억제하였기 때문에 병 발생이 억제된 것으로 사료된다.
Aureobasidium pullulans MHAU2101의 화상병 꽃 감염 방제 효과 검정
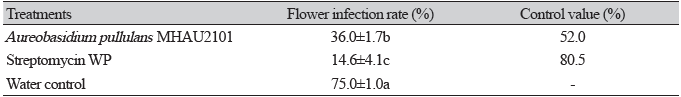
E. amylovora 접종 5일 후 꽃사과 꽃을 관찰한 결과, 암술, 씨방, 꽃받침이 갈변되어 마르고 세균액이 분출되는 화상병 병징이 나타났으며, A. pullulans MHAU2101 처리구는 무처리구에 비해 꽃 감염률이 유의하게 낮았다(Fig. 4; Table 1). A. pullulans MHAU2101의 화상병 꽃 감염 방제효과를 검정하기 위해 처리별 꽃 감염률을 방제가로 산출한 결과, A. pullulans MHAU2101을 처리하였을 때 방제가는 52.0%이고 대조 약제인 항생제 스트렙토마이신 수화제를 처리하였을 때 방제가는 80.5%였다(Table 1). A. pullulans MHAU2101은 스트렙토마이신 대비 64%의 방제효과를 보여 국내 배 꽃에서 분리한 A. pullulans MHAU2101이 화상병 방제에 효과가 있음을 확인하였다. 이는 사과 과실에서 분리된 2종의 A. pullulans 균주(strain CF10, CF40)를 E. amylovora 접종 24시간 전 사과 꽃에 처리 할 경우 스트렙토마이신과 유사한 수준의 방제 효과가 있다고 보고한 Kunz [11]의 연구결과와, 사과나무 과원에서 사과 꽃에 적화제를 처리한 후 A. pullulans를 처리할 경우 스트렙토마이신에 준하는 방제 효과가 있다고 보고한 Johnson과 Temple [21]의 연구결과와 유사한 경향의 결과였다. 그러나 Duffy 등[22]은 같은 농도의 A. pullulans 현탁액을 처리하더라도 사과나무 품종에 따라 화상병 방제효과가 차이가 있음을 보고하였다. 따라서 본 연구에서 사용된 꽃사과 외에도, 국내에서 주로 재배되고 있는 사과 또는 배 품종에 대한 A. pullulans의 화상병 방제 효과 연구가 추가로 요구된다.

Fig. 4. Symptoms of blossom blight in crab apple 5 days after inoculation of Erwinia amylovora TS3128. Treatment of streptomycin on blossoms 1 day after inoculation of Erwinia amylovora TS3128 (A), treatment of Aureobasidium pullulans MHAU2101 on blossoms 2 days before inoculation of Erwinia amylovora TS3128 (B), water control (C).
외국에서는 두 종류의 A. pullulans 균주(strain DSM14940, DSM14941)가 화상병 방제제로 상용화된 Blossom protectTM (bio-ferm, Tulln, Austria) 제품의 경우 수화제로 개발되었으며, 방제효과를 높이기 위해 산성 버퍼인 Buffer protectTM (bio-ferm, Tulln, Austria) 제품과 함께 사용하도록 권장된다[11,23]. 국내에서 분리한 A. pullulans MHAU2101 역시 화상병 방제제로 상용화되기 위해서는 포장 환경에서의 건조 및 자외선에 견딜 수 있고, 방제효과를 극대화할 수 있는 제형화 개발이 필요하다. 또한 A. pullulans MHAU2101의 적절한 처리 농도 및 처리 시기, 포장 환경에서의 방제 효과에 관한 연구가 추가로 요구된다.
Aureobasidium pullulans MHAU2101 처리에 따른 꽃에서의 E. amylovora의 밀도 변화
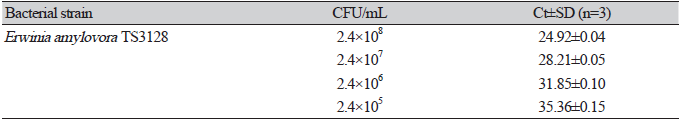
꽃은 화상병의 주요 감염 부위로, E. amylovora는 암술머리에서 암술대를 통해 화통의 화밀공으로 이동하여 식물체 내로 침입하는 것으로 알려져 있다[21]. 본 실험은 E. amylovora가 접종된 A. pullulans MHAU2101 처리구와 무처리구 꽃사과의 꽃 부위별 E. amylovora의 밀도 변화를 조사하여 A. pullulans MHAU2101의 화상병 방제 효과를 확인하고자 수행하였다. 최근에는 E. amylovora를 신속하게 검출하기 위해서 다양한 real time PCR 검사법이 개발되어 화상병 진단 및 정량 분석에 활용되고 있다[24]. 국내에서 시판 중인 과수화상병 진단 키트를 활용하여 꽃 부위별 E. amylovora의 밀도를 조사하였으며, 시판 중인 진단 키트의 E. amylovora 검출 한계는 2.4×105 cfu/mL이고 Ct (cycle threshold)값은 35.36이였다(Table 2).
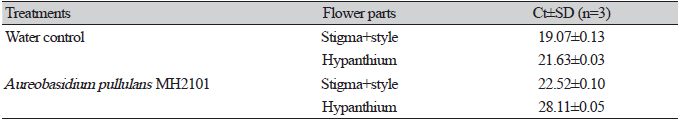
꽃사과 꽃에 E. amylovora만 접종한 무처리구의 경우 접종 5일 후 암술에서의 Ct값은 19.07, 화통에서의 Ct값은 21.63으로 꽃에서 E. amylovora가 2.4×108 cfu/mL 이상의 높은 밀도로 유지됨을 확인할 수 있었다(Table 2 and 3). A. pullulans MHAU2101 처리구의 경우 접종 5일 후 암술에서의 Ct값은 22.52, 화통에서의 Ct값은 28.11로 암술과 화통 모두 E. amylovora의 밀도가 무처리구에 비해 낮았으며 특히 화통에서 2.4×107 cfu/mL로 밀도가 더 낮은 특징이 있었다(Table 2 and 3). 이는 Blossom protectTM (A. pullulans DSM14940, DSM14941)를 처리하였을 시 무처리구 대비 사과 꽃에서의 E. amylovora 밀도가 감소한 Lee 등[25]의 연구결과와 유사하였고, A. pullulans를 처리하였을 때 암술머리에서의 E. amylovora 밀도가 무처리에 비해 1,000배 감소한 Duffy 등[22]의 연구결과와 유사하였다. A. pullulans는 E. amylovora가 증식하는 암술머리와 침입하는 화통의 화밀공 부위에서 서식 장소와 양분에 대해 경쟁함으로써 화상병 발생을 억제한다고 알려져 있다[26]. 특히 A. pullulans는 다른 길항 세균과 비교하여 암술머리뿐만 아니라 화통에서도 잘 증식하며, 이는 A. pullulans가 꽃에서 화상병 감염을 예방하는 주 요인으로 여겨지고 있다[21]. 본 실험에서 A. pullulans MHAU2101 처리구가 무처리구에 비해 암술과 화통에서 E. amylovora의 밀도가 낮았던 이유 또한 A. pullulans MHAU2101가 사전 처리되어 암술머리와 화통을 선점하여 증식함으로써 E. amylovora와 서식 장소와 양분에 대해 경쟁하여 E. amylovora의 증식 및 감염을 억제하였기 때문으로 사료된다.