생물다양성 협약은 생물다양성의 보존, 지속가능한 이용, 이익 분배의 이유로 중요한 국제협약 중 하나이다. 이에 따라 생물자원의 주권 확보와 보존 및 지속가능 한 이용의 중요성은 날로 증가하고 있다. 특히, 섬의 동식물들은 희귀생물들로 구성되어 있어 생물다양성 확보에 중요한 역할을 하지만 최근 기후변화에 따른 해수면 상승과 해양오염 등에 의한 생태계 문제로 인해 섬지역의 생물다양성 확보가 필요하다[1].
독도는 크게 동도와 서도로 구분되고, 크고 작은섬이 89개로 구성되어 있다. 기후는 한류와 난류가 접하는 완대류해역에 속하고, 연평균 기온이 약 12℃이며, 내륙과는 차별된 기후 조건을 가진다. 또한, 차별된 기후영향과 강한바람, 염류, 강우로 인한 유기영양분 유실로 인해 독특한 식생을 형성하고 있다[2].
독도에 서식하는 식물로는 29과 48속 49종 1아종 3변종 총 53종류의 식물상이 조사되었다[3]. 이중 왕호장근(Fallopia sachalinensis)은 마디풀과 여러해살이 초본으로 울릉도, 유럽, 북미, 일본에서 자생하는 식물로 알려져 있고 독도에서는 서도에서 군락지가 확인되었다[3,4].
식물이 생장하고 있는 토양에는 여러 종류의 미생물들이 공존하며, 식물생장촉진과 병 억제를 유도하는 유용 미생물도 존재한다[2,5]. 식물의 근권, 근면, 뿌리내생에 서식하며 식물에 생장 촉진 효과를 나타내는 진균류를 식물생장촉진균류(plant growth promoting fungi, PGPF)라 하며, Aspergillus속, Trichoderma속, Phoma속, Penicillium속, Fusarium속, Rhizoctonia속 등의 진균류가 알려져 있다[2,5]. 독도 자생 식물 뿌리에서 분리된 진균류가 지베렐린(gibberellins)을 생산한다는 보고가 알려져 있고, 독도의 미생물 관련 발굴 연구 보고에서는 주로 원핵생물의 신종/미기록종 발굴에 대한 연구가 많이 알려져 있지만[6], 진균에 대한 신종/미기록종 발굴 보고는 거의 이루어져 있지 않아 발굴 가능성이 높은 지역이다[2,6,7]. 최근에 군집 분석 연구가 활발하게 진행되고 있어 독도의 토양에서 분리배양이 어렵거나 미발굴종에 대한 진균 정보를 토대로 신종/미기록종 발굴이 활발하게 진행될 수 있을 것이다[7].
염분이 높은 토양 특성과 척박한 환경인 독도에 자생하는 식물의 근권토양에 분포하는 진균류의 다양성 조사 및 식물 생육과 연관된 진균류 발굴 연구 결과 국내에 보고되지 않는 진균류가 분리되었다. 본 연구에서 독도 왕호장근 근권에서 분리된 국내에 보고되지 않은 진균에 대한 분류학적 특성을 보고하고자 한다.
2020년도에 독도 서도(37.24167, 131.86422)에서 서식하는 왕호장근의 근권 토양시료 50 g을 채집하여 진균분리에 사용하였다. 채집한 시료 5 g을 멸균수에 10배 희석하여 30분간 교반한 뒤 10-5까지 순차적으로 희석하였다. 각각의 희석된 토양시료액 20 μL를 WA 배지에 도말 후 25℃에서 5일간 암배양하였다. 생장한 진균들의 균총을 확인하고 PDA (potato dextrose agar)배지에 계대배양하여 순수분리한 배양체를 확보하였다. 분리한 진균들은 4℃에 보관하며 다음 실험에 사용하였다.
분리한 진균들을 동정하기 위해 형태적 특징과 분자생물학적 특징을 조사하였다. 형태적 특징을 조사하기 위해 PDA배지에 접종 후 25℃에서 7일간 암배양 후 생장량과 균총의 특징을 확인하였다. 또한 동일 조건에서 5일간 배양한 균주들은 광학현미경(Eclipse E800, Nikon, Tokyo, Japan) 하에서 현미경적 특징을 관찰하였고 카메라(DS-Fi1, Nikon)를 이용하여 화상정보를 획득하였다. 분자생물학적 특징을 조사하기 위해 분리균들을 PDB배지에서 25℃에서 3-5일간 진탕배양하였다. 생장한 균사를 수확하여 동결건조 한 뒤 RNeasy® Plant Mini Kit (Qiagen, Hilden, Germany)의 공시방법으로 DNA를 추출하였다. ITS1F (5′-CTT GGT CAT TTA GAG GAA GTA A-3′) [8]와 ITS4 (5′-TCC TCC GCT TAT TGA TAT GC-3′) [9] 프라이머를 사용하여 1차 PCR을 수행하였다. ITS결과에 따라 LR0R (5′-ACC CGC TGA ACT TAA GC-3′)과 LR7 (5′-TAC TAC CAC CAA GAT CT -3′) 프라이머[10]를 사용한 LSU (large subunit)영역 또는 bt2a (5′-TCC CCC CGT CTC CAC TTC TTC ATG -3′) [11]와 T22 (5′-TCT GGA TGT TGT TGG GAA TCC-3′)[12] 프라이머를 사용한 beta-tubulin영역을 증폭하였다. 증폭된 PCR산물은 제노텍(https://www.genotech.co.kr/)에 염기서열 분석을 의뢰하였다.
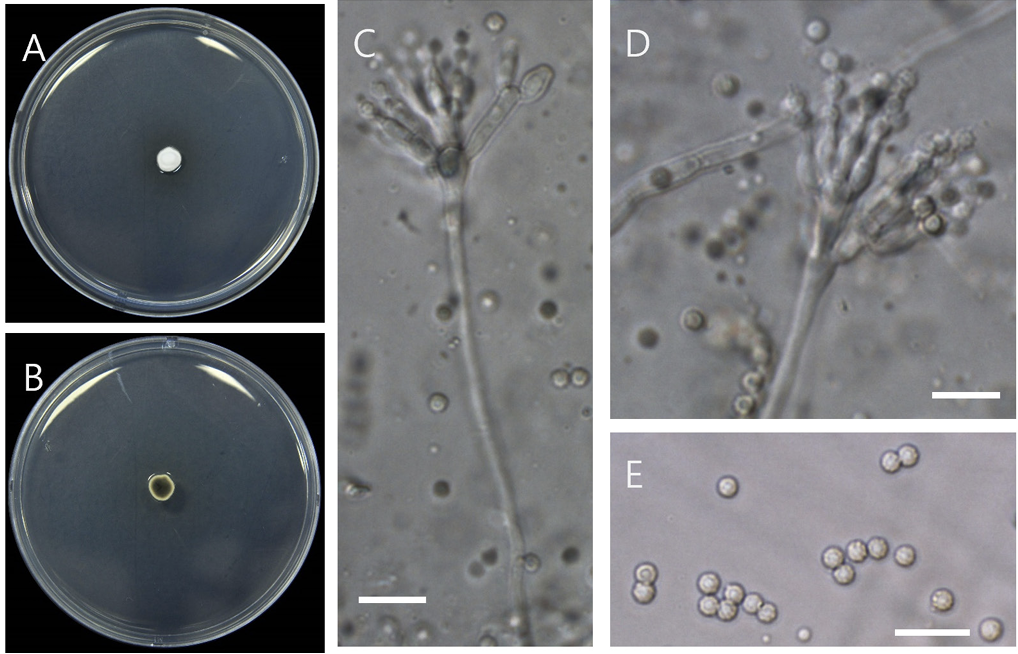
Penicillium striatisporum Stolk, Antonie van Leeuwenhoek 35 (3): 268 (1969) [MB#335769] [NIBRFGC000509145]
PDA에서 25℃ 7일간 생장량은 0.8 cm로 느리게 생장하고 균사는 흰색~분홍색이며 회색의 분생포자를 형성하고 뒷면은 회색-갈색이고 균총 끝부분은 황색이다. Conodiophore는 5-15 μm로 짧으며 hyaline, smooth이고 monoverticillate이고 2-7개의 양끝이 좁은 phialides를 형성하며 크기는 4.5-6×2-2.5이다. 분생포자는 황갈색에 줄무늬가 있고 ellipsoid에서 ovoid의 모양이며 표면은 rough이고 크기는 2.5-3.5×2-2.5 μm이다(Fig. 1) [13].
Fig. 1
Penicillium striatisporum D05 (NIBRFGC000509145). (A, B) Colonies on potato dextrose agar (PDA) at 25℃ after 7 days of incubation (obverse and reverse), (C, D) conidiophores, (E) conidia. Bars=10 μm.
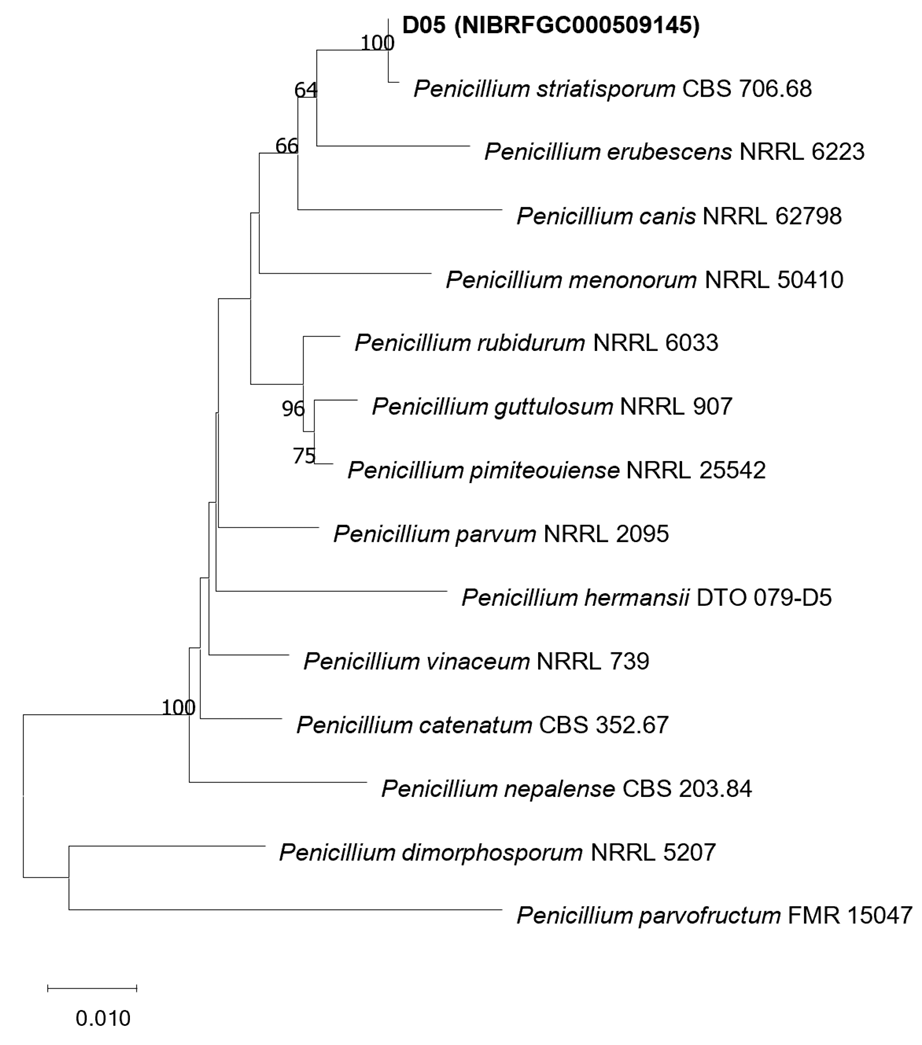
ITS분석결과(MW832238) Penicillium striatisporum CBS 706.68 MN859205와 99.63%의 상동성을 보였고 beta-tubulin (OR475566)은 Penicillium striatisporum CBS 706.68 MN969401과 99.73%의 상동성을 보였다. ITS와 beta-tubulin을 결합한 계통수(Fig. 2)에서는 Penicillium striatisporum CBS 706.68과 다른 종들과는 독립된 하나의 clade를 형성하였다.
Penicillium striatisporum는 1969년 Stolk에 의해 Vachellia karroo 낙엽에서 처음 보고가 되었고 이후 토양, 고추의 근권 등에서 분리가 보고되었다. Penicillium striatisporum 줄무늬의 분생포자를 형성하고 생장이 느리며 황갈색의 포자, phialides 모양에 의해 다른 Penicillium 종들과 구분된다[13].
Fig. 2
Phylogenetic position of D05 strain based on the combined data from the internal transcribed spacer (ITS) of rDNA (MW832238) and β-tubulin (OR475566). Combined data of the isolate was compared with those of other species in Penicillium section Exilicaulis from Houbraken et al. [16]. The combined data were analyzed using Tamura-Nei parameter distance calculation model, and then used to construct the Neighbor-Joining (NJ) tree with MEGA ver. 7.0 [17]. Bootstrap analysis was performed with 1,000 replications.
were symptom-free. The same fungus was successfully reisolated from the artificially inoculated plants (Fig. 1J), thereby fulfilling Koch’s postulates.
In the last decade, several fungal pathogens, including Alternaria alternata [11], Golovinomyces orontii (recently reclassified under G. bolayi) [12], Fusarium fujikuroi [13], and Septoria lactucae [14], have been reported on L. serriola in Korea. Additionally, oomycetes, such as Bremia lactucae [15], have also been documented. To the best of our knowledge, this is the first report of leaf blight caused by C. intermedia on L. serriola in Korea. C. intermedia affects the economically important crops and grasses as well as weeds of lawns and turfgrasses [16]. Furthermore, it causes leaf spots on Zea mays in Korea [17].
Results of this study suggest C. intermedia as an effective biocontrol agent for L. serriola. This pathogen was previously proposed as a potential microbial herbicide for large crabgrass (Digitaria sanguinalis) [18]. In addition, use of C. intermedia as a microbial herbicide against crabgrass and other susceptible species has been detailed in two U.S. patents [19,20]. However, its potential non-target effects require further investigation to prevent any adverse ecological impact.
Gongronella sichuanensis Zhi.Y. Zhang, Y.F. Han, W.H. Chen & Z.Q. Liang, Phytotaxa 416 (2): 170 (2019) [MB#830671] [NIBRFGC000509146]
PDA에서 25℃ 7일간 생장량은 54 mm, 흰색이며 뒷면은 옅은 황색-흰색이다. Rhizoid와 stolon은 형성되지 않았다. 포자낭은 subglobose, globose이고 7.3-14.7 μm이며 포자낭포자는 reniform, ovoid, ellipsoidal이고 0.8-1.4×1.2-1.7 μm이다. Apophyses는 ellipsoidal, subglobose이고 크기는 4.25.6×3.8-7.4 μm이다. Columellae는 hemispherical이고 1.2-2.8×3.7-5.3 μm이다. Chlamydospores는 globose 또는 subglobose이고 4.3-8.1 μm이며 Zygospores 관찰되지 않았다(Fig. 3) [15].
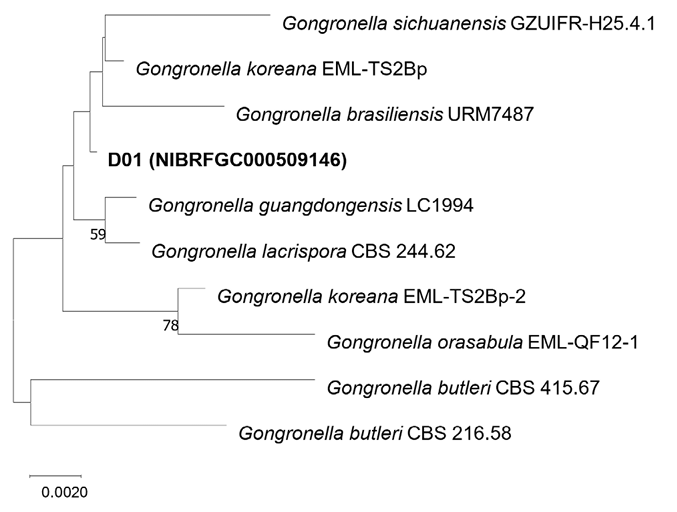
Gongronella sichuanensis는 2019년도에 처음 보고되었으며 토양에서 분리되었다. G. sichuanensis는 apophyses와 포자낭포자의 형태와 Chlamydospore의 형성유무에 의해 다른 Gongronella 종들과 구분된다[15]. D01균주의 ITS 분석결과(MW832239) 다양한 Gongronella종들과 99%이상의 상동성을 보였으나 일치하는 종은 없었지만 LSU분석결과(MW840080) G. sichuanensis와 100%의 상동성을 보였고 G. guangdongensis, G. koreana, G. orasabula 종들과는 99.89%의 상동성을 보였다. ITS와 LSU 염기서열을 결합한 계통수(Fig. 4)에서 D01균주와 일치하거나 같은 clade를 형성하는 표준균주는 없었다.
분자적 특징에서는 정확한 동정이 어려웠으나 Zhang 등[15]의 형태적 분류에 따른 형태적 특징의 분석결과 D01균주는 zygospore 미형성, chlamydospore 형성, rhizodi와 stolon을 미형성, reniform,
Fig. 3
Gongronella sichuanensis D01 (NIBRFGC000509146). (A, B) Colonies on potato dextrose agar (PDA) at 25℃ after 7 days of incubation (obverse and reverse), (C) sporangiophores, (D) chlamydospore, (E, F) sporangiophores, (G) sporangiospores. Bars=5 μm.
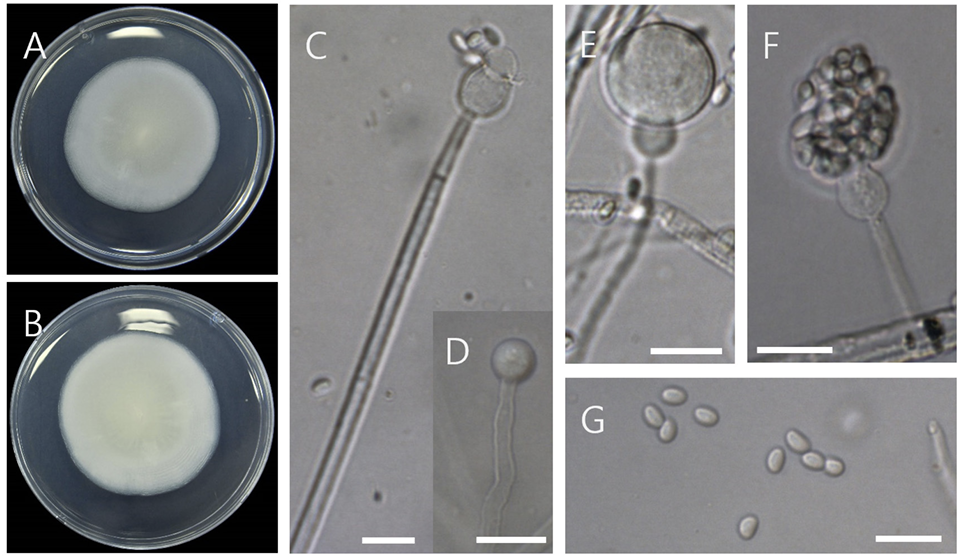
Fig. 4
Phylogenetic position of D01 strain based on the combined data from the internal transcribed spacer (ITS) (MW832239) and large subunit (LSU) (MW840080) of rDNA. Combined data of the isolate was compared with those of other species in Gongronella from Zhang et al. [15]. The combined data were analyzed using Tamura-Nei parameter distance calculation model, and then used to construct the Neighbor-Joining (NJ) tree with MEGA ver. 7.0 [17]. Bootstrap analysis was performed with 1,000 replications.
독도에 자생하는 왕호장근의 근권토양에서 균을 분리하여 형태적 특징과 분자생물학적 특징을 분석한 결과 기존에 국내에 보고되지 않은 Penicillium striatisporum과 Gongronella sichuanensis 이 분리되었다. 이 종들은 모두 주로 토양에서 분리되는 것으로 보고되었다. 특히, Penicillium striatisporum의 경우 고추의 근권에서 분리된 종으로 병원균인 Phytophthora spp., Cladosporium cucumerium, Sclerotinia sclerotiorum의 균사 생장에 영향을 미치는 것으로 보고되어[14] 활용가치가 있을 것으로 판단된다.


