효모는 균계에 속하는 진핵생물로 Ascomycota와 Basidiomycota으로 나뉘며 물, 동물, 식물, 토양 그리고 곤충 등에서 흔히 발견된다. 담수환경의 효모는 생물다양성이 높으며 중요한 생태학적 역할도 가지는 것으로 보고되고 있다[1].
Candida 속은 Ascomycota에 속하는 효모로서 다양한 환경에서 분리되고 있다. Candida viswanathii는 가래 검체에서 분리되어 최초 보고되었으며[2,3] 병원성을 가지는 것으로 보고되고 있다[4]. Curvibasidium 속, Oberwinklerozyma 속 그리고 Vishniacozyma 속은 Basidiomycota에 속하는 효모이다[5]. Curvibasidium 속에는 6개의 종이 속해 있으며, Curvibasidium cygneicollum은 산 속 동물의 대변과 식물의 꽃, 잎, 열매, 뿌리 등에서 분리되었다[6]. Oberwinklerozyma 속은 5개의 종이 있으며, Oberwinklerozyma silvestris는 최초 Rhodotorula 속으로 보고되었으나[7] Wang [8]에 의해 Oberwinklerozyma 속으로 재명명 되었으며, 생태계 내의 유기물질을 분해하는 것으로 알려져있다. Vishniacozyma 속은 24개의 종이 속해 있으며 담수환경을 포함하여 대부분의 생태계에서 발견된다. Vishniacozyma foliicola는 Crytococcus 속으로 보고되었다가[9] 2015년에 Vishniacozyma 속으로 재명명되었다[10].
본 연구에서는 국내 담수 환경에서 물과 식물체, 슬러지를 채집하여 야생효모를 분리 및 동정하였고 이들 중 국내 미기록 효모 4종을 선별하여 종 특성을 알아보았다.
담수효모를 분리하기 위하여 강원도 춘천시와 경상북도 경주시의 담수시료를 50 mL 채취하여 조사 현장에서 핸드펌프와 nitrocellulose membrane filter (pore size 0.45 μm MCE membrane, MFMiliporetm, Burlington, MA, USA)를 이용하여 여과하였다. 필터의 시료가 여과된 면을 streptomycin 100 ppm이 첨가된 water agar (WA, 20 g/L, agar)에 부착하여 15℃에서 1일 간 배양 후 membrane f ilter를 제거하고 실체현미경을 이용하여 발아한 포자를 배지에서 분리하여 V8 agar배지 (V8A; 8% V8 juice [v/v] and 1.5% agar [w/v] adjusted to pH 6.0 using 10 N NaOH)에 배양하였다. 경상북도 포항시의 담수환경에서 채집한 담수침전식물체는 여과한 현장수에 넣고 20℃에서 2일 동안 150 rpm으로 진탕배양한 후, 배양된 배지 100 µL를 WA에 도말하여 2일 동안 15℃에서 배양하였다. 배양된 배지에서 단포자 분리를 통해 야생효모를 V8A 배지에 순수분리 하였다. 인천광역시의 담수환경에서 채집한 슬러지는 10-3배 희석하여 streptomycin 100 ppm이 첨가된 potato dextrose agar (PDA, Difco, Detroit, MI, USA)에 도말하여 5일 간 20℃에서 배양하였다. 배양된 배지에서 단포자 분리를 통하여 담수효모를 V8A 배지에 순수분리 하였다. 분리된 효모의 균체 확보를 위하여 yeast extract peptone dextrose broth (YPDB, Sigma-Aldrich, Darmstadt, Germany)에 agar를 첨가한 yeast extract peptone dextrose agar (YPDA)배지에 계대배양 하였다. 분리 효모의 포자를 관찰 및 화상자료 확보를 위하여 광학현미경(H550S, Nikon, Tokyo, Japan)을 이용하였다.
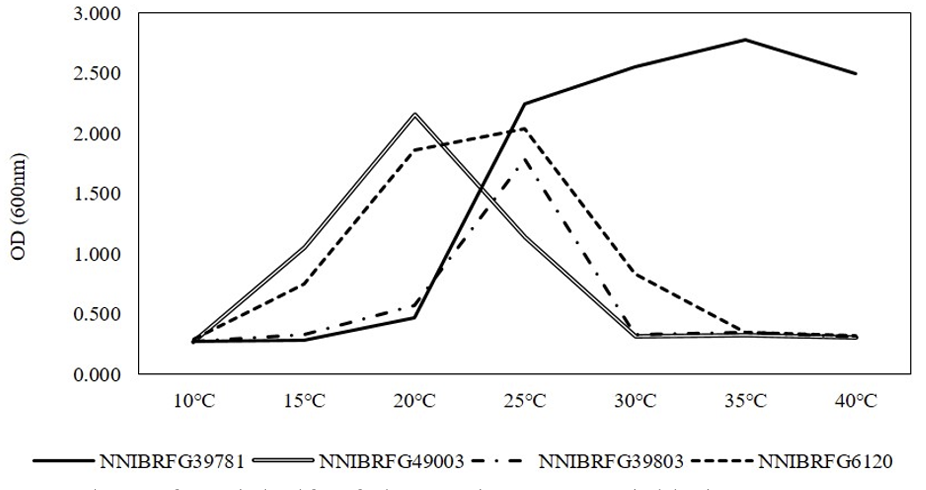
분리된 효모의 배양환경의 조건에 따른 생육 특성을 조사하기 위하여 10-40℃의 7개 온도 범위와 pH 4-8의 5개 pH 범위의 YPDA, 10%와 20% glucose (w/v)를 첨가한 YPDB, 5%와 15% NaCl (sodium chloride [w/v])을 첨가한 YPDB, yeast mold broth (YMB, Difco, Detroit, MI, USA), yeast vitamin free base (YVB, Formedium Ltd., Hustanton, England), potato dextrose broth (PDB, Difco, Detroit, MI, USA) 배지를 실험에 사용하였다. 각각의 배지를 125 mL 삼각플라스크에 30 mL씩 조제하여 48시간동안 150 rpm으로 진탕배양하여 흡광도(600 nm, microplaterreader Epoch2, Bioteck, Winooski, Vermont, USA)를 측정하였다[12].
균학적 특성
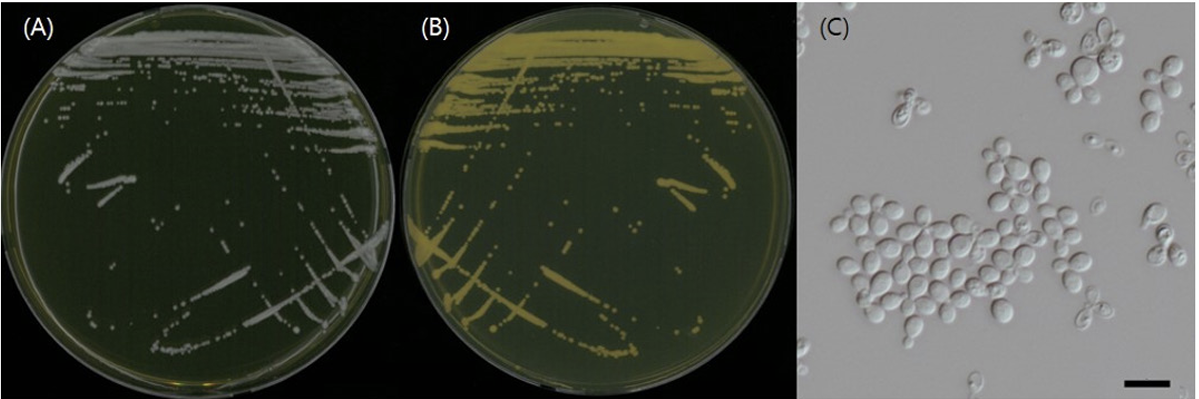
Candida viswanathii T.S. Viswan. & H.S. Randhawa, Science and Culture (Calcutta) 25: 86 (1959) [2] (Figs. 1, 2, and 3; Table 1 and 2)
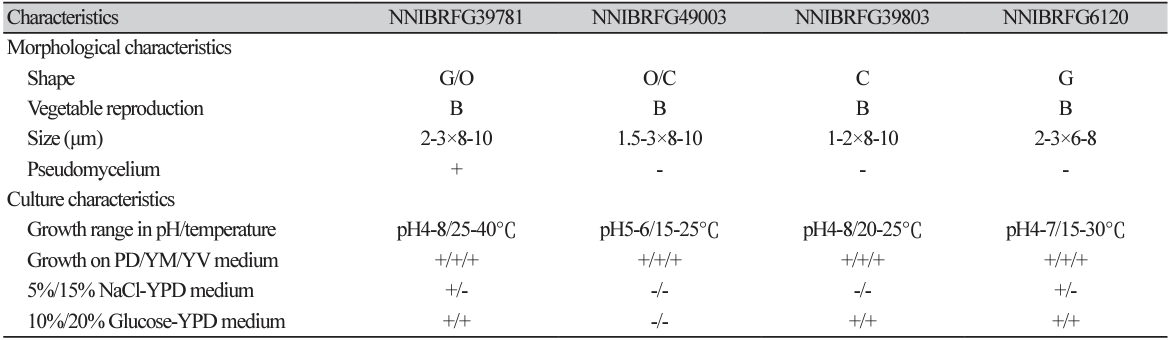
형태 및 배양 특성: YPDA 배지에 획선도말하여 25℃에서 5일 간 배양하였을 때 콜로니는 전체적으로 흰색을 띄었고 광택이 없었다. 포자의 형태는 구형 또는 난형으로 관찰되었으며 의균사를 형성하였다. 출아에 의한 무성생식을 하였으며, 크기는 폭 2-3 μm×길이 8-10 μm이다. YPDB, PDB, YMV, YVB 배지에서 생장하였으며, 생장 pH는 4-8, 생장 온도는 25-40℃의 범위이며 35℃에서 가장 잘 생장하였다. Glucose가 함유된 배지에서 생장하였으며 NaCl의 농도가 5%일 때는 생장하였으나 15%에서는 생장하지 않았다.
분리원: 슬러지
표본 정보: 인천광역시 남동구, 2022.03.07., NNIBRFG39781, 국립낙동강생물자원관
비고: NNIBRFG39781 균주는 26S D1/D2 영역의 염기서열을 NCBI의 blast를 이용하여 비교한 결과, C. viswanathii CBS4024 (KY106885) 균주와 100%의 상동성을 보였으며, 계통수 상에서도 C. viswanathii CBS4024 균주와 같은 clade에 속하는 것으로 확인되어 최종적으로 C. viswanathii으로 동정되었다.
Fig. 1
Phylogenetic tree of Candida viswanathii NNIBRFG39781 and related species based on a Neighbor-joining analysis of the nucleotides sequences of large subunit 26S ribosomal DNA D1/D2 region, using MEGA-X. The sequences of Schizosaccharomyces pombe was used as outgroup. The unrecorded yeast was shown in bold and red.
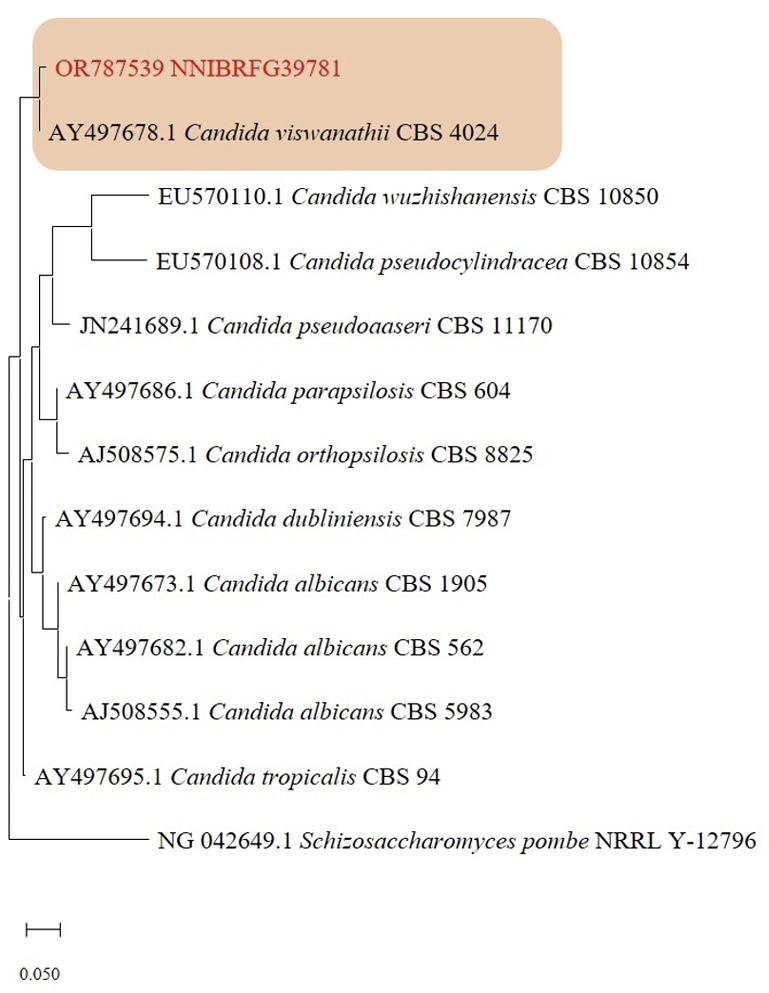
Fig. 2
Morphology of Candida viswanathii NNIBRFG39781. The colony of front (A), reverse (B) and hairy projection (C) on yeast extract peptone dextrose agar for 5 days at 25℃ and conidia and pseudomycelium (D, E, F). scale bar=10 μm (×400).
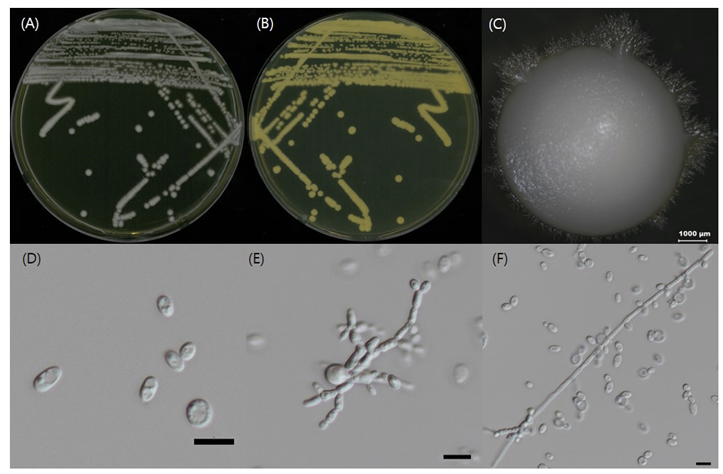
Fig. 3
Temperature growth curve of yeasts isolated from freshwater environment. OD, optical density.
Curvibasidium cygneicollum J.P. Samp., Int. J. Syst. Evol. Microbiol. 54 (4): 1402 (2004) [6] (Figs. 3, 4, and 5; Table 1 and 2)
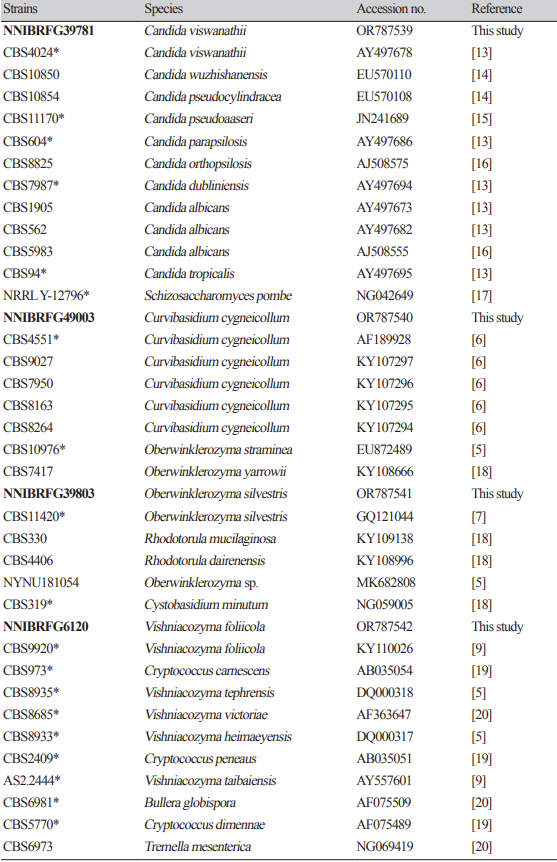
형태 및 배양 특성: YPDA 배지에 획선도말하여 20℃에서 5일 간 배양하였을 때 콜로니는 상아색으로 약하게 광택을 띄었다. 포자의 형태는 타원형 또는 막대형으로 관찰되었으며 출아에 의한 무성생식을 하였으며 크기는 폭 1.5-3 μm×길이 8-10 μm이다. YPDB, PDB, YMB, YVB 배지에서 생장하였으며, 생장 pH는 5-6, 생장 온도는 15-25℃의 범위이며 20℃에서 가장 잘 생장하였다. Glucose 및 NaCl이 함유된 배지에서는 생장하지 않았다.
분리원: 하천의 담수
표본 정보: 경상북도 경주시 능동천, 2023.02.09., NNIBRFG49003, 국립낙동강생물자원관
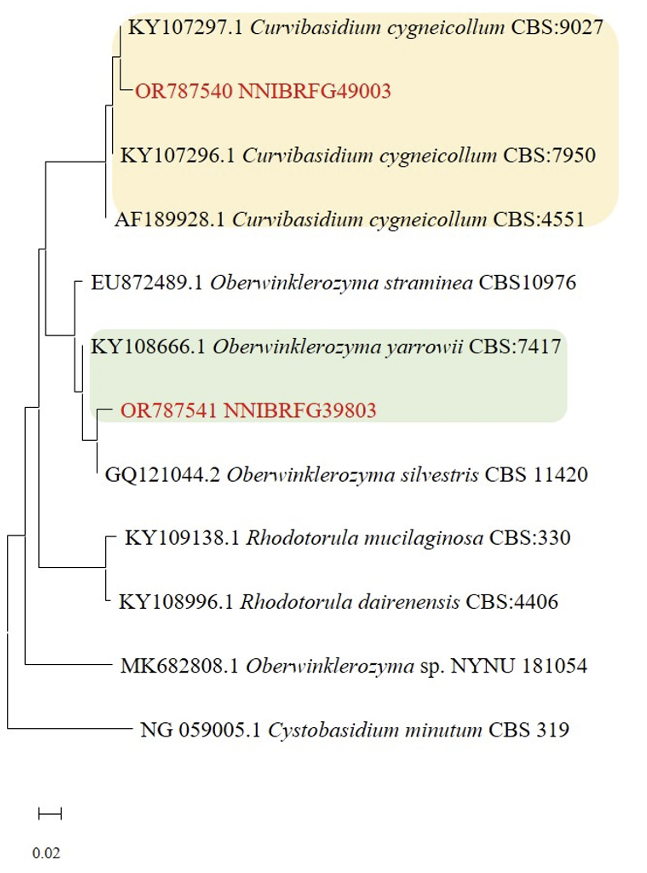
비고: NNIBRFG49003 균주는 26S D1/D2 영역의 염기서열을 NCBI의 blast를 이용하여 비교한 결과, C. cygneicollum CBS8163 (AF189931) 균주와 100%의 상동성을 보였으며, 계통수 상에서도 C. cygneicollum CBS7950, C. cygneicollum CBS4551, C. cygneicollum CBS9027 균주와 같은 clade에 속하는 것으로 확인되어 최종적으로 C. cygneicollum으로 동정되었다.
Fig. 4
Phylogenetic tree of Curvibasidium cygneicollum NNIBRFG49003, Oberwinklerozyma silvestris NNIBRFG39803 and related species based on a Neighbor-joining analysis of the nucleotides sequences of large subunit 26S ribosomal DNA D1/D2 region, using MEGA-X. The sequences of Cytobasidium minutum was used as outgroup. The unrecorded yeasts were shown in bold and red.
Oberwinklerozyma silvestris Scorzetti & Golubev ex Q.M. Wang, F.Y. Bai, M. Groenew. & Boekhout, Studies in Mycology 96: 135 (2020) [7] (Figs. 3, 4, and 6; Table 1 and 2)
형태 및 배양 특성: YPDA 배지에 획선도말하여 25℃에서 5일 간 배양하였을 때 콜로니는 전체적으로 흰색이었다. 포자의 형태는 막대형으로 관찰되었으며 크기는 폭 1-2 μm×길이 8-10 μm이다. 또한 출아에 의한 무성생식을 하였다. YPDB, PDB, YMB, YVB 배지에서 생장하였으며, 생장 pH는 4-8, 온도는 20-25℃의 범위이며 25℃에서 잘 생장하였다. Glucose가 함유된 배지에서는 생장하였으나 NaCl이 함유된 배지에서는 생장하지 않았다.
분리원: 하천의 담수침전식물체
표본 정보: 경상북도 포항시 냉천, 2022.02.08., NNIBRFG39803, 국립낙동강생물자원관
비고: NNIBRFG39803 균주는 ITS 영역의 염기서열을 NCBI의 blast를 이용하여 비교한 결과, O. silvestris CBS11420 (GQ121045) 균주와 100%의 상동성을 보였으며, 26S D1/D2 영역의 염기서열로 작성한 계통수 상에서 O. silvestris CBS11420과 같은 clade에 속하는 것으로 확인되어 최종적으로 O. silvestris로 동정되었다.
Vishniacozyma foliicola Q.M. Wang & F.Y. Bai ex Yurkov, Studies in Mycology 96: 137 (2020) [9] (Figs. 3, 7, and 8; Table 1 and 2)
형태 및 배양 특성: YPDA 배지에 획선도말하여 25℃에서 5일 간 배양하였을 때 콜로니는 전체적으로 흰색이었으며 광택을 띄었다. 포자의 형태는 구형으로 관찰되었으며 크기는 폭 2-3 μm×길이 6-8 μm이다. 또한 출아에 의한 무성생식을 하였다. YPDB, PDB, YMB, YVB 배지에서 생장하였으며, 생장 pH는 4-7, 온도는 15-30℃의 범위이며 25℃에서 가장 잘 생장하였다. Glucose가 함유된 배지에서 잘 생장하였으며, 5%의 NaCl이 함유된 배지에서는 생장하였으나 15%의 NaCl이 함유된 배지에서는 생장하지 않았다.
분리원: 하천의 담수
표본 정보: 강원도 춘천시 추곡천, 2018.05.03., NNIBRFG6120, 국립낙동강생물자원관
비고: NNIBRFG6120 균주는 26S D1/D2 영역의 염기서열을 NCBI의 blast를 이용하여 비교한 결과, V. foliicola CBS9920 (NG067769) 균주와 100%의 상동성을 보였으며, 계통수 상에서도 V. foliicola CBS9920, V. foliicola YM26828 균주와 같은 clade에 속하는 것으로 확인되어 최종적으로 V. foliicola으로 동정하였다.
Fig. 7
Phylogenetic tree of Vishniacozyma foliicola NNIBRFG6120 and related species based on a Neighbor-joining analysis of the nucleotides sequences of large subunit 26S ribosomal DNA D1/D2 region, using MEGA-X. The sequences of Tremella mesenterica was used as outgroup. The unrecorded yeast was shown in bold and red.

적요
본 연구는 국내 담수환경으로부터 야생효모를 분리하여 특성을 분석하였다. 분리된 효모의 26S rDNA의 D1/D2부위 염기서열을 이용하여 동정을 하였다. 결과적으로 C. viswanathii (NNIBRFG39781), C. cygneicollum (NNIBRFG49003), O. silvestris (NNIBRFG39803), V. foliicola (NNIBRFG6120) 등 4종의 국내 미기록 야생효모들을 동정하였다. 이들 미기록 효모는 모두 출아에 의하여 영양생식을 하였고 PD, YM, YV 배지에서 잘 자랐다. C. viswanathii (NNIBRFG39781) 균주는 의균사를 형성하였으며 고온에서도 생육하였다. 또한 C. viswanathii (NNIBRFG39781), O. silvestris (NNIBRFG39803), V. foliicola (NNIBRFG6120) 균주는 20% glucose를 함유한 YPD 배지에서 생육하는 내당성을 보였으며 C. cygneicollum (NNIBRFG49003)와 O. silvestris (NNIBRFG39803) 균주는 NaCl을 함유한 배지에서는 생육하지 못하였다. 담수환경은 효모를 포함한 균류의 다양성이 높은 환경으로 지속적 연구가 필요하다. 본 연구는 향후 담수환경의 생물다양성 연구에 기초자료로 활용될 것이다.