서론
고등 미생물인 효모는 Candida albicans와 Cryptococcus neoformance 등을 제외한 대부분의 균들이 GRAS (generally recognized as safety)균으로 오래전부터 전통주와 된장 등의 전통 발효식품 제조에 이용해오고 있고[1,2], 비타민과 미네랄 등을 함유한 약용효모로 알려져 있다. 근래에 이들의 probiotics 등 다양한 생리활성들이 보고됨에 따라 일부 건강소재 생산에 이용되고 있고[2-10], 효소 등 다양한 대사산물들을 생산, 분비하고 이들의 기작들이 규명되어있어 외래단백질 발현을 위한 숙주 등의 분자생물학적 연구 재료로도 매우 유용한 미생물로 알려져있다[11].
최근 전 세계적으로 자국의 생물자원 보호에 대한 중요성이 크게 강조됨에 따라 우리나라도 환경부의 국립생물자원관과 국립낙동강생물자원관이 중심이 되어 우리나라에서 자생하고 있는 새로운 생물자원의 발굴과 이들의 보존 및 이용에 관한 연구를 활발히 추진해오고 있다.
우리 한반도는 연평균 기온이 20-30℃로 4계절이 분명하고 우기가 비교적 짧고 낙동강 등의 강과 하천들이 많고 남해안에 많은 섬들이 있어 다양한 생물자원들이 서식하기 좋은 환경이다. 따라서 최근 우리 고유의 생물체들이 많이 발굴‧보고되고 있으며, 본 연구실도 지난 10년동안 우리나라 산이나 섬, 강과 하천, 해변, 도시, 농촌등의 토양이나 야생화, 물과 수중 식물체, 수생 생물등의 광범위한 시료로부터 이들 자연환경에 분포하는 약 2,500여 균주의 다양한 야생 효모들을 분리, 동정하여 보고하였고[12-23], 200종의 국내 미기록 야생효모들을 선별하여 이들의 균학적 특성등을 보고하였다[19,21,24-27].
그러나, 담수환경으로부터의 야생 균류 특히, 새로운 효모균류 발굴 연구는 다른 곰팡이, 세균등에 비해 미흡하여 본 연구에서도 영산강, 낙동강 및 금강 등의 주변 물과 토양 등으로부터 야생효모들을 분리, 동정하고 이들 중 국내 미기록 효모들을 선별하여 이들의 특성을 보고하였을 뿐이다[19,28-36].
본 연구는 남덕유산 거창의 월성 계곡과 대전광역시 갑천 상류인 논산 병암천과 하류인 진잠천 등에서 분리, 동정한 야생효모들 [34,35] 중 국내 미기록효모들을 선별한 후 이들의 균학적 특성과 효소 및 생리활성 등을 조사하여 보고하고자 한다.
재료 및 방법
국내 미기록 효모들의 선별
본 연구실에서는 남덕유산 월성계곡 월성교 주변에서 분리‧동정한 야생효모들과 대전광역시 갑천, 진잠천 상류와 하류(논산 병암천, 장안호수, 진잠교) 등에서 분리, 동정한 야생효모들을 대상으로 국립생물자원관 DB와 한국 진균관련 학술자료들을 이용하여 국내 미기록 효모들을 선별한 후[34], 아래와 같이 균학적 특성과 산업용 유용 효소 및 생리활성 등을 측정하였다.
국내 미기록 효모들의 균학적 특성
국내 미기록 야생효모들을 대상으로 일반 미생물 실험방법 등을 이용하여 이들의 몇 가지 균학적 특성 등을 다음과 같이 조사하였다[23]. 미기록 효모들을 potassium acetate-yeast extract dextrose (SM) 배지와 glucose-peptone-yeast extract (GPY) 한천 배지에 순차적으로 배양한 후 효모 세포 염색법과 광학현미경 (BX43, OLYMPUS , OLYMPUS, Tokyo, Japan)현미경과 eXcopex3프로그램(OLYMPUS, Tokyo, Japan) 등을 이용하여 선발 균주의 포자, 의균사 형성 유무 등의 형태적 특징과 배양적 특성을 조사하였다[34,35].
탄소원 등에 대한 자화성과 발효성은 선발 효모를 durham관이 들어있는 yeast nitrogen base (w/o amino acids, BD Difco, Le Pont-de-Claix, France) 액체배지에 접종하여 30℃에서 24시간 배양한 후, 생육과 CO2생성 여부를 확인하여 탄소원들의 자화성과 발효성을 판정하였다[30]. 중금속에 대한 내성은 YPD (yeast extract-peptone-dextrose) 배지에 중금속을 농도별(ppm)로 첨가하여 30℃에서 24시간 배양한 후 660 nm에서 흡광도를 측정하여 생육도를 조사하였다[35,36].
국내 미기록 효모들의 효소활성 및 생리 활성
α-amylase 활성은 가용성 전분을 기질로 이용하여 생성된 dextrin을 요오드 반응으로 발색시켜 670 nm에서 흡광도를 측정하였고, glucoamylase는 기질인 가용성 전분으로부터 생성된 환원당을 DNS (5-dinitrosalicylic acid)법을 이용하여 535 nm에서 흡광도를 측정하였다[37]. Invertase 활성은 sucrose를 기질로 사용하여 측정하였고[38], β-Galactosidase 활성은 p-nitrophenyl-β-D-galactopyranoside을 기질로 하여 반응시킨 후 생성된 PNP (p-nitrophenyl)함량을 410 nm에서 흡광도를 측정하였다[34]. Cellulase 활성은 1% carboxymethyl cellulose (CMC)를 이용한 분광분석법으로 측정하였고[39], protease 활성은 casein을 기질로 반응시킨 후 folin 시약으로 발색하여 660 nm에서 흡광도를 측정하였다[37]. 항산화 활성은 선발균주의 무세포추출물을 DPPH (α-dipenyl-β-picrylhydrazyl)와 혼합한 후 plate reader를 이용하여 측정하였고, SOD (superoxide dismutase) 유사 활성은 pyrogallol과 plate reader를 이용하여 조사하였으며[17], xanthine oxidase 저해 활성 등은 각각 L-tyrosine과 tyrosinase, xanthine과 xanthine oxidase을 사용하여 조사하였다[28]. 주름생성 억제에 관련된 elastase 저해활성과 collagenase저해활성, 미백관련 tyrosinase 저해활성들은 각각 N-Succinyl-(Ala)3-p-nitroanilide와 elastase, L-tyrosine과 tyrosinase 등을 이용하여 분광분석법으로 측정하였다[17].
결과 및 고찰
국내 미기록 야생효모들의 선별
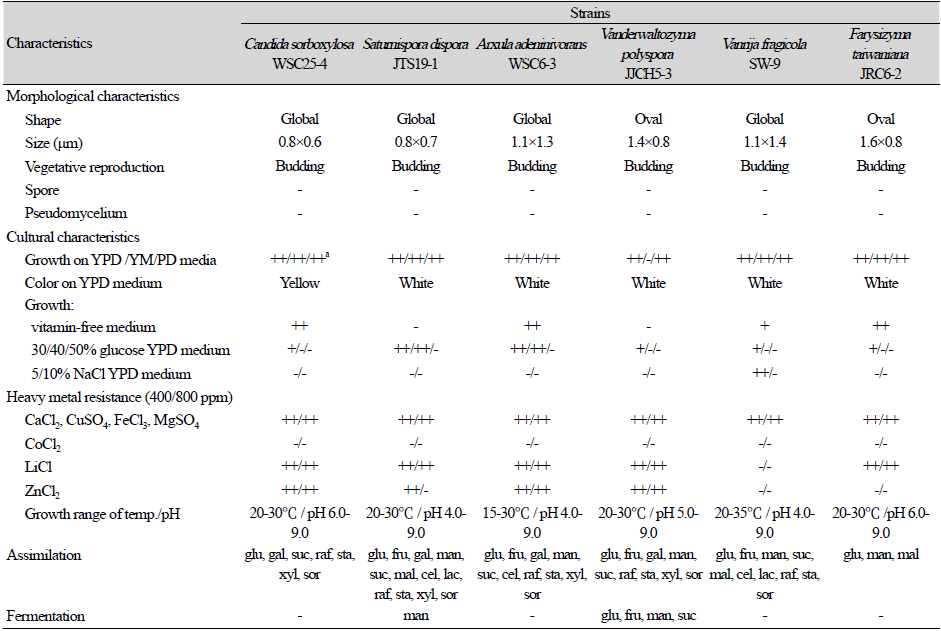
본 연구에서는 월성계곡주변 물과 토양 등으로부터 분리, 동정한 야생효모들 중 Candida sorboxylosa WSC25-4 (NNIBRFG47336, GenBank No: LC054320.1), Arxula adeninivorans WSC6-3 (NNIBRFG47335, GenBank No: U40094.1) 2 균주를 국내 미기록 효모로 선별하였고, 대전광역시 갑천과 진잠천 상류인 논산 병암천 주변에서 Farysizyma taiwaniana JRC6-2 (NNIBRFG47339, GenBank No: AY551270.1) 균주를, 장안호수 주변에서는 Saturnispora dispora JTS19-1 (NNIBRFG47334, GenBank No: U94937.1) 균주를 미기록 효모로 선발하였다. 또한 진잠천 하류지역인 진잠교 주변에서 Vanderwaltozyma polyspora JJCH5-3 (NNIBRFG47337, GenBank No: EF460547.1), Vanrija fragicola SW-9 (NNIBRFG47338, GenBank No: AB126585.1) 2균주 등, 총 6균주를 국내 미기록 야생효모들로 최종 선별하였다.
국내 미기록 효모들의 계통수와 형태학적, 배양학적 특성
선별한 국내 미기록 야생효모 6균주들의 계통수는 Fig. 1과 같고, 이들 균주들의 균학적 특성으로 형태학적, 배양학적 특성과 중금속 등에 대한 내성 및 탄소원들에 대한 자화성과 발효성 등을 조사한 결과는 다음과 같다(Table 1; Fig. 2).
Candida sorboxylosa WSC 25-4
2022년 8월 경남 거창의 남덕유산 월성계곡 주변토양에서 분리한 국내 미기록 야생효모로 0.6-0.8 μm 크기의 구형으로 출아에 의해 영양 증식을 하였고, 포자와 의균사를 형성하지 않았다. YPD, YM (yeast extract-malt extract), PDA (Potato dextrose agar)배지와 vitamin-free 배지에서 생장이 좋았다. 30% 포도당을 함유한 YPD배지에서 생장이 좋은 반면, 5% NaCl을 함유한 YPD배지에서는 생장하지 못하였다. 또한 Ca, Fe, Cu, Li, Zn, Mg등의 중금속들에 대하여 800 ppm까지 내성을 보였다. 포도당과 galactose, sucrose, raffinose, starch, xylose, sorbitol 등을 자화시켰고, fructose, mannose, maltose, lactose 등은 자화시키지 못하였으며, 대부분의 당류들을 발효시키지 못하였다.
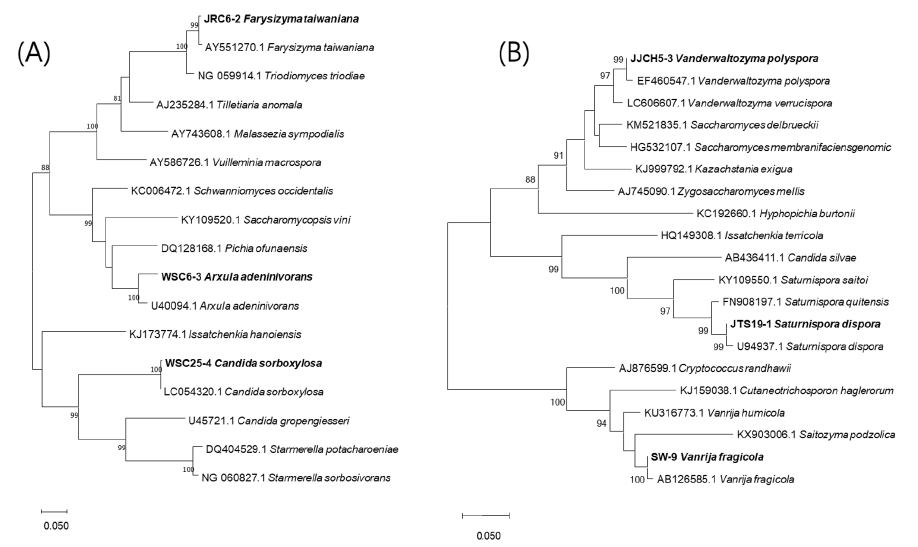
Fig. 1. Phylogenetic trees of unrecorded wild yeasts, Farysizyma taiwaniana JRC6-2, Arxula adeninivorans WSC6-3, Candida sorboxylosa WSC25-4 (A) and Vanderwaltozyma polyspora JJCH5-3, Saturnispora dispora JTS19-1, Vanrija fragicola SW-9 (B), based on the sequences of D1/D2 region of the large-subunit rDNA. The tree was generated by the neighbor-joining method, using MEGA X. The bar indicates the number of substitutions per position. (Bold : unrecorded yeasts).
한편, 이 미기록균 효모는 Nakase [40]가 자연계로부터 분리한 C. Krusei 등 76균주의 야생효모들을 탄소원의 자화성과 비타민 요구성, DNA의 G+C 함량등을 토대로 재동정한 균주 중 하나로 처음 보고되었다.
Arxula adeninivorans WSC6-3
2022년 8월 경남 남덕유산 월성계곡 주변토양에서 분리된 국내 미기록 야생효모로 1.1-1.3 μm 크기의 구형으로 출아에 의해 영양 증식을 하였고, 포자와 의균사를 형성하지 않았다. YPD, YM, PDA에서 잘 생육하였고 vitamin-free배지에서도 생육하였다. 또한, 40% 포도당을 함유한 YPD배지에서 생육하는 내당성이 있어 고농도 담금이 필요한 알콜발효산업 등에 유용할 것으로 사료된다. Ca, Cu, Li, Mg Zn, Fe 등의 중금속 이온들에 대하여 800 ppm까지 내성을 보였고 포도당과 fructose, galactose, mannose, sucrose, maltose, cellobiose, raffinose, starch, xylose, sorbitol 등을 자화시켰으나 대부분의 당류들을 발효시키지 못하였다. 한편, 이 미기록 효모는 계통분류학적으로 Saccharomycetes 목의 Dipodascaceae 과에 속하는 균이며, 특히 질산염을 자화시키는 내건성을 가진 효모로 처음 보고되었다[41].
Farysizyma taiwaniana JRC6-2
2022년 5월 대전광역시 갑천 상류인 논산 병암천 주변토양에서 분리한 야생효모로 1.1-1.6 μm 크기의 난형으로 출아에 의해 영양 증식을 하였고, 포자와 의균사를 형성하지 않았다. YPD, YM, PDA에서 잘 생육하였지만, vitamin-free배지에서는 생육하지 못하였다. 또한, 40% 포도당을 함유한 YPD배지에서 생육하였고 Ca, Cu, Fe, Mg 등의 중금속 이온들에 대하여 800 ppm까지 내성을 보였다. 포도당과 mannose, maltose 등을 자화시켰으나 대부분의 당류들을 발효시키지 못하였다. 이 미기록 효모는 대만의 Nanjen-shan 자연보호구역에있는 큰도둑놈의갈고리 식물에서 무성세대속 효모로 처음 보고되었다[42].
Saturnispora dispora JTS19-1
2021년 10월 대전광역시 갑천 상류인 장안호수 주변토양에서 분리한 야생효모로 0.7-0.8 μm 크기의 구형으로 출아에 의해 영양 증식을 하였고 포자와 의균사를 형성하지 않았다. YPD, YM, PDA에서 잘 생육하였으나 vitamin-free배지에서는 생육하지 못하였다. 또한, 40% 포도당을 함유한 YPD배지에서 생육하는 내당성을 가졌고 Ca, Cu, Fe, Li, Mg 등의 중금속 이온들에 대하여 800 ppm까지 내성을 보였다. 포도당과 fructose, mannose, galactose, maltose, sucrose, lactose, raffinose, cellobiose, starch, xylose, sorbitol 등을 자화시켰고, 특이하게 mannose만을 발효시켰다. 국내 미기록 효모 Saturnispora dispora JTS19-1는 구형-난형으로 다극출아에 의한 영양증식과 1-2개의 자낭포자를 생성하는 효모로 처음 보고되었다[43].
Vanderwaltozyma polyspora JJCH5-3
2022년 9월 대전광역시 진잠천 하류인 진잠교 주변에서 분리한 야생효모로 0.8-1.4 μm 크기의 난형으로 출아에 의해 영양 증식을 하였고, 포자와 의균사를 형성하지 않았다. YPD와 PDA에서 잘 생육하였으나 vitamin-free 배지에서는 생육하지 못하였다. 또한, 30% 포도당을 함유한 YPD배지에서 생육하였고 Ca, Cu, Fe, Li, Mg, Zn 등의 중금속이온들에 대하여 800 ppm까지 내성을 보였다. 포도당과 fructose, mannose, galactose, sucrose, lactose, raffinose, starch, xylose, sorbitol 등을 자화시켰다. 한편, 이 미기록 효모는 Van der Walt에 의하여 Kluyveromyces polyspora로 처음 보고되었으나[44], 후에 Vanderwaltozyma속으로 재명명되었다.
Vanrija fragicola SW-9
2022년 9월 대전광역시 진잠천 하류인 진잠교 주변의 작은 민물새우에서 분리한 야생효모로 1.1-1.4 μm 크기의 구형으로 출아에 의해 영양 증식을 하였고, 포자와 의균사를 형성하지 않았다. YPD와 YM, PDA에서 잘 생육하였고 vitamin-free배지에서도 생육하였다. 또한, 30% 포도당과 5% NaCl을 각각 함유한 YPD배지에서 생육하는 내당성과 내염성이 있어 발효산업에서 유용한 내삼투압성 대사산물을 생성할것으로 사료된다. Ca, Cu, Fe, Mg 등의 중금속이온들에 대하여 800 ppm까지 내성을 보였고 포도당과 fructose, mannose, sucrose, maltose, lactose, cellobiose, raffinose, starch, sorbitol 등을 자화시켰으나 galactose, xylose, ribose 등을 자화시키지 못하였고, 대부분의 당류들을 발효시키지 못하였다. 이 효모는 처음 Cryptococcus fragicola 로 동정되었으나 현재 V. fragicola 로 재명명되었고, YM배지에서 구형-타원형으로 출아법으로 무성 생식하는 균으로 알려졌다[45].
미기록 효모균주들의 주요 효소 및 생리활성
선발된 6 균주의 국내 미기록 효모들의 건강 기능성 소재로서의 다양한 응용성을 알아보기 위해, 이들 효모균주들의 배양 상등액에 대한 탄수화물 분해관련 효소들과 단백질분해효소 활성 등을 측정하였다(Table 2).
이들 미기록 야생효모들의 배양 상등액들 중 A. adeninivorans WSC6-3 과 F. taiwaniana JRC6-2, V. fragicola SW-9 등의 glucoamylase 활성이 각각 58.0%, 59.0%, 59.0% 로 비교적 높아 이들 균주들이 포도당 생산에 매우 유용할 것으로 사료된다. 그러나 invertase 활성이 약 2.0-20%의 활성을 보였을 뿐 여타의 효소활성은 없거나 1% 미만의 낮은 활성을 보였다. 또한 C.sorboxylosaWSC25-4 균주의 배양 상등액의 알칼리성 단백질 분해효소 활성이 높아 이 균주의 세재산업 등에 대한 추가적인 응용 연구가 필요하다.
이들 미기록 효모들의 배양 상등액에 대한 항노화 및 주름생성 억제 등에 관련된 생리기능성을 조사한 결과는 Table 2와 같이 노화억제 관련 항산화 활성과 SOD-유사활성이 6균주 모두 70-98%로 매우 높았고 S. dispora JTS19-1과 V. fragicola SW-9의 항통풍성 잔틴산화효소 저해활성도 각각 70%와 80%로 높게 나타났다. 따라서 이들 미기록 균주들은 노화억제와 통풍예방을 위한 건강 소재 개발에 매우 유용할 것으로 사료된다. 한편, 주름생성억제에 관련된 elastase와 collagenase저해활성은 없거나 20%미만으로 낮았다.