황칠나무(Dendropanax trifidus)는 두릅나무과(Araliaceae)에 속하는 난대성 상록활엽수로 한국 특산식물이며, 우리나라 온대남부와 난대지역인 제주도, 보길도, 거문도, 거제도, 완도, 해남 등 남서해안과 일부 도서지역에 분포한다[1]. 황칠나무는 잎에 광택이 있고 단아한 수형 때문에 관상수로의 이용이 증가되고 있으며, 황칠나무의 잎 추출물은 면역활성, 줄기 추출물은 높은 고혈압 억제 효과가 보고되어 있고[2,3], 황칠나무 잎·가지·수액 추출물은 항균 작용이 있다고 알려져 있다[4].
국내 황칠나무에서 잎에 발생하는 병으로는 Alternaria panax, A. dendropanacis에 의한 2종의 진균병이 보고되어 있다[5,6]. 식물의 뿌리썩음에 관여하는 모잘록병을 일으키는 병원균으로는 Rhizoctonia solani, Pythium spp., Fusarium spp. 등이 있으나[7,8], 황칠나무의 뿌리썩음에 관여하는 병은 보고된 바 없다. 나무 묘목에서 뿌리썩음을 일으키는 병으로는 국내에서 낙엽송 묘목에 Fusarium oxysporum에 의한 모잘록 증상이 보고되어 있고[9], 국외에서는 Douglas-Fir (미송) 묘목에 F. oxysporum에 의한 모잘록 증상이 보고된 바 있다[10]. 이에 따라 본 연구에서는 병든 황칠나무 유묘 뿌리에서 병원균을 분리하여 동정하고, 건전한 황칠나무 유묘에 인공접공하여 병원성을 확인하였다.
병징
2021년 6월 전라남도 나주의 양묘장에서 파종하여 재배 중인 황칠나무 1년생 유묘의 30% 정도에서 발아율의 감소 및 유묘가 시들어 죽는 모잘록병과 유사한 피해가 발생하였다. 식물체의 지제부가 갈변하고 잘록해지는 증상이 관찰되었으며 뿌리도 갈변하여 생육이 저해되었다(Fig. 1A). 감염된 식물체 대부분은 서있지 못하고 쓰러졌으며, 식물체를 뽑아 보면 뿌리 끝부분이 썩어 있거나 잔뿌리가 거의 없고, 잎이 시들고 갈변하는 증상이 나타나기도 하였다(Fig. 1B).

Fig. 1.Symptoms and mycological characteristics of Fusarium root rot on seedling of Dendropanax trifidus caused by Fusarium oxysporum. (A) Dendropanax trifidus seedlings exhibiting low germination rate and root rot symptoms (right). (B) Brown encrosis appearing on stems and roots. (C ) Top and bottom view of F. oxysporum cultured on potato dextrose agar after 7 days. (D) Microconidia. (E) Macroconidia. Scale bars=20 μm. (F) Symptoms on stems and roots artificially inoculated with F. oxysporum. (G) Untreated control.
균학적 특성 및 염기서열 분석
병원균 분리를 위하여 이병묘목 15본의 뿌리와 줄기를 0.5-1 cm 길이로 잘라 1% 차아염소산나트륨(NaOCl) 용액으로 1분간 표면 살균하고, 멸균증류수로 3회 세척하여 무균작업대에서 건조하였다. 건조된 조직들은 감자한천 배지(potato dextrose agar, PDA)에 치상하고, 인큐베이터에서 25℃, 암실 환경에 5일간 배양되었다. 흰색 내지 연한 보라색을 띠는 Fusarium 균총이 뿌리 및 줄기 조직 주변으로 성장하였으며, 균총의 끝 부분을 떼어 새로운 PDA에 옮겨 총 9개의 균주를 획득하고, 각기 다른 이병묘목에서 3개 대표 균주를 선발하였다(CMML21-54, CMML21-55, CMML21-56). 모두 PDA에서 7일간 생장하여, 균총의 앞면은 연한 보라색 솜 같은(cottony) 형태를, 그리고 뒷면은 어두운 보라색을 띠었다(Fig. 1C). 분생포자 형성을 유도하기 위해 PDA에서 7일간 생장한 균총의 절편을 Mung bean broth 30 mL과 함께 50 mL conical tube에 넣고 25℃에서 150 rpm으로 4일간 배양하였다. 분생포자의 크기와 모양을 현미경(Olympus, Tokyo, Japan)으로 관찰한 결과 소형분생포자(microconidia)는 신장(kidney) 모양으로 크기는 6.67±0.40×2.87±0.16 µm이며 격막이 없었다(Fig. 1D). 대형분생포자(macroconidia)는 낫(sickle) 모양으로 크기는 43.03±2.89×3.57±0.22 µm이며 주로 3개의 격막을 가졌다(Fig. 1E). 균학적 특성조사 결과, 세 균주의 배양적, 형태적 특성은 Fusarium oxysporum과 일치하였다[11].
분리된 균주의 분자생물학적 동정을 위해 PDA에서 7일간 생장한 균사를 각각 0.5 g 채취하여 CTAB DNA 추출법으로 genomic DNA를 추출하였다[12]. 추출된 DNA 시료를 주형으로 하여 internal transcribed spacer (ITS) 영역과 translation elongation factor (EF) gene을 증폭하기 위해, 1 (5'-TCC GTA GGT GAA CCT GCG G-3')/ITS4 (5'-TCC GCT TAT TGA TAT GC-3')와 EF-1 (5'-ATG GGT AAG GAR GAC AAG AC-3')/EF-2 (5'-GGA RGT ACC AGT SAT CAT G-3') 프라이머를 사용하여 PCR을 수행하였다[13]. PCR은 GeneAmp PCR system 2700 (Applied Biosystems, Massachusetts, USA)을 사용하였으며, Takara Ex Taq® DNA polymerase를 활용한 PCR 조건은 pre-denaturation (95℃, 2분) 후, denaturation (95℃, 30초), annealing (ITS 50℃ 또는 EF1-α 52℃, 30초), extension (72℃, 1분)을 1 cycle로 하여 35회 반복 진행하였다. 증폭이 확인된 PCR 산물은 ExoSAP-IT Kit (Applied Biosystems, Massachusetts, USA) 처리한 후, 마크로젠(Macrogen, Daejeon, Korea)에 염기서열 분석을 의뢰하였다. 분석된 염기서열은 PHYDIT 프로그램을 이용하여 정렬하였고[14], GenBank에 등록된 염기서열과 비교한 결과 Fusarium oxysporum NRRL 43542 (ITS>99%, EF1-α>97%) 와 높은 상동성을 확인하였다. MEGA X 프로그램으로 Maximum Likelihood 계통수를 작성하였고[15], 3개 균주 모두 F. oxysporum 참고균주(NRRL 43542, NRRL 43466, CBS: 255.52)와 높은 bootstrap value (96%)로 군집을 이루었으며, 외집단(outgroup)은 F. biseptatum을 대상으로 하였다(Fig. 2). 계통분류학적 분석에 의해서 황칠나무에서 분리된 3균주는 F. oxysporum으로 동정되었다. 분석된 CMML21-54, CMML21-55, CMML21-56 균주의 ITS 염기서열과 EF1-α 염기서열은 NCBI GenBank에 accession number OP623453, OP623454, OP623455, OP651776, OP651777, OP651778로 등록하였다.
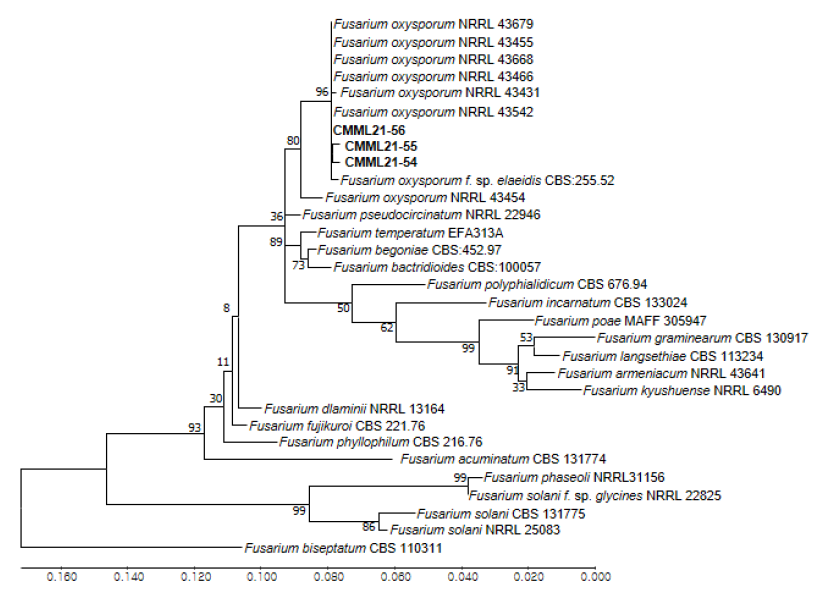
Fig. 2.Phylogenetic tree of Fusarium oxysporum strains isolated from stems and roots of Dendropanax trifidus and their related reference strains based on combined sequences of the internal transcribed spacer (ITS) region and translation elongation factor 1-α (EF1-α ) gene. The tree was generated using Maximum Likelihood analysis. The number in each branch indicates bootstrap values obtained after a bootstrap test with 1,000 replications. Bold type font indicates fungal strains in this tsudy.
병원성 검정
황칠나무에 대한 병원성 확인을 위해 1년생 황칠나무 유묘에서 분리한 두 균주(CMML21-54, CMML21-55)의 분생포자 현탁액을 각각 준비하였다. 상처를 통한 병원균의 침입을 유도하기 위해 뿌리 말단을 0.3-0.5 cm 절단하여 1×107 spores/mL 농도의 분생포자 현탁액을 1시간 침지 처리한 후 10 cm 지름의 포트에 1주씩 정식하였다. 균주당 3반복 처리하였으며, 대조구에는 멸균 증류수를 1시간 침지 처리하였다. 식물체는 플라스틱 컨테이너에 넣고 95±3%의 높은 습도를 유지하면서 25±2℃로 식물 배양실에서 20일간 유지되었다. 관찰 결과, CMML21-54와 CMML21-55 접종구에서 지제부와 줄기의 갈변 및 잘록한 현상을 확인하였다. 또한, 접종구에서 뿌리 조직이 고사하여 흑갈색의 병징과 함께 잔뿌리가 제거되는 현상을 확인하였다(Fig. 1F). 대조구에서는 상처부위의 뿌리조직이 정상적으로 회복되었으며, 지제부 및 지상부의 병징은 나타나지 않았다(Fig. 1G). 접종구 줄기의 병반을 떼어, 현미경으로 관찰하였을 때 2종류의 병원균 모두 F. oxysporum의 분생포자가 형성된 것을 확인하였다.
황칠나무는 수형이 아름답고, 약리 효과가 우수하여 국내 양묘 재배가 늘어나고 있으나, 재배 중 발생하는 병해에 대한 연구는 많이 이루어지지 않았다. 따라서 황칠나무에 피해를 주고 있는 병해에 대한 발생조사와 체계적인 관리방법에 관한 연구가 필요한 실정이다.
이상과 같이 황칠나무 뿌리썩음 증상에서 분리한 병원균은 형태적, 배양적 특성 및 DNA 염기서열 분석에 의해 F. oxysporum으로 동정되었고, 인위적 접종을 통해 황칠나무에 병원성이 있음이 확인되었다. 따라서 본 결과를 바탕으로 국내 황칠나무에 발생하는 뿌리썩음병균으로 F. oxysporum을 처음으로 보고하고자 한다.


