서론
표고는 단기소득임산물 버섯류 중 하나로 2020년 기준 18,468톤 생산되고, 생산액은 1,948억원으로 임가 소득에 가장 높은 비중을 차지하는 버섯이다[1]. 국내에서는 1990년대 초에 톱밥재배방법이 정립되고[2], 톱밥재배용 재배법, 품종, 관련기자재 등이 보급됨에 따라 점차 톱밥재배 임가의 비율이 늘어났으며, 2020년 현재 815임가에서 35,680,758봉의 배지를 재배하고 있다[3].
표고 톱밥배지는 재배하는 배지의 형태에 따라 ʻ원통형’, ʻ봉형’, ʻ사각’으로 구분하고 있으며, 이러한 배지 형태에 따라 종균 접종, 배양 및 버섯 발생 방법 등에서 일부 차이가 발생한다[4-6]. 표고는 종균 접종부터 버섯 발생 전까지 최소 110-120일의 배양기간을 필요로 하며, 이로 인해 버섯 재배기간이 느타리, 새송이 등 다른 재배버섯에 비해 상대적으로 길다. 임의로 톱밥배지 배양기간을 다 채우지 않고 줄여서 배양한 후, 버섯 발생을 시키는 경우에는 표고의 생산성이 떨어진다[7].
표고 톱밥배지의 배양기간에는 종균 접종방법과 접종량[8], 배지조성과 배지크기[9,10], 배양 중 광도, 온도, 배지 내 통기성 등[11] 다양한 조건이 영향을 주며, 이것은 버섯 생산성과 품질에도 영향을 준다. 이러한 조건을 최적화하면, 버섯 생산성과 품질을 유지하면서도 배양기간을 어느 정도 줄이는 것이 가능할 것으로 생각된다[8].
본 연구는 표고 톱밥배지의 재배조건을 최적화하기 위해 시도되었다. 기존 연구에서 표고 톱밥재배 시 액체종균을 이용하면 배양기간을 5% 단축시킬 수 있었다[8]. 여기에서는 배지조성, 종균접종량, 빛 조건을 달리하여 균사생장, 배양기간, 버섯 생산성 및 품질 비교를 통한 재배조건의 개선방안에 대해 알아보고자 하였다.
재료 및 방법
표고 균주
본 연구에 사용된 표고 균주는 국립산림과학원에서 출원한 품종인 산백향(등록번호 제189호. 산림품종관리센터)을 사용하였다. -80℃에서 보관중인 균주를 potato dextrose agar (PDA; Difco, Detroit, MI, USA) 평판배지에 접종하여 25℃에서 14일간 배양하여 균주의 상태를 확인한 후, 다시 한 번 PDA 평판배지에 접종하여 14일간 배양하였다. 배양을 완료한 균주는 종균의 접종원으로 사용하였다.
종균 제작 및 배양
재배시험에는 톱밥종균과 액체종균의 두 가지 종균을 사용하였다. 톱밥종균은 종균용 참나무 톱밥과 밀기울을 8:2 (w/w)의 비율로 섞어 함수율을 65%로 조절한 후, 1 L 용량의 종균병에 650 g씩 입병하였다. 이를 고압증기멸균(100℃ 60분, 121℃ 90분)한 뒤, 냉각실에서 냉각을 하였으며, 냉각을 마친 종균병에 배양을 마친 접종원을 접종하였다. 접종한 종균은 22℃ 배양실에서 30일간 배양하여 접종 종균으로 사용하였다.
액체종균은 potato dextrose broth (PDB; Difco, Detroit, MI, USA)배지를 사용하였다. 500 mL 삼각플라스크에 PDB 250 mL를 pH 5.5로 제작하여 고압증기멸균(121℃ 20분)한 뒤, 냉각을 하였다. 냉각을 마친 PDB 액체배지에 PDA 평판배지에 배양한 접종원을 코르크 보러(Cork Borer, Ø 8mm)를 이용해 25개 접종하여 22℃ 배양실에서 30일간 배양하였다. 배양 중에는 배양액 상층부에 균사매트가 생기지 않도록 흔들어주었다. 배양이 완료된 액체종균은 균질화기기(CN/MT-13K, Miulab, Hangzhou, China)로 15초간 균질화하여 접종 종균으로 사용하였다.
톱밥배지 제작 및 배양
표고 재배 농가에서 많이 사용하는 원통형 형태의 톱밥배지를 제작하였다. 입자크기 3-5 mm의 참나무 톱밥 42.4% (w/w) (상수리 나무 50%:신갈나무 50%), 입자크기 8-10 mm의 참나무 톱밥 42.4% (w/w), 밀기울 14.9% (w/w), 패화석 0.3% (w/w)의 조성으로 2.8 kg 중량, 함수율 60%의 원통형 톱밥 배지를 입봉하여 대조군으로 사용하였다. 옥수수가루를 사용한 톱밥배지는 밀기울 대신 옥수수가루를 15%의 비율로 넣어 톱밥배지를 같은 중량으로 제작하여 실험군으로 사용하였다. 입봉을 마친 톱밥배지는 고압증기멸균기를 이용하여 100℃ 100분, 105℃ 400분의 조건으로 살균을 한 뒤, 냉각실에서 냉각을 하였다. 냉각은 18℃에서 12시간 이상 실시하였다.
본 연구에서는 두 가지 형태의 종균을 냉각이 완료된 배지에 각각 접종하였다. 톱밥종균은 배지 각각의 접종구마다 각각 9, 12, 15 g 접종하였으며, 액체종균은 각각의 접종구마다 9, 12, 15 mL 접종하였다. 접종구는 배지마다 4개씩 만들었다. 접종한 부위는 테이프로 밀봉하여 외부로부터 유해균이 침입하는 것을 막아주었다. 접종이 끝난 톱밥배지는 배양실에서 23℃, 습도 60%의 조건으로 배양하였다. 총 배양기간 100일 중 암배양 60일, 명배양 40일을 실시하였으며, 암배양을 실시하는 동안 표고 균사의 호흡을 위해 침봉작업을 3회 실시하였다. 침봉작업은 접종 2주차, 4주차, 그리고 암배양이 끝나는 시기에 진행하였다. 명배양은 빛의 파장에 따라 두 가지 조건에서 실시하였으며, 기존에 사용하는 백색 LED와 청색 LED (300 lux)에서 나오는 빛을 이용해 명배양을 실시하였다. 배양이 완료된 후 발생실에서 온도 18±1℃, 상대습도 80±5℃의 조건으로 발생작업을 실시하여 버섯 발생을 유도하였다. 각각의 실험군들은 S1-S6, L1-L6으로 표시하였고, 대조군은 C로 표시하였다(Table 1).
Table 1
Effects of BFLJ on antioxidant enzyme activities in AAPH-treated LLC-PK1 cells.
생산성 및 특성 조사
발생작업을 통해 발이한 원기들은 발이 2-3일 경에 솎아주기를 실시하여 배지마다 10-12개의 원기가 남도록 하였다. 생육이 완료된 자실체들은 배지에 가깝도록 절단하여 수확하였다. 수확한 자실체들은 배지별로 생중량을 측정한 뒤, 외형적 특성을 ʻ신품종 심사를 위한 표고버섯 재배 및 특성조사 매뉴얼’에 따라 실시하였다[12]. 버섯의 중량, 갓의 직경과 두께, 대의 길이와 두께를 각각 측정하였다. 1차 발생이 완료된 후 3주간의 휴양기간을 가졌다. 온도 18±1℃, 상대습도 60%의 배양실에서 암조건으로 3주동안 배지 휴양을 가졌으며, 휴양이 끝난 배지는 침수조에서 30시간동안 침수를 통해 버섯 발생에 필요한 수분을 배지에 공급하였다. 침수가 끝난 뒤, 온도 18 ±1℃, 상대습도 80±5℃의 조건으로 발생작업을 진행하였고, 1차 발생과 같은 방법으로 생산량 및 자실체의 특성을 조사하였다. 버섯생산량에 대한 효율(biological efficiency, BE)은 배지 제작에 사용된 재료의 중량대비 생산량을 백분율로 환산하여 표시하였다.
전자 혀 분석
식용버섯의 맛 분석에 사용되는 전자 혀 분석기기인 ASTREE electronic tongue (Alpha M.O.S., Toulouse, France)를 이용해 Zeng 등[13]이 사용한 방법을 바탕으로 기초적인 맛 분석을 수행하였다. 50℃에서 48시간 열풍건조 하여 곱게 분쇄한 표고버섯 가루 1 g을 50 mL의 3차 증류수에 첨가하였다. 5분동안 와류 시킨 후 7,000 rpm/min으로 원심분리 하여 상층액을 분리하였다. 분리한 상층액 10 mL를 90 mL 3차 증류수와 섞어 전자 혀 분석(electric tongue analysis)을 하기 위한 시료로 사용하였다. 측정은 120초로 설정했고 5회 분석하였다. 7개의 센서(AHS [sourness], CTS [saltness], NMS [umami], ANS [sweetness], SCS [bitterness], PKS [보조센서], CPS [보조센서])를 사용하였으며, 이들은 다섯 가지의 맛을 감지하는데 사용하였다. 분석한 결과는 rolled-dumplings 분석을 통해 각 측정값을 확인 및 비교하였다.
결과 및 고찰
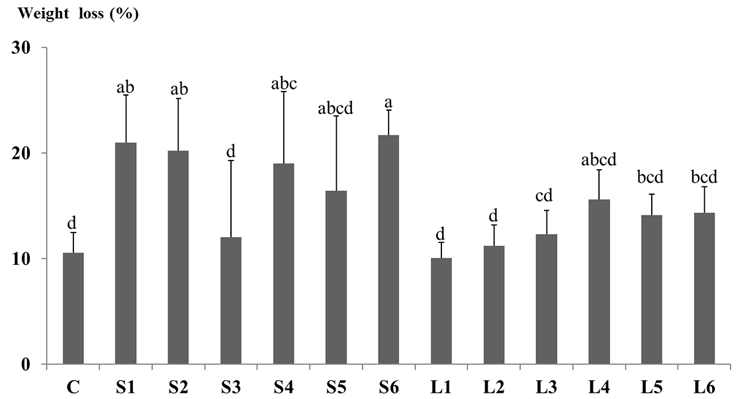
본 연구에서는 옥수수가루 및 청색광을 이용한 표고버섯 톱밥배지 재배방법의 개선방안에 대한 연구를 진행하였다. 옥수수가루의 성분들 중 유기물과 버섯균이 쉽게 이용할 수 있는 성분인 가용성 무질소물의 양이 높은 것으로 확인하였다[14]. 밀기울 대신 옥수수가루를 영양원으로 이용한 톱밥배지의 배양기간이 100일이 된 후, 배지의 중량감소율을 측정하였다(Fig. 1). C조건에서 중량감소율이 가장 낮았으며(10.5%), S6조건에서 중량감소율이 가장 높게 나타났다(21.7%). 옥수수가루를 사용한 경우, L1조건을 제외하면 C조건보다 중량감소율이 높았다. 톱밥종균을 사용한 실험조건에서 액체종균을 사용한 실험조건보다 중량감소율이 5.9% 높았으며(t=5.922, F=24.262, p<0.001), 청색 LED를 사용한 조건에서 중량감소율이 2.4% 더 높았다(t=1.943, F=4.786, p<0.05). 접종량에 따른 배양완료된 배지의 중량감소율은 유의미한 관계를 보여주지 않았다.
Fig. 1
Comparison of weight loss rate (%) of sawdust media after 100 days under different cultivation conditions. a-d: The value indicates a significant difference (Tukey test p<0.05).
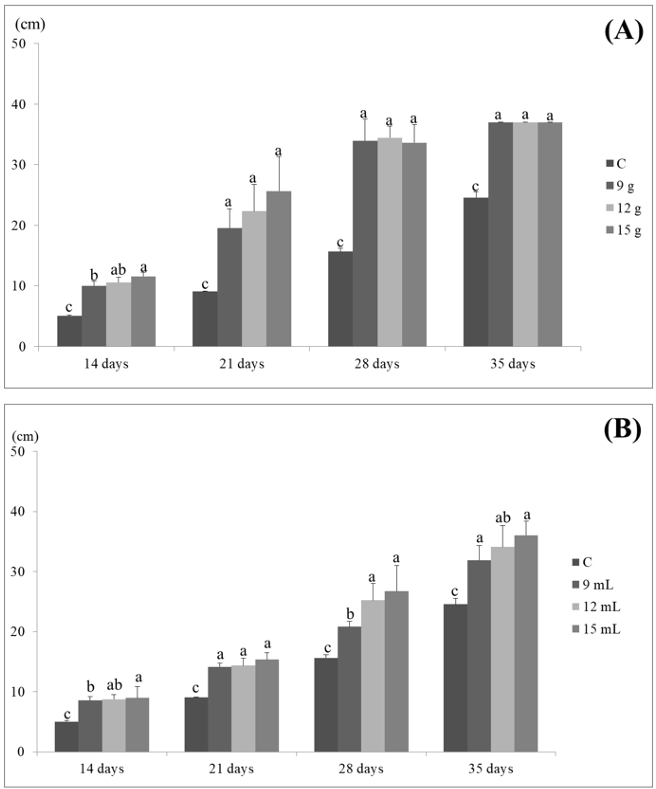
종균의 형태 및 접종량에 따른 배양 초기 균사생장속도를 확인하였다(Fig. 2). 톱밥 종균의 경우 배양 14일차까지는 접종량이 많은 톱밥배지에서 균사생장이 빠른 것으로 나타났으나, 그 이후로는 접종량과 생장속도의 관계가 유의미한 결과를 보여주지 못하였다. 반면, 액체종균은 균사가 배지 표면에 만연할 때까지 종균 접종량이 많을수록 균사의 생장이 빠른 것으로 나타났다. 균사가 배지표면에 만연된 후에는 접종량이 톱밥배지 배양 및 갈변에 영향을 주지 않았다.
Fig. 2
Initial mycelial growth on the surface of sawdust medium. (A) Sawdust inoculum, (B) Liquid medium. a-c: The value indicates a significant difference (Tukey test p<0.05).
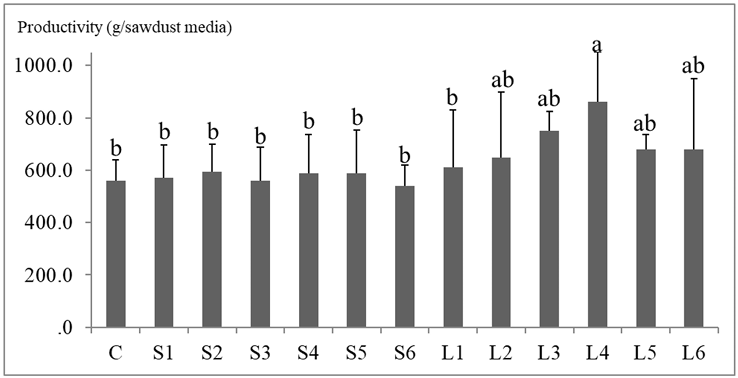
배양이 완료된 배지에서 버섯을 수확하여 생산성을 조사하였다(Fig. 3). L4 조건에서 생산성이 가장 높았으며(749.6 g/media, BE 87.9%), 그 뒤로 L3 (749.8 g/media, BE 76.5%), L5 (680.2 g/media, BE 69.41%) 순서로 생산성이 높았다. S6 (539.6 g/media, BE 55.0%)의 생산성이 가장 낮았으며, C (559.6 g/media, BE 57.1%)의 생산성이 그 다음으로 낮았다. 전체적으로 액체종균을 사용한 실험군에서 생산성 및 BE가 높았다. 종균의 형태에 따른 생산성 차이를 t-test를 사용해 분석한 결과, 액체종균을 사용할 경우 생산성이 더 높은 것으로 나타났다(t=3.150, F=3.150, p<0.01). 명배양 시 청색광을 사용한 조건과 백색광을 사용한 조건의 생산성을 비교해 본 결과 청색광을 사용한 조건에서의 생산성이 높았다(t = 0.826, p<0.05).
Fig. 3
Comparison of fruiting body production of ‘Sanbaekhyang’ on sawdust media under different cultivation conditions. a, b: The value indicates a significant difference (Tukey test p<0.05).
수확한 버섯 자실체의 외형적 특성을 조사하였다(Table 2). 버섯 자실체의 무게는 C (39.6±14.6 g), S5 (38.7±18.9 g), S2(38.5±18.1 g)의 순서로 무거웠다. 버섯 자실체의 갓 직경은 S5 (69.2±12.6 mm), C (68.8±12.3 mm), S2 (66.7±12.8 mm)의 순서로 크게 나타났으며, 갓 두께는 C (14.2±2.1 mm), L2 (13.2±2.5 mm), L4 (12.1±2.3 mm)의 순서로 두껍게 나타났다. 버섯 대의 길이는 S1 (55.4 ±9.8 mm), S5 (53.3±9.3 mm), S4 (53.0±10.7 mm)에서 대가 긴 것으로 나타났으며, 대의 두께는 S2 (12.9±2.9 mm), C (12.7±3.0 mm), S1 (12.6±2.4 mm)에서 다른 조건들보다 두껍게 나타났다. 각 배양조건에 따른 자실체의 특성을 t-test를 통해 검증하였다. 종균의 형태에 따른 자실체의 특성을 비교한 결과, 톱밥종균이 자실체의 중량(t=12.160), 갓직경(t=6.901), 대길이(t=13.293), 대두께(t=6.795)의 값이 더 높은 것으로 나타났다. 명배양 과정에서 사용한 광원의 색상에 따른 자실체 특성 분석 비교 결과, 중량(t=2.412), 대두께(t=2.915)의 특성이 청색광을 사용한 경우 더 우월한 것으로 나타났다.
Table 2
Comparison of morphological characteristics of fruiting bodies under different cultivation conditions.
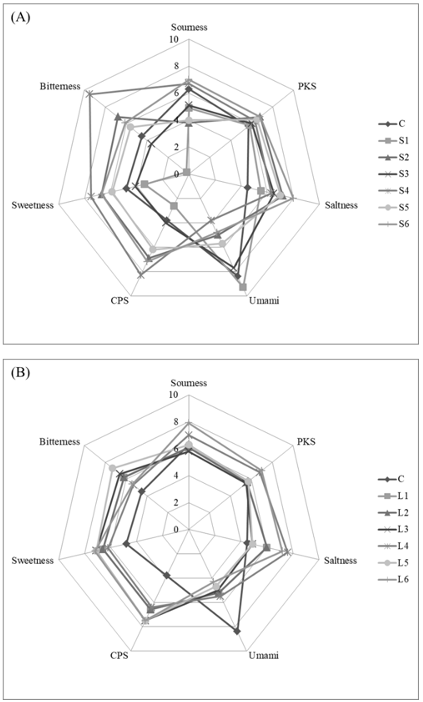
다섯가지의 센서를 이용하여 기초적인 맛 분석을 실시하였다(Fig. 4). Sourness (시큼한 맛)은 L6에서 가장 높았으며(7.90), S2가 가장 낮았다(3.80). Saltness (짠맛)은 S6가 가장 높았고(8.00) 대조군(C)가 가장 낮았다(4.50). Sweetness (단맛)은 S4가 가장 높았으며(7.5), S1이 가장 낮았다(3.40). Bitterness (쓴맛)은 S4에서 가장 높고(9.50) S1에서 가장 낮았으며(2.40), 감칠맛을 나타내는 umami는 S1에서 가장 높았으며(9.3) S4에서 가장 낮았다(3.80). 배지의 영양분을 밀기울에서 옥수수가루로 변화시킨 결과 saltness의 수치가 증가하였으며, 청색 LED광을 명배양과정에서 이용한 결과 sourness의 수치가 증가하는 것을 확인할 수 있었다.
Fig. 4
Intensity comparison score radar chart of rolled-dumplings with various levels of hot-air dried (50℃) ‘Sanbaekhyang’ using taste sensor of e-tongue. (A) Sawdust inoculum, (B) Liquid inoculum. PKS, auxiliary sensor; CPS, standard sensor.
표고버섯은 예로부터 유칼립투스류, 참나무류, 망고, 아보카도와 같은 종류의 나무에서 자라왔으며, 상수리나무(Quercucs acutissima)는 동아시아와 중국에서 옛날부터 사용해 왔고, 현재 북미지역에서도 이용하고 있다. 이전에는 나무 원목에 직접 재배하는 방법이었으나, 현재는 플라스틱 비닐을 이용한 버섯 재배가 주로 이루어지고 있다. 이러한 재배에서는 다양한 임업, 농업 부산물들을 버섯 재배에 기질로 이용할 수 있다[15]. 목재를 이용해왔던 표고버섯 재배는, 재배환경에 적합하고 경제성을 갖춘 재료를 이용하여 재배하는 것이 필요한 상황이다. 목재 바이오매스인 리그닌, 셀룰로오스, 헤미셀룰로오스 등은 균류의 생장에 필수적이며, 표고버섯은 이들을 효과적으로 분해하여 이용할 수 있는 균류로 알려져 있다. 표고버섯 자실체가 발생한 뒤에는 이들의 양이 감소하는 것으로 알려져 있는데, 셀룰로오스 15-34%, 헤미셀룰로오스 10-26%, 리그닌은 소량 감소하는 것으로 알려져 있다[16]. 백색부후균에 의한 목질계 바이오매스의 단당류로의 생물학적 전환 작용은 주로 리그닌 분해효소, 헤미셀룰로오스 및 셀룰로오스 분해효소들을 포함한 가수분해 효소에 의해 일어나며, 이들에 의해 위 물질들은 균사의 생장과 자실체의 발달에 이용된다[17]. 브라질에서는 유칼립투스속의 나무를 널리 이용하고 있으며, 그 외의 지역에서도 이용하고 있다. 사탕수수, 옥수수, 옥수수대의 부산물과 같은 농업 부산물들은 쉽게 구할 수 있는 기질들이다. 그리고 밀기울, 쌀, 콩, 오트 또는 옥수수를 첨가하여 이용 가능한 영양분의 증가와 더 나은 생장, 생산을 이끌어내기도 한다[18].
옥수수는 세계적으로 중요하게 이용되는 작물 중 하나이며, 옥수수를 가공하는 과정에서 나오는 부산물은 손쉽게 획득이 가능한 부산물이다. 콘코브와 같은 옥수수 부산물을 톱밥대신 39% 첨가해주었을 경우 표고버섯 생산량의 증가와 향을 향상시켜준다는 이전 연구결과가 있다[16]. 톱밥배지 제작 과정에서 이전부터 이용하던 톱밥을 옥수수로 대체할 경우, 멸균 후 톱밥배지의 pH가 6.27-6.67이며, 이러한 pH 조건은 균사가 생장하기에 적합한 환경이고, 대체해준 옥수수가 이러한 환경을 만들어 준다고 보고되어 있다[19]. 본 연구에서도 옥수수가루를 이용한 톱밥배지의 경우 배양 초기부터 균사 만연시기까지의 균사 생장 속도가 기존의 톱밥 및 밀기울을 이용한 배지(C)보다 더 빠른 것으로 나타났으며, 배지 표면에 균사가 만연하는데까지 걸리는 시간이 4-6일 단축되는 것으로 확인되었다.
빛에 의한 배지 표면의 갈변과정에 대한 기작은 완벽히 알려지지 않았지만, 표고의 생산에서 중요한 단계이며, 대부분의 표고 재배 과정에서 일반적으로 이루어지는 과정이다. 이 과정은 표고버섯의 수확량, 발이 수, 유해균 및 해충에 대한 저항력에 큰 영향을 미친다[16]. 갈변과정을 통해 갈색의 피막이 형성됨으로써 버섯의 품질 향상과 오염율의 감소가 나타나는데, 몇몇 연구들에서는 이러한 갈변의 정도가 빛, 환기, 온도에 의해 다양하게 조절된다고 보고되어 있으며, 특히 산소와 빛에 노출됨으로써 이 단계가 가속화된다고 알려져 있다[20]. 갈변 과정에서 주어지는 빛의 양과 종류는 균사의 갈변에 영향을 준다. 그 중 청색광은 몇몇 버섯에서의 균사 형성 및 자실체의 발달에 필요하다고 보고되어 있으며, 표고버섯에는 원기의 형성 및 발달에 영향을 준다고 알려져 있다. Sakamoto 등[21]의 연구에 따르면 청색광 조건에서 갓이 더 크고 두꺼웠으며, 대의 길이는 짧았다고 보고되었고, Yu 등[16]에 따르면 팽이버섯(Flammulina velutipes)을 청색광에서 배양할 경우, 적색광이나 암조건에서 배양하는 것보다 갓이 크고 대가 짧다고 보고되기도 하였다. 본 연구에서도 청색광을 사용한 실험군에서 대가 더 두껍고, 버섯이 더 무거운 것으로 확인되었다. 표고버섯에서는 청색광이 다른 환경에 비해 갓의 색을 더 어둡게 만들어 준다고 하였다[22]. 그 외에도 칼슘이나 마그네슘이 포함되어 있는 배지에서도 균사의 갈변이 나타난다고 보고되었으며, 갈변된 균사의 추출물에서는 높은 렉틴활성이 나타나는데 이는 배지의 질소원에 영향을 받는 것으로 보고되었다[23].
식용버섯에서 아미노산류(Asp, Glu)들은 감칠맛(umami)를 내는 요소들이다. 감칠맛은 음식의 기호성에 기여하고, 음식 섭취를 촉진하며 음식에 부정적인 영향을 미치는 쓴맛을 억제하며 짠맛을 강화시킨다[24]. 버섯의 화학적 구성은 생장과정에서 사용된 기질의 화학적 구성에 영향을 받으며, 이는 크고 작은 영양분의 축적과 관련이 있다. 그렇기에 사용된 배지의 성분 변화가 버섯의 맛과 영양분에 영향을 줄 것이라고 볼 수도 있다. 수확한 표고의 관리에 따라 맛과 영양이 변하기도 하는데, 표고를 건조하면 비타민 D가 활성화되고, 감칠맛이 향상된다. 이는 5’-guanosin monophosphate의 증가 때문이며, 이는 영양적 측면뿐 아니라 맛과 향의 향상에도 영향을 준다고 알려져 있다[25].
본 연구에서도 표고 재배 과정에서의 초기 균사 생장 속도 및 버섯의 생산량, 품질을 향상시키기 위해 옥수수가루를 기질로 사용하고, 액체종균의 사용 및 청색광을 이용한 톱밥배지 배양기간 동안의 배지갈변, 버섯 생산량 등을 조사하였다. 그 결과, 배양기간의 단축하면서 버섯의 생산량을 증가시킬 수 있는 가능성은 보였으나, 품질의 향상에는 더 다양한 연구가 필요하다고 여겨졌다. 그리고 다양한 품종들 및 재배형태들에 적용할 수 있는 개선된 재배법을 매뉴얼화 하는 것이 필요하다고 생각된다.


