서론
최근 각종 과일과 채소, 약용식물 등의 색소들이 항산화활성, 전립선 암 등에 대한 항암성, 항비만활성 등이 있어 건강식품이나 의약소재로서 매우 유용한 phytochemical로 개발되고 있다[1]. 그러나, 이들 천연 색소생산에는 생산 기간이 비교적 길고 추출 등의 복잡한 공정들이 요구되는 문제점 등이 있어 경제성 측면에서 이들에 비하여 비교적 쉽게 단시간에 대량 배양이 가능한 미생물 특히 효모로부터 고부가가치의 생리활성 물질 생산 연구가 최근 많이 실시되고 있다[2-13].
지금까지 효모의 주요 생리활성으로 항고혈압성 angiotensin-Ⅰ 전환효소저해물질[2], 항치매성 β-secretase 저해물질[3]과 acetylcholinesterase 저해물질[4], 혈관신생억제물질[5], 미백성 tyrosinase 저해 물질[6]과 혈전용해물질[7], 대장암 발병 억제관련 β-glucuronidase저해물질[10]등이 보고되었다. 특히 최근 probiotics 작용을 하는 Saccharomyces boulardii균주가 보고[8]됨에 따라 새로운 건강소재 생산을 위한 다양한 효모들이 자연환경 등으로부터 분리, 동정되었다[9,11-13].
그러나 지금까지 색소생성 효모에 관한 주요 연구로는 carotenoid색소를 생산하는 Rhodotorula glutinis (적색색소)와 Rh. flava (황색색소), 항진균제인 aureobasidin과 biopolymer등을 생산하는 것으로 알려진 Aureobasidium pullulans (흑색색소) 등이 있고 사출 포자 효모인 Sporobolomyces속 효모와 담자 포자 생성 효모인 Rhodospordium속 효모들이 적색 색소를 생성하는 것으로 보고되었으나[1,14] 많은 색소생성 효모들의 다양한 산업적 응용 연구는 아직까지 미흡한 실정이다.
따라서 본 연구에서는 비병원성 야생 색소 효모로부터 유용효소나 생리활성 물질들을 생산하여 이를 건강소재 산업에 응용하고자 먼저 대전광역시 월평공원 등으로부터 분리, 동정한 야생 효모들 중 비병원성 색소 효모들을 선별하였다. 이들의 배양 상등액과 무세포추출물들을 각각 제조하여 각종 생리활성과 효소활성들을 측정하여 항산화물질과 항통풍성 xanthin 산화효소 저해물질 생산 우수 야생 색소 효모들을 최종 선발하였다. 이들의 항산화물질과 xanthin 산화효소 저해물질의 생산 최적 조건을 검토하였고 이들 선발 균주들의 균학적 특성들을 조사하였다.
재료 및 방법
비병원성 야생 색소 효모들의 배양 상등액과 무세포추출물의 제조
대전광역시 월평공원 등으로부터 분리하여 선별한 비병원성 야생 색소 효모들을 yeast extractpeptone-dextrose (YPD) 배지에 접종하여 30℃에서 48시간 배양한 후 8,000 rpm으로 20분간 원심 분리하여 배양 상등액과 세포 균체들을 얻었다. 세포 균체들을 다시 0.1 M Tris-HCl완충용액(pH 8.3)에 현탁 시킨 후 초음파 균체파쇄기(Vibra Cell; Sonics 대전광역시 월평공원 등으로부터 분리하여 선별한 비병원성 야생 색소 효모들을 yeast extractpeptone-dextrose (YPD) 배지에 접종하여 30℃에서 48시간 배양한 후 8,000 rpm으로 20분간 원심 분리하여 배양 상등액과 세포 균체들을 얻었다. 세포 균체들을 다시 0.1 M Tris-HCl완충용액(pH 8.3)에 현탁 시킨 후 초음파 균체파쇄기(Vibra Cell; Sonics & Materials, Newtown, CT, USA)로 파쇄하고 12,000 rpm으로 20분간 원심 분리한 다음 상등액을 회수하여 무세포추출물 시료로 하였다[13]. Materials, Newtown, CT, USA)로 파쇄하고 12,000 rpm으로 20분간 원심 분리한 다음 상등액을 회수하여 무세포추출물 시료로 하였다[13].
생리활성 측정
항산화 활성과 superoxide dismutase (SOD) 유사활성; 선발 균주의 배양 상등액과 무세포 추출물들을 각각 DPPH (α-dipenyl-β-picrylhydrazyl)와 혼합한 후 plate reader를 이 용하여 525 nm에서 10분 동안 흡광도를 측정한 후 DPPH 활성을 계산하였다. 또한 SOD 유사 활성은 24 mM pyrogallol 와 plate reader를 이용하여 420 nm에서 흡광도를 측정하여 조사하였다[15,16].
혈전용해 활성; fibrinogen을 사용하여 생성된 투명환(clear zone)의 직경을 측정하였다[16,17]. 양성 대조구로는 plasmin (2 U/mg protein, Sigma-Aldrich, St. Louis, MO, USA)을 사용하였다.
Acetylcholinesterase (AChE) 저해활성; AChE와acetylthiocholine iodide, 5,5’-Dithiobis 등을 이용하여 plate reader로 415 nm에서 흡광도를 측정하여 AChE 저해활성을 조사하였다[4].
Angiotensin Ⅰ-converting enzyme (ACE) 저해활성; 배양 상등액과 무세포 추출물들을 각각 ACE 와 기질인 hippuryl-histidyl-leucine을 반응시키고 생성된 hippuryl 함량을 228 nm에서 흡광도를 측정하여 조사하였다[2].
Tyrosinase 저해활성과 xanthine oxidase 저해 활성; L-tyrosine을 이용하여 plate reader로 470 nm에서 흡광도를 측정하여 tyrosinase 저해활성 조사하였다[18]. Xanthine oxidase 저해 활성은 xanthine과 xanthine oxidase을 배양 상등액과 무세포 추출물로 각각 반응을 시킨 후 생성된 uric acid함량을 292 nm에서 흡광도를 측정하여 조사하였다[13,19].
Elastase와 collagenase 저해활성; N-Succinyl-(Ala)3-p-nitroanilide와 elastase (0.2 unit/mL)을 시료들에 혼합 후 plate reader를 이용하여 410 nm에서 흡광도를 측정하여 elastase 활성을 조사하였고[20], 4-Phenylazobenzyloxycarbonyl-Pro-Leu-Gly-Pro-D-Arg과 collagenase (0.5 mg/mL)를 시료들과 혼합 후 6% 구연산과 에칠아세테이트를 가하여 반응시킨 후 원심분리 하여 얻은 상등액의 흡광도를 340 nm에서 측정하여 collagenase 저해활성을 조사하였다[12].
α-glucosidase 저해활성과 β-glucosidase 활성; 먼저 α-glucosidase 저해활성은 α-glucosidase와 p-nitrophenyl- β-D-glucopyranoside (pNPG)를 무세포 추출물로 반응시킨 후 plate reader로 405 nm에서 p-nitrophenol 함량을 측정하여 저해활성을 조사하였다[21]. 또한 phytoestrogen인 genistein의 흡수율 증진에 관여하는 β-glucosidase 활성은 pNPG를 기질로 하여 분광분석법으로 측정하였다[21].
β-glucuronidase 저해활성; β-glucuronidase 저해활성은 배양 상등액 및 무세포 추출물 각각에 0.1 M 인산완충용액(pH 7.0) 과 10 mM p-nitrophenyl-D-glucuruonide, β-glucuronidase (0.4 unit/mL)를 혼합한 후 37℃에서 30분간 반응시켰다. 이후 0.25 N NaOH를 가하여 반응 정지시킨 후 원심 분리하여 얻은 상등액의 흡광도를 405 nm에서 측정하여 저해활성을 조사하였다[10].
효소활성 측정
α-amylase, β-amylase와 glucoamylase 활성; 가용성 전분을 기질로 α-amylase 활성은 생성된 dextrin 함량을 요오드 반응으로 발색 시켜 670 nm에서 흡광도를 측정하여 정량 하였고 β-amylase과 glucoamylase 활성은 DNS법을 이용하여 생성된 환원당 함량을 535 nm에서 흡광도를 측정하여 정량하였다[22].
Invertase 활성과 β-galactosidase 활성; Invertase 활성은 sucrose를 기질로 사용하여 측정하였고[23], β-galactosidase 활성은 o-nitrophenyl-β-D-galactopyranoside을 기질로 하여 반응시킨 후 생성된 p-nitrophenol 함량을 410 nm에서 흡광도를 측정하였다[24].
Cellulase 활성과 lipase 활성; Cellulase 활성은 1% carboxymethyl cellulose를 이용한 분광분석법으로 측정하였고[25], lipase 활성은 olive oil과 반응시킨 후 acetone-ethanol을 첨가하여 반응 정지한 다음 phenolphthalein지시약으로의 0.05 N NaOH으로 적정하여 측정하였다[26].
Protease 활성; Casein을 기질로 반응시킨 후 folin 시약으로 발색 하여 660 nm에서 흡광도를 측정하였다[27]
균학적 특성과 자화성 및 발효성
형태 및 배양 특성; 선발된 항산화활성 우수 효모와 xanthin 산화효소 저해활성 우수 효모들을 각각 potassium acetate-yeast extract dextrose 배지와 glucose-peptone-yeast extract 고체배지에서 30℃에서 24시간 배양한 후 배양액을 슬라이드 글라스(76 × 26 mm, Marienfeld, Lauda-Königshofen, Germany)에 점적하여 효모 세포 염색법 등으로 고정하였다. 이들을 OLYMPUS BX43 (Olympus, Tokyo, Japan)현미경과 eXcopex3프로그램을 이용하여 형태 및 포자, 의균사 형성 유무 등의 형태적 특징을 조사하였다[29]. 각종 중금속 이온들에 대한 내성은 YPD배지에 중금속을 400 ppm과 800 ppm씩 각각 첨가하여 선발 균주들을 30℃에서 24시간 배양한 후 660 nm에서 흡광도를 측정하여 생육도를 조사하였다[29].
탄소원에 대한 자화성과 발효성; 선발된 효모들을 yeast nitrogen base (w/o amino acids, BD Difco, Le Pont-de-Claix, France) 액체배지에durham tube 넣고 접종하여 30℃에서 배양하면서 생육도와 이산화탄소 생성 유무 등을 확인하여 탄소원들의 자화성과 발효성을 조사하였다[29].
결과 및 고찰
비병원성 야생 색소 효모들의 생리활성
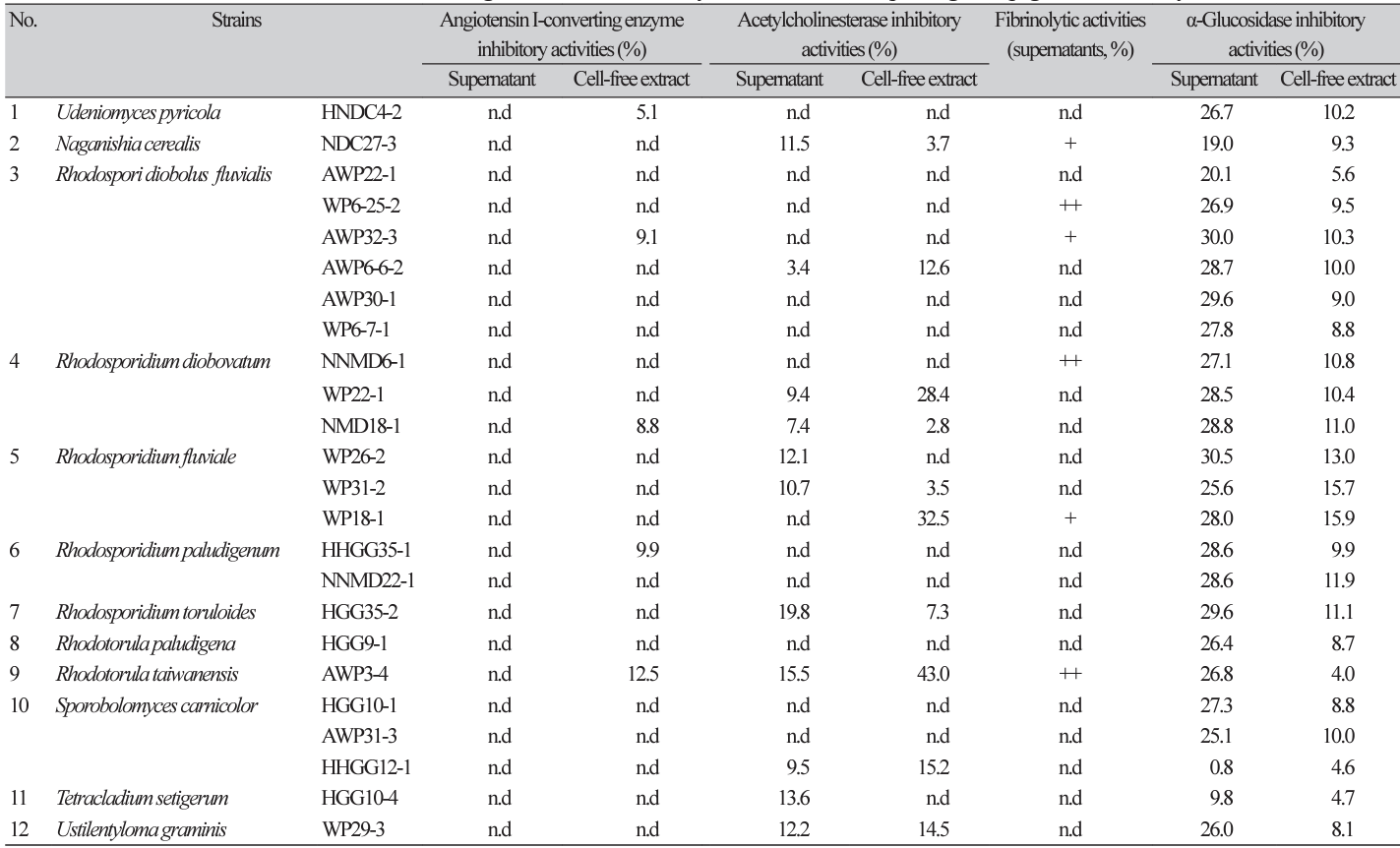
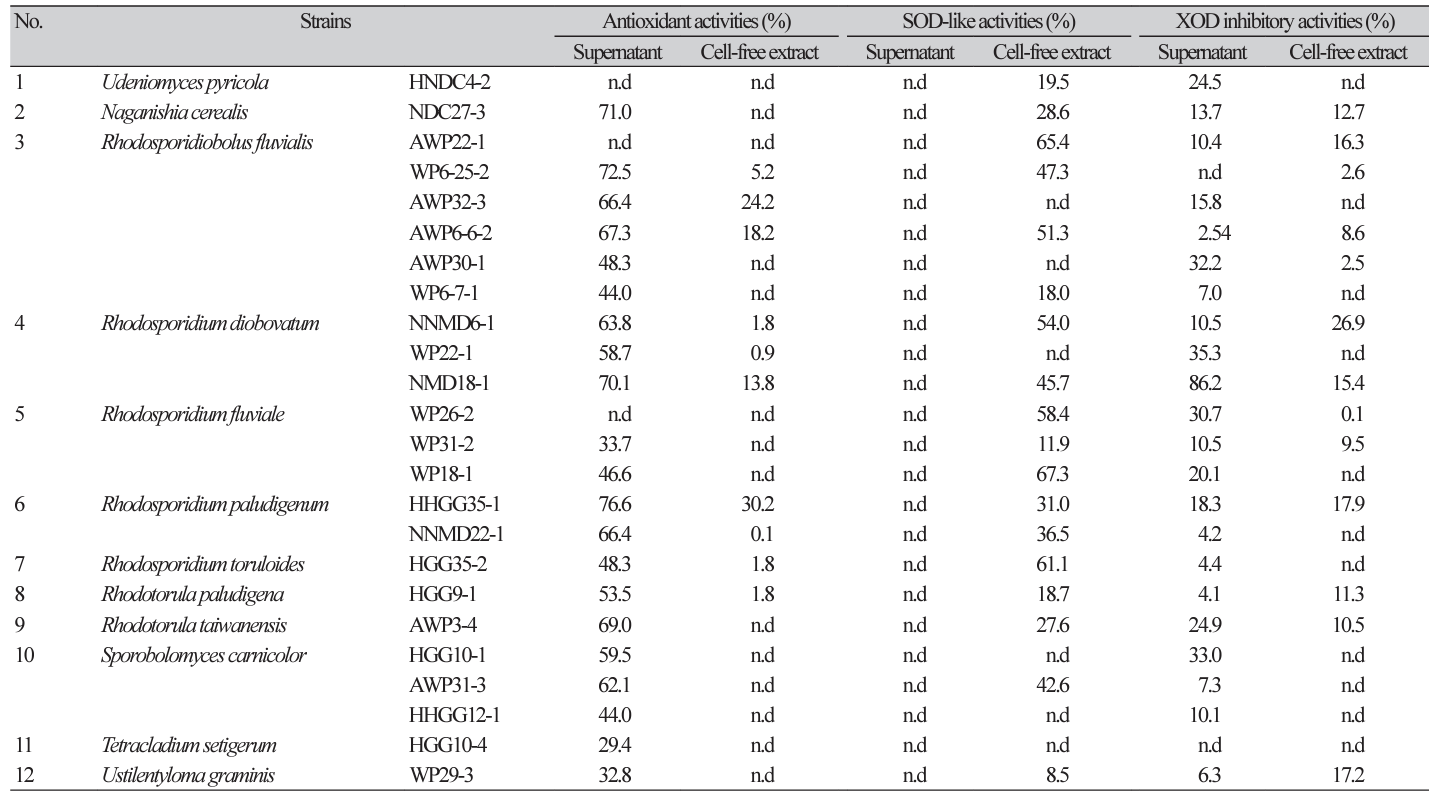
대전광역시 월평공원 등으로부터 분리, 동정한 186균주 야생 효모들 중 1차로 색소 효모 18종 38균주들을 선별하였고 이들 중 비병원성 효모 12종 24균주들을 시험 균주로 최종 선별하였다. 이들 색소 효모들의 배양 상등액과 무세포추출물들에 대한 생리활성들을 조사하였다(Table 1-3).
먼저, 항산화활성은 무세포추출물들보다 배양 상등액들이 대체로 높았고 특히 Rh. paludigenum HHGG35-1의 배양 상등액의 항산화 활성이 76.6%로 가장 높았다. Rh. fluviale WP18-1의 SOD 유사활성도 무세포추출물에서 67.3%로 높았고 항산화활성과는 다르게 대체로 무세포추출물들이 배양 상등액보다 높은 활성을 보였다.
Rh. diobovatum NMD18-1의 배양 상등액에서 xanthin 산화효소 저해활성이 86.2%로 높았고 항고혈압성 ACE저해활성은 없거나 15% 미만으로 낮았으며 항치매성 AChE저해활성은 Rh. taiwanensis AWP3-4의 무세포추출물이 43.0%를 보였다(Table 1).
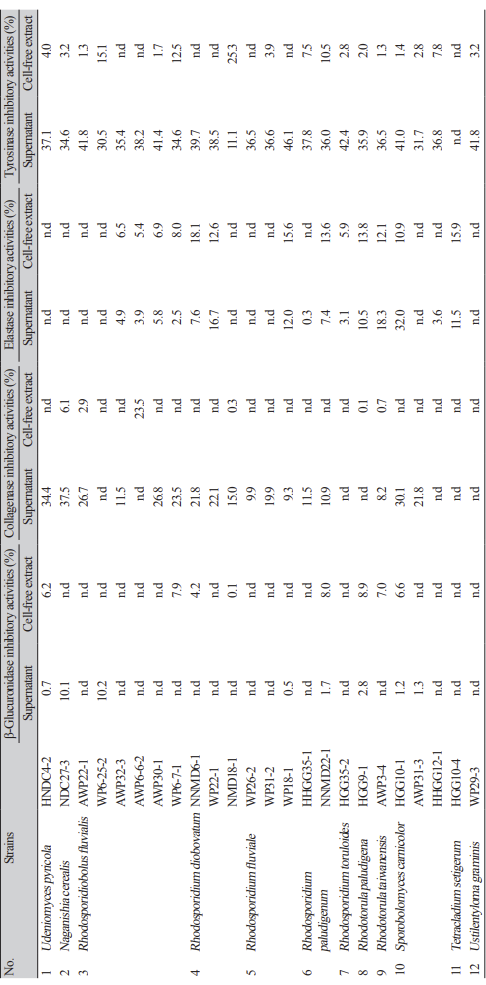
혈전용해활성은 24균주들중 6균주들이 활성을 나타내었고(Table 2) 피부 주름생성 억제에 관련된 collagenase 저해활성은 N. cerealis NDC27-3의 배양 상등액이 37.8%, 미백관련 tyrosinase 저해활성은 Rh. fluviale WP18-1의 배양 상등액이 46.1% 이었다(Table 3). 여타의 생리활성들은 없거나 10% 미만으로 낮았다.
Table 1
Antioxidant activities, SOD-like activities and xanthin oxidase inhibitory activities of non-pathogenic pigmented wild yeasts.
비병원성 야생 색소 효모들의 효소활성
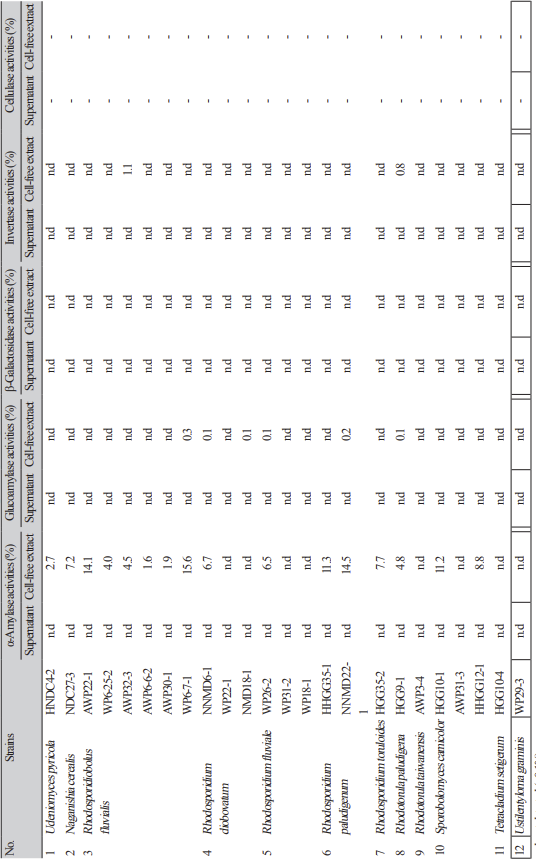
비병원성 색소 효모들의 배양 상등액과 무세포추출물들에 대하여 발효산업에서 많이 사용되고 있는 효소들의 활성을 측정한 결과는 Table 4, 5와 같다. α-Amylase 활성은 Rh. fluvialis WP6-7-1의 무세포 추출물이 15.6%, Rh. paludigenum NNMD22-1는 14.5%이었고 Rh. paludigenum HHGG351 과 Sp. carnicolor HGG10-1의 무세포추출물들도 각각 11.5%와 11.2%를 보였다(Table 4).
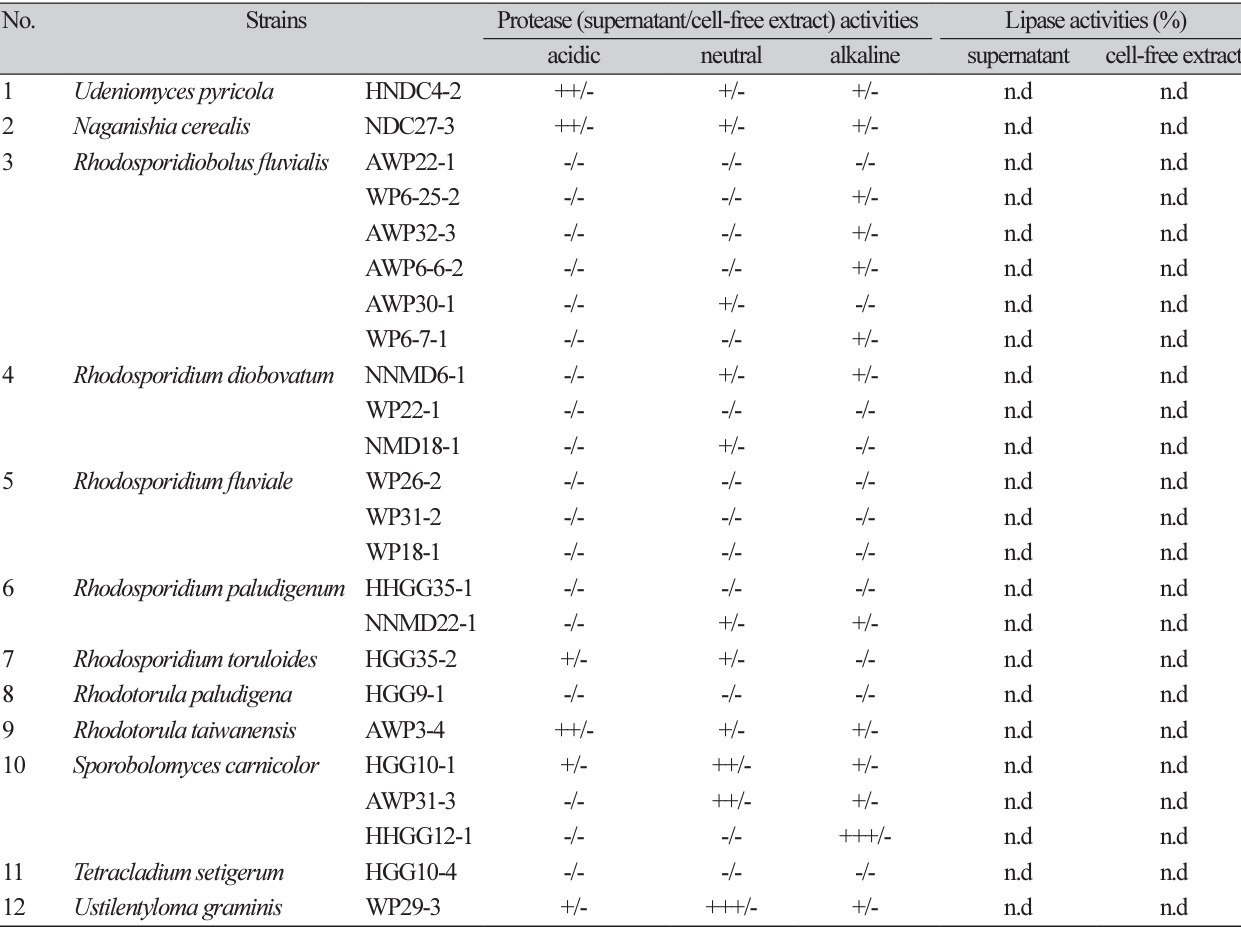
또한 Sp. carnicolor HHGG12-1 배양 상등액의 알칼리성 protease 와 U. graminis WP29-3 배양 상등액의 중성 protease 활성이 높아 이들 균주들은 세제 개발에 유용할 것으로 사료된다(Table 5).
한편, invertase, β-galactosidase, glucoamylase, cellulase, lipase 활성 등은 없거나 매우 미약하였다.
이상의 생리활성과 효소 활성들을 종합하였을 때 각종 질병과 노화억제에 관련된 주요 생리활성인 항산화활성 우수 효모로 Rh. paludigenum HHGG35-1 균주와항통풍성 xanthin 산화효소 저해활성 우수 효모로 Rh. diobovatum NMD18-1 등 2균주들을 최종 우수 효모들로 선발하였다. Yang 등[14]은 적색 효모인 Rh. paludigenum의 건조 균체 분말 첨가 사료가 새우의 항산화활성 증진에 관여한다고 보고하였고 Hyun 등[30] 은 야생화에서 분리한 비병원성 야생 효모 Ps. hubeiensis 228-S-1의 xanthin 산화효소 저해활성이 19.6% 이었다는 결과보다 본 선발 균주가 약 66% 더 높은 xanthin 산화효소 저해활성을 보여 산업적 응용이 큰 우수 효모균주로 사료된다.
항산화물질과 xanthin 산화효소 저해물질 생산조건
항산화물질 생산 우수 균주 Rh. paludigenum HHGG35-1와 xanthin 산화효소 저해물질 생산 균주 Rh. diobovatum NMD18-1들의 항산화물질과 xanthin 산화효소 저해물질 생산에 미치는 배지와 배지의 초기 pH들의 영향을 조사한 결과 두 생리활성 물질들 모두 초기 pH 6.5로 조정한 YPD 배지에 배양하여 얻은 배양 상등액들이 각각 가장 높은 76.4%의 항산화활성과 89.3%의 xanthin 산화효소 저해활성을 보였다(data not shown).
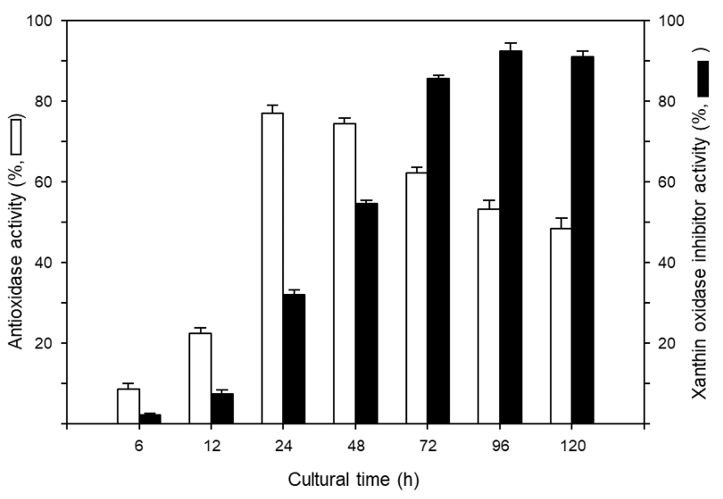
또한, xanthin oxidase 저해활성은 Rh. diobovatum NMD18-1의 배양 시간이 길어짐에 따라 증가하여 생육이 정지기를 지나 쇠퇴기로 들어가는 배양 96시간에 91.6%로 최고의 저해활성을 보였고 배양 120시간까지도 80% 이상의 높은 xanthin oxidase 저해활성을 보였다(Fig. 1).
항산화물질과 xanthin 산화효소 저해물질 생산 효모들의 균학적 특성
형태 및 배양 특성; 항산화물질과 xanthin 산화효소 저해물질 생산 우수 균주인 Rh. paludigenum HHGG35-1와 Rh. diobovatum NMD18-1 균주의 phylogenetic tree는 Fig. 2와 같고 형태와 배양 특성들을 조사한 결과는 Table 6과 같다. Rh. paludigenum HHGG35-1은 타원형, Rh. diobovatum NMD18-1은 구형으로 출아에 의해 영양증식을 하였고 크기는 각각 1.1 × 1.6, 1.6 × 1.6 μm이었다. 모두 포자를 형성하였으나 의균사를 형성하지 못하였다.
또한, 선발 균주들은 YPD, yeast extract-malt extract (YM) 및 potato-dextrose (PD)배지등에서 잘 생육하였고 40% 포도당을 함유한 YPD 배지에서도 생육하는 내당성을 보였다. 두 균주 모두 10% NaCl를 함유한 YPD 배지에서 잘 생육하는 호염성 효모들로써 내삼투압성과 호염균의 내염기작을 연구하는데 유용하게 활용될수 있을 것이고 이들로부터 내당성이며 내염성의 고부가가치의 대사산물을 생산하여 이를 당이나 염장 가공 식품산업으로 응용하는데 매우 귀중하게 사용될 것으로 사료된다.
Fig. 2
Phylogenetic tree of the antioxidant-producing Rhodosporidium paludigenum HHGG35-1 and xanthin oxidase inhibitor-producing Rhodosporidium diobovatum NMD18-1, based on the nucleotide sequences of large subunit 26S ribosomal DNA D1/D2 region.
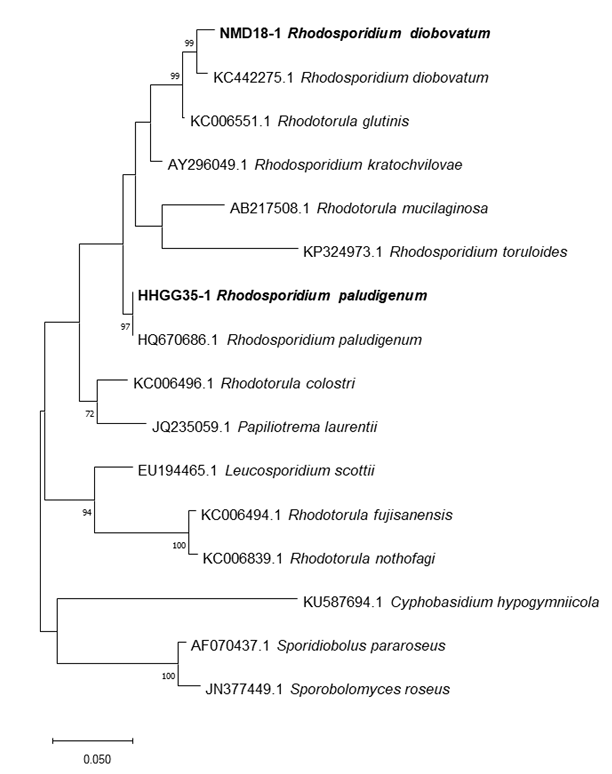
Table 6
Microbiological characteristics, assimilation and fermentation on sugars of Rhodosporidium paludigenum HHGG35-1 and Rhodosporidium diobovatum NMD18-1.
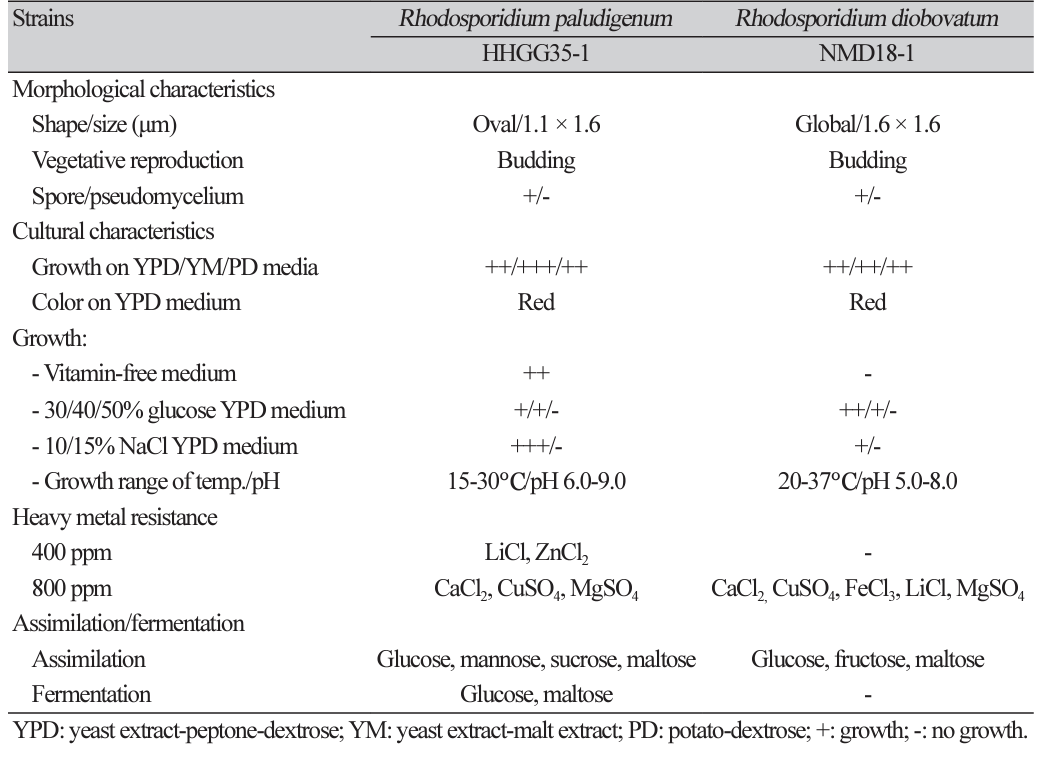
한편, 두 균주들은 Ca, Cu, Fe, Mg 등의 중금속 이온 등에 대하여 800 ppm까지 내성을 보였고 Rh. paludigenum HHGG35-1 균은 pH 6.0-9.0, Rh. diobovatum NMD18-1 균은 pH 5.0-8.0에서 잘 생육하였으며 선발 균주들은 20-37℃에서 생육하였다.
탄소원들에 대한 자화성과 발효성; 선발 균주들의 탄소원으로 당류와 당알코올에 대한 자화성과 발효성을 조사한 결과는 Table 6과 같다. 먼저 Rh. paludigenum HHGG35-1 은 포도당과 mannose, sucrose, maltose 등을 자화 시켰고 포도당과 maltose 만을 발효시켰다. 또한 Rh. diobovatum NMD18-1은 포도당과 fructose, maltose를 자화 시켰으나 실험에 사용한 모든 당류와 sorbitol을 발효시키지 못하였다.
적요
비병원성 야생 색소 효모로부터 건강 소재를 생산하기 위하여 대전광역시 월평공원 등에서 분리, 동정한 야생 효모들 중 비병원성 색소 효모들을 선별한 후 각종 생리활성과 효소활성들을 조사하였다. 최종적으로 항산화활성 우수 균주로 Rhodosporidium paludigenum HHGG35-1 와 항통풍성 xanthin 산화효소 저해물질 생산 우수 균주로 Rh. diobovatum NMD18-1를 선발하였다. Rh. paludigenum HHGG35-1의 항산화물질은 초기 pH를 6.5로 조정한 YPD 배지에 선발 균을 접종하여 30℃에서 24시간 배양하였을 때 76.9%의 최대 활성을 보였다. Rh. diobovatum NMD18-1의 xanthin 산화효소 저해물질은 선발 균주를 YPD 배지에 접종하여 30℃에서 96시간동안 배양하였을 때 91.6%의 최대 활성을 보였다. 항산화활성과 xanthin 산화효소 저해활성 우수 균주들의 균학적 특성을 조사하였다. Rh. paludigenum HHGG35-1는 타원형으로 포자를 형성하였고 YPD, YM, PD 배지 및 비타민을 첨가하지 않은 YPD배지에서 잘 생육하였으며 40% 포도당을 함유한 YPD 배지와 10% NaCl을 함유한 YPD 배지에서도 잘 생육하여 강한 내당성과 호염성을 보였다. 항통풍성 xanthin 산화효소 저해물질 생산 우수 균주인 Rh. diobovatum NMD18-1은 구형으로 포자를 형성하였고 YPD, YM, PD 배지에서 잘 생육하였으며 40% 포도당을 함유한 YPD 배지와 10% NaCl을 함유한 YPD 배지에서 생육하여 내당성과 내염성을 보였다. 그러나 비타민을 함유하지 않은 배지에서는 생육하지 못하였고 pH 5.0-8.0, 20-37℃에서 잘 생육하였으며 포도당, fructose, maltose를 자화 시켰다.