땅콩(Arachis hypogaea L.)은 1년생 콩과작물로 열대지역에서 오래전부터 재배되어 왔으며, 단백질과 지방이 풍부한 유지작물(oil seed sop)중 하나이다[1,2]. 땅콩은 꼬투리가 땅속에서 형성되므로 생육기간 중 토양병원균에 감염되면, 방제가 어렵고 땅콩의 수량과 품질이 심각하게 저하된다[3]. 국외의 경우, 땅콩에 주로 문제가 되는 토양 전염성병으로는 Ralstonia solanacearum에 의한 풋마름병과 Pythium myriotylum, Fusarium oxysporum에 의한 시들음병 등이 알려져 있으며[4,5], 최근에 국내에서도 풋마름병의 발생이 보고되었다[6]. 한편, 식물의 뿌리와 지제부의 줄기를 침입하여 조직을 썩게하고 지상부의 마름(시들음) 증상을 유발하는 Macrophomina phaseolina에 의한 균핵마름병은 최근 콩에서 문제가 되고 있는 고온성 병으로 국내에서는 2020년도에 콩에서 발생이 보고되었다[7]. 국외에서는 땅콩에서도 발생하는 것으로 보고되었으나[8], 국내에서는 아직까지 발생이 확인되지 않았다.
2021년 8월 익산(35°56'38.5"N; 126°59'36.8"E)의 땅콩 재배 포장의 1-2%의 땅콩 식물체에서 지상부 잎이 노랗게 변하면서 시들고, 마르는 증상이 관찰되었다(Fig. 1A and B). 시들음 증상을 보이는 식물체를 뽑아서 확인한 결과 지제부의 줄기와 뿌리가 갈색이나 검은 색으로 부패되고, 부패된 조직의 내에 소립균핵이 형성된 것을 관찰할 수 있었다. 이와 같은 병을 유발하는 병원균을 분리하기 위해 식물체의 지제부를 1 cm 크기로 절단한 뒤, 70% ethanol로 1분간 표면소독한 다음 멸균수로 수차례 세척한 후, 감자한천배지(potato dextrose agar, PDA; Difco, USA)에 치상하고, 30℃에서 배양하였다. 치상한 이병조직에서 배양 3일 후 정도에 연회색의 균사가 자라 나오기 시작하였는데, 자라나온 균사의 끝부분을 채취해 PDA배지에 2회 계대배양하여 순수분리하였다.
재료 및 방법
포도밭 내 야생 효모의 분리 및 동정
2023년 4월 경기도 김포시 소재 Campbell Early 품종의 포도를 재배하는 포도밭(37°41'39.5"N 126°38'55.3"E)에서 토양 샘플을 채집하였다. 멸균된 튜브에 9 mL의 멸균수를 넣고, 포도나무 주변 토양 샘플을 1 g 넣어 희석하였다. 이 현탁액을 연쇄 희석하여 YPD (Yeast extract peptone dextrose, DB Difco, USA) 한천 배지(pH 3.7-5.0)에 100 μL씩 분주하여 도말하였다. 이후 10℃에서 3~5일 배양한 후 효모 집락을 분리하였다[8]. 실험에 사용한 YPD 한천 배지는 chloramphenicol (0.4 g/mL) 0.04%, sodium propionate (0.2 g/mL) 0.02%를 첨가하여 제조하였다.
분리한 효모의 동정을 위해 26S rDNA의 D1/D2 region을 NL1, NL4 primer를 이용하여 polymerase chain reaction (PCR)을 수행하고, 증폭된 산물에 대하여 염기서열 분석을 수행하였다[9]. 확보한 염기서열은 미국 국립생물정보센터(National Center for biotechnology Information, NCBI)의 Basic Local Alignment Search Tool (BLAST) 데이터베이스를 통해 다른 효모와의 상동성을 비교하였고, Clustal X 2.0 프로그램을 이용하여 주변 서열들과 정렬하였다[10]. 계통수는 MEGA 11.0 프로그램에서 neighbor-joining method를 사용하여 구축하였다[11].
Fig. 1
(A, B) Charcoal rot symptom of peanut caused by Macrophomina phaseolina in fields of Iksan, Korea. (C) Sclerotia formed in potato dextrose agar (PDA) medium. Bar=100 μm. (D) Sclerotia formed on water agar barley leaf medium. Bar=400 μm.

분리된 균주들중 IS-1균주를 대상으로 먼저 형태학적 특성을 관찰하였다. IS-1 균주의 균총 선단을 PDA 배지에 치상 후 30℃에서 배양하면 시간이 지나면서 균사의 색이 흰색에서 점차 검은색으로 변하였으며, 검은색의 원형이나 타원형 모양의 균핵이 무작위로 형성되는 것이 관찰되었다(Fig. 1C). 또한, 온도별 병원균의 균사 생장을 비교한 결과 25℃에 비해 35℃에서 균사가 약 1.8배 더 빨리 생장하는 것을 확인하였다. 한편, 식물체에서의 균핵형성을 유도하여 관찰하기 위해 121℃에서 15분간 멸균한 보리 잎을 2% 물한천 배지(water agar) 위에 치상한 다음 보리 잎에 병원균을 접종하여 30℃에서 12시간 광/암 조건으로 배양하였다. 배양 7일 후에 보리 잎 위에 둥근 모양의 균핵이 다수 형성되었는데(Fig. 1D), PDA배지에서 형성된 균핵에 비해 모양이 비교적 일정하였으며, 균핵의 평균 직경은 194 μm (138-312 μm)였다.
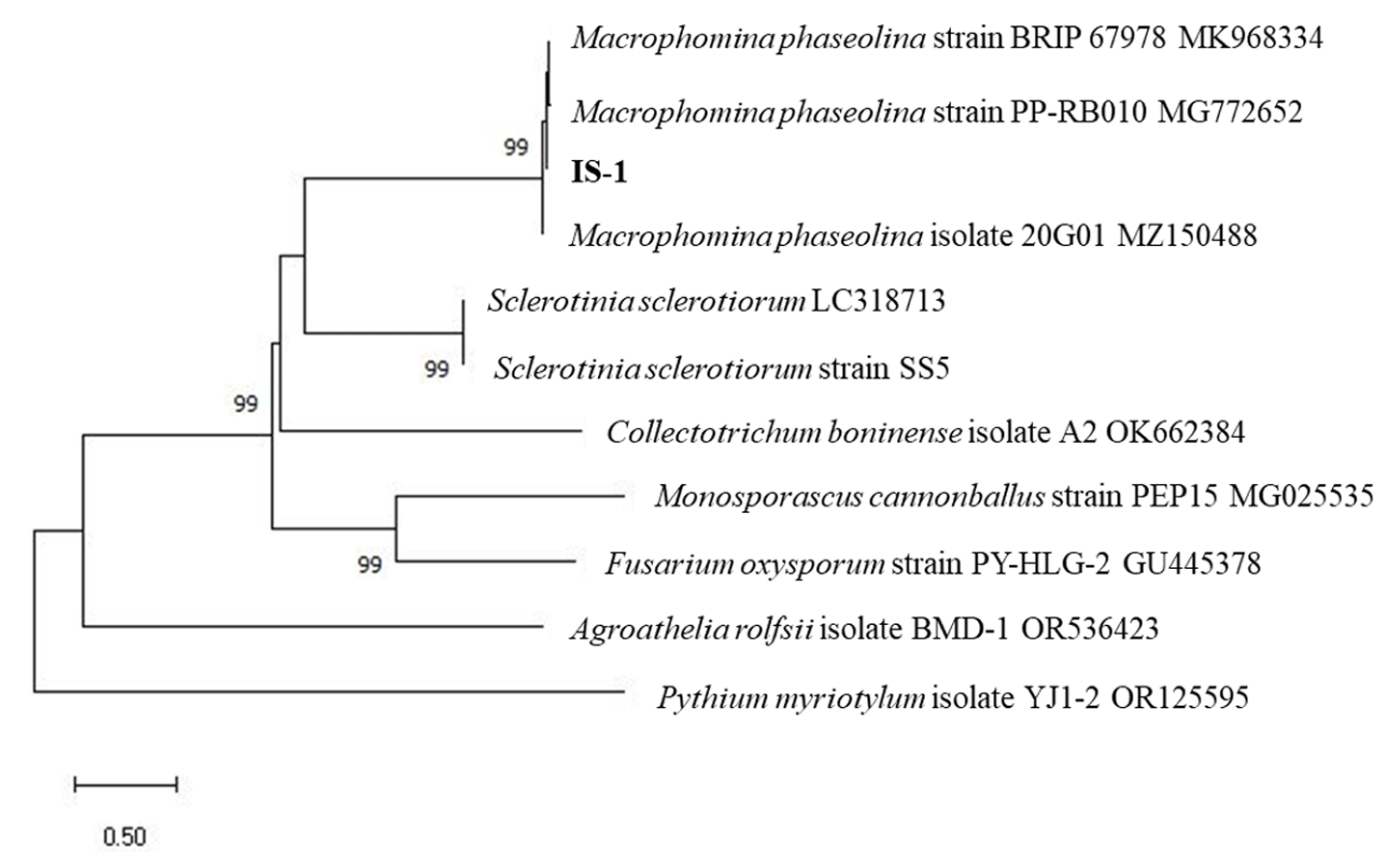
IS-1균주를 계통유전학적으로 동정하기 위해서 CTAB (cetyltrimethylammonium bromide) buffer를 이용하여 DNA를 추출한 후에 internal transcribed spacer (ITS) 영역과 calmodulin (CAL) 유전자를 각각의 프라이머 세트인 ITS4/ITS5와 CAL228F/CAL737R를 사용하여 PCR로 증폭하였다[9,10]. 증폭된 PCR 산물은 마크로젠(Macrogen, Daejeon, Korea)에 의뢰하여 염기서열을 분석하였다. National Center for Biotechnology Information (NCBI)의 BLASTN을 이용하여 염기서열을 비교한 결과, 두 유전자 모두 Macrophomina phaseolina (NCBI Acc no. MK968334, KF951962)의 염기서열과 100% 일치하였고, 분석한 염기서열은 NCBI의 GenBank database에 Acc no. OR879294 (ITS), OR905569 (CAL)로 등록하였다. 한편, 국내에서 보고된 M. phaseolina 균주들과 땅콩에서 시들음증상을 유발하는 Pythium myriotylum 및 흰비단병을 일으키는 Agroathelia rolfsii (=Sclerotium rolfsii) 균주들을 포함하여 ITS 영역의 염기서열 대상으로 MEGA X 프로그램을 이용하여 neighbor joining 방법으로 계통수를 작성하였다. 그 결과 본 연구에서 분리된 IS-1 균주와 M. phaseolina의 높은 근연관계를 확인하였으며(Fig. 2), IS-1 균주는 씨앗은행에 기탁하였다(KACC 410624).
Fig. 2
Neighbor-joining tree constructed with the internal transcribed spacer (ITS) regions of Macrophomina phaseolina IS-1. The present sequence was aligned with ten reference sequences, including M. phaseolina isolates from other hosts in Korean and other fungal pathogens on peanut in Korea. The phylogenetic tree was generated using MEGA 10 with 1,000 bootstrap replications (only values greater 70% are shown).
분리한 균주의 땅콩에 대한 병원성 검정을 위해서 2% NaOCl에 2분간 표면소독 후 멸균수로 3회 세척한 땅콩(품종명: 신팔광) 종자를 멸균수에 적신 솜위에 올려놓고 2일간 배양하여 발아시켰다. 이를 121℃에서 60분간 멸균한 상토가 담긴 폿트(직경: 9 cm; 높이: 8 cm)에 파종하고, 국립식량과학원의 온실에서 재배하면서 병원성 검정에 사용하였다. 병원균의 접종은 균핵이 형성된 이쑤시개를 이용한 접종 방법을 응용하였는데[7], 멸균된 이쑤시개(길이 12 mm) 5개와 PDA에서 예비 배양한 병원균의 균총 선단의 조각을 잘라서 함께 PDA에 치상하고, 30℃ 암조건에서 7일간 배양하여 이쑤시개 주변에 균핵이 자라도록 하였다. 이쑤시개의 선단부에 형성된 균핵을 접종원으로 사용하여 땅콩의 지제부의 줄기를 관통하도록 찔러 접종하였으며, 병원균과 같이 배양하지 않은 멸균된 이쑤시개만을 찔러 넣은 식물체를 무처리로 하여 비교하였다. 처리구와 무처리구는 각각 10개체씩 반복 접종하였으며, 접종된 식물체는 32℃ 온도에서 광/암 12시간 조건에서 재배하면서, 지상부에 시들음(마름) 증상의 발현 여부를 관찰하였다. 접종 후 35일경부터 지상부에 시들음 증상이 관찰되기 시작하여 40일째에는 완전히 고사되어, 수분을 공급해도 증상이 회복되지 않았다(Fig. 3). 발병된 식물체의 조직을 표면소독하고 균을 분리한 결과 M. phaseolina와 형태적・유전적으로 동일한 균이 재분리되었다.
Fig. 3
Symptoms of the artificially-infected peanut plants by Macrophomina phaseolina. The stems of peanut seedlings were inoculated with sclerotia using toothpicks, and symptom development was observed for 40 days in the growth chamber.

M. phaseolina는 전세계적으로 균핵마름병을 일으키는 병원균으로 고온건조한 환경에서 발생한다고 알려져 있으며, 국내에서는 콩, 박 등의 작물에서 발생이 보고되었으나[7,11,12], 땅콩에서 M. phaseolina에 의한 균핵마름병은 본 연구가 최초이다. 기후변화로 인해 기온이 상승하고, 잦은 강우로 인해 다습해지는 것을 고려할 때 M. phaseolina에 의한 균핵마름병의 발생이 증가할 가능성이 높다. 따라서, 땅콩을 안정적으로 재배하고, 수확을 높이기 위해서는 여름철 생육기에 M. phaseolina에 의한 균핵마름병의 적절한 관리가 필요할 것이다. 본 연구에서는 국내 땅콩에서 발생한 M. phaseolina에 의한 지상부와 지하부의 여러 증상과 병원균의 특징을 고려하여 균핵마름병으로 보고하고자 한다.


