표고는 우리나라에서 많이 재배되는 버섯 중 하나이며, 생표고와 건표고로 유통되고 있다. 2021년 생표고 생산량과 생산액은 16,568톤, 1,592억원, 건표고는 803톤(생표고 환산 5,869톤), 286억원에 이른다[1]. 표고의 품종육성은 원목재배용보다는 톱밥재배용 품종이 많이 이루어지며, 산림품종관리센터에 등록된 품종은 현재 59개에 이른다[2].
표고 품종을 육성하기 위해서는 기본적으로 단핵균사와 단핵균사 간의 교배를 하거나 단핵균사와 이핵균사를 교배하는 방법을 사용한다[3]. 먼저 표고는 4극성의 교배체계를 지니며 균사간의 교배 여부는 서로 독립적인 A교배형과 B교배형에 의해 결정된다[4,5]. 각각의 단핵균사의 교배형이 서로 다른 경우에만 교배가 이루어질 수 있으며, 표고 균주의 이핵균사의 교배형을 분석하면 단핵균사 간의 적절한 교배형 조합을 통해 자실체를 만들 수 있는 성공적인 교배를 예상할 수 있게 된다. 따라서 본 연구에서는 교배형 분석방법을 활용하여 이핵균주를 육성하는 경우 육성효율이 어느 정도인지 알아보고자, 톱밥재배 방법을 이용하여 교배육성된 이핵균주들의 버섯 생산 특성을 알아보았다.
단핵균주 분리
실험에는 국립산림과학원이 개발한 ʻ산백향’과 청흥버섯영농조합이 개발한 ’청흥1호’ 품종을 이용하였다[6]. 산백향은 보관균주를 톱밥재배하여 발생시킨 버섯으로부터 포자를 받아 멸균수로 희석한 후 90 mm 페트리디쉬 potato dextrose agar (PDA, BD Difco, Franklin Lakes, USA) 배지에 도말하였다. 배지는 저온배양기(Dasol Scientific, Hwaseong, Korea)에서 5-7일간 25℃에서 배양하면서 포자 발아를 확인하였다. 발아된 포자들 중 단포자로 판단되는 균사체 100여개를 PDA배지에 계대배양하여 25℃에서 14-21일간 배양하였다. 청흥1호는 주름살이 형성되지 않는 무포자 품종으로 단핵균사를 분리하기 위해 이핵균사의 원형질체를 분리한 후 재분화 과정을 통해 단핵균사를 선발하였다[7,8]. 이 과정을 통해서 버섯의 이핵균사로부터 단핵균사를 분리하였다. 산백향과 청흥1호로부터 유래한 단핵균사들은 PDA배지에 계대배양하고 25℃ 저온배양기에서 14-21일간 배양하여 교배형 분석에 이용하였다.
교배형 분석
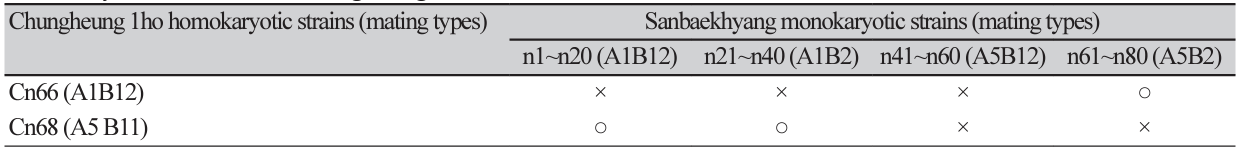
교배에 앞서 산백향과 청흥1호의 교배가 가능한 조합을 조사하기 위해 이핵균사와 단핵균사들의 교배형 분석을 수행하였다[4]. 산백향은 A1A5B2B12 교배형을 지니고 있으며, 포자로부터 유래한 단핵균사는 A1B2, A1B12, A5B2, A5B12의 교배형 중에서 한 가지 교배형을 갖는다. 그 중 각각의 교배형 별로 20균주씩 총 80개의 단핵균사를 선발하였다. 청흥1호의 교배형은 A1A5B12B11이며, 교배형 조합에 따라 A1B12와 A5B11의 두 가지 교배형을 가지는 단핵균사를 분석하여 교배에 이용하였다.
균주 교배
산백향으로부터 유래한 80개의 단핵균주(n1-n80)와 청흥1호로부터 유래한 2개의 단핵균주(Cn66, Cn68)를 이용하여 교배를 실시하였다. 각각의 단핵균주들의 교배형 그룹에 따라 교배에 성공할 수 있는 조합은 3가지로 확인되었다(Table 1). 교배형에 따라 선발된 단핵균사를 서로 붙여서 배양하여 교배를 실시하고 서로의 균사들이 융합되어 하나의 균총으로 자란 부위를 순수분리하여 교배균주로 선발하였다[9]. 그 결과 3가지 교배조합으로부터 각각 20개의 균주를 얻어 총 60개의 교배균주를 얻었으며 균사체의 교배율은 100%로 나타났다. 선발된 교배균주는 PDA배지에 계대배양하여 25도에서 2주간 배양한 후 톱밥재배의 접종원으로 이용하였다.
톱밥배지 제조, 종균 접종 및 배양
교배균주의 톱밥재배에는 2 kg 사각블럭배지를 이용하였다. 배지 재료로는 참나무톱밥(상수리나무와 신갈나무 1:1, w/w)과 밀기울을 사용하였으며, 85:15 (w/w)의 비율로 혼합하였다. 함수율은 60% 정도로 조정하였다. 입봉한 사각블럭배지는 고압증기멸균기로 100℃ 60분, 121℃ 90분 동안 멸균 후 18℃에서 충분히 냉각한 후 사용하였다. 균주별로 한 개의 PDA배지에 90%정도 자란 균사체를 4개로 조각내어 한 개의 사각블럭배지에 무균상에서 접종하였고 균주별로 3반복씩 수행하였다. 접종이 완료된 배지는 밀봉하여 온도 23℃, CO2 농도는 1,000 ppm으로 유지되는 배양실에서 60일간 암배양 후, 60일간 명배양(백색광, 250 lux)을 실시하였다. 총 60균주 180개 배지를 이용하여 배양을 실시한 결과 배양 초기 산백향 단포자 균주를 청흥1호 Cn68 균주와 교배한 60개 균주들의 균사생장이 청흥1호 Cn66 균주와 교배한 20개 균주들보다 빠른 것을 알 수 있었다.
버섯 발생 및 특성
120일간의 배양이 완료된 사각블럭배지는 발생실로 옮겨 비닐봉지를 개봉하여 발생작업을 실시하였다. 이때 배양이 온전하게 완료된 배지만 발생처리를 실시하였는데, 청흥1호 Cn68 균주와 교배한 균주들은 6개 균주를 제외하고 3반복 배지 모두 버섯 발생처리를 실시하였으나, Cn66 균주와 교배한 균주들은 1개 균주는 3개, 3개 균주는 2개, 12개 균주는 1개의 배지만 버섯 발생처리를 실시하였다. 4개 균주는 버섯 발생을 실시하지 못하였다. 발생실의 온도와 습도는 버섯 발생을 위해 18℃와 80%로 조정하였으며, 수분공급을 위해 버섯이 발생되기 전까지 배지 표면에 주기적으로 살수를 실시하였다. 버섯 발생은 1차 발생만 수행하였다. 발생한 버섯은 배지와 가까운 부분을 절단하여 수확하였고, 국립산림품종관리센터의 ’신품종 심사를 위한 표고버섯 재배 및 특성조사 매뉴얼’에 따라 특성조사를 수행하였다[10]. 다만 배지에서 버섯이 발생하는 경우 균주별로 온전한 버섯 한 개씩은 유전자 분석을 위해 생산량과 특성조사를 하지 않고 보존하였으며, 버섯이 기형인 경우에도 생산량과 특성조사를 실시하지 않았다.
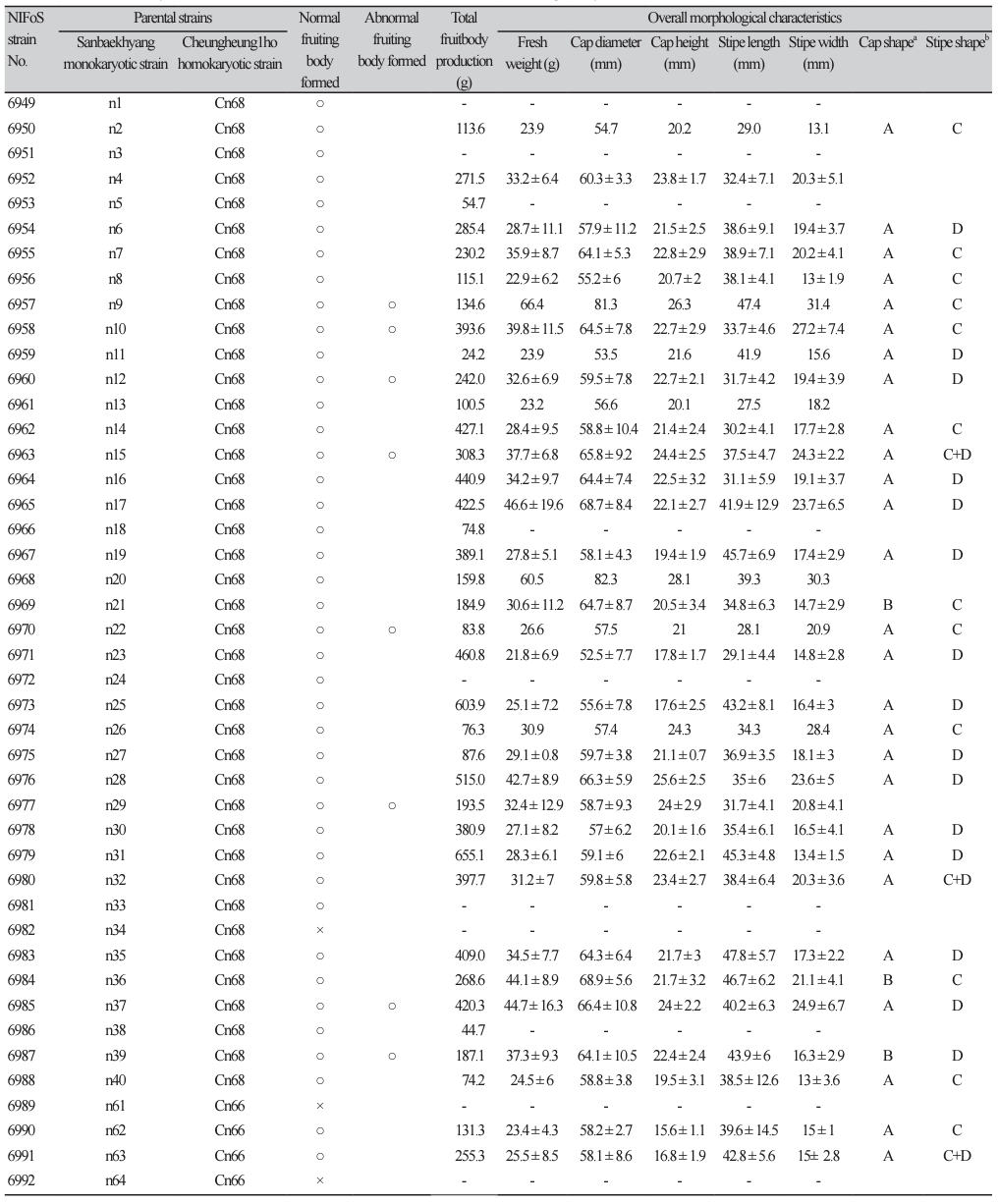
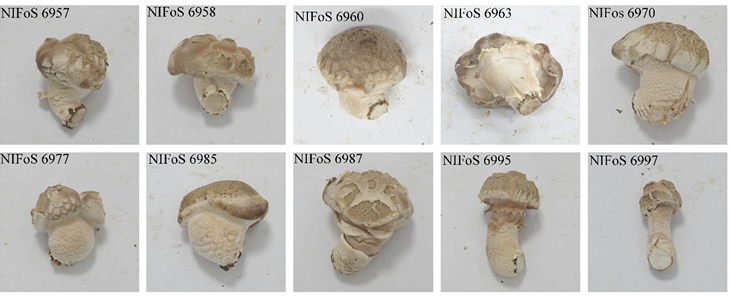
발생실에서 자실체를 유도한 결과 총 60개 균주 중 55개 균주로부터 버섯이 발생하였다(Fig. 1; Table 2). 이러한 결과로 미루어 보아 교배형 분석을 통해 교배하는 경우 교배율은 100%에 이르며, 버섯 발생률은 91.7%정도로 매우 높은 것을 알 수 있었다. 일반적인 방법으로 교배형 분석을 실시하지 않고 서로 다른 모균주의 단포자 균주를 이용하여 교배를 실시하고 버섯을 발생시키는 경우(교배 성공률 53%, 버섯 발생률 22% [9], 혹은 교배 성공률 51%, 버섯 발생률 63.2% [11])와 비교하면 교배형 분석이 교배 균주의 교잡 성공률과 버섯 발생률을 높이는데 매우 효과적임을 알 수 있다. 버섯이 발생하지 않은 균주 5개 중 4개는 청흥1호 Cn66으로부터 유래한 균주로 이러한 균주들이 버섯발생이 되지 않은 것은 배양 단계에서 균사생장이 원활하지 않은 것이 영향을 준 것으로 판단된다. 버섯의 생산량을 조사하지 못한 경우를 제외하고도 Cn68유래 균주들(263.7 g)이 Cn66유래 균주들(195.1 g)보다 좀 더 높게 나타났다.
Fig. 1
Fruiting bodies of Lentinula edodes derived from Sanbaekhyang and Chungheung 1ho by monomono hybridization.

Table 2
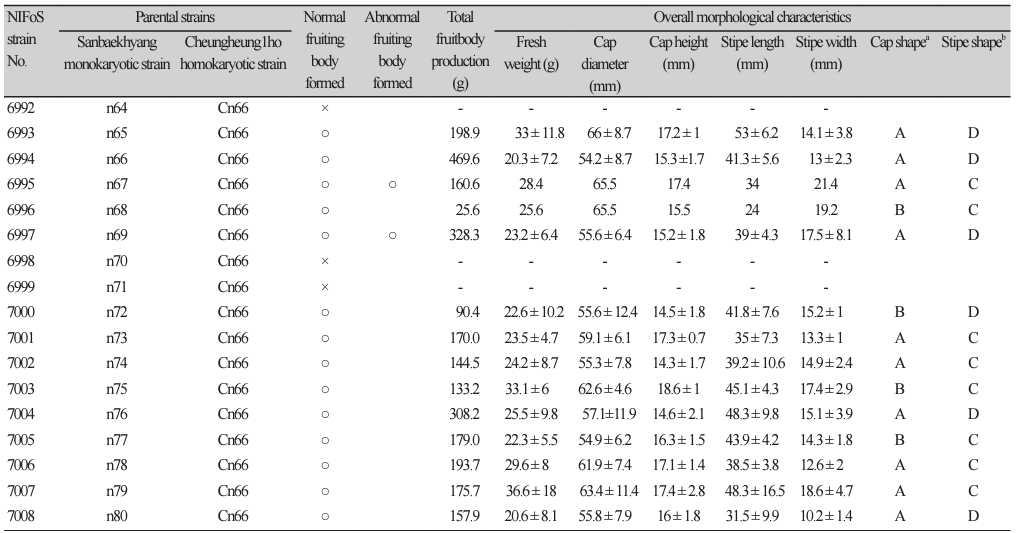
List of 60 hybridized strains of Lentinula edodes and their fruiting body characteristics (continued).
55개 균주에서 발생한 버섯은 갓의 주름살이 정상적으로 형성된 것이 대부분이었으나, 10개 균주(18.2%)의 경우 기형버섯이 같이 발생하였다(Fig. 2). 본 연구에서 의미하는 기형버섯은 버섯의 주름살이 갓 밑면에 주름살이 일부 혹은 전혀 형성되지 않는 버섯들로 이러한 버섯들은 균주별로 1개에서 4개정도 발생하였다. 가강현 등[9]은 단포자 교배의 상호작용보다는 하나의 단포자가 주름살 형성에 더 크게 관여한다고 하였다. 본 연구에서는 주름살을 형성하지 않는 버섯만 만든 교배균주는 없었으나 주름살을 형성하지 않는 청흥1호 단핵균주의 유전자가 기형버섯 형성에 영향을 준 것으로 판단된다. 더 자세한 것은 추후 유전자 분석을 통해 알아볼 계획이다.
버섯의 갓은 대부분 청흥1호와 유사한 평반구형, 대는 산백향과 유사한 기둥형을 나타내었으며, 일부 균주는 갓이 산백향화 유사한 편평형이거나 대가 청흥1호와 유사한 곤봉형으로 발생하기도 하였다. 버섯의 중량(20.3-66.4 g), 갓직경(52.5-82.3 mm), 갓두께(14.3-28.1 mm), 대길이(24.053.0 mm), 대두께(10.2-31.4 mm) 등은 균주별로 매우 다른 특성을 나타내었으며, 교배균주별로 일정한 양상을 보이지 않았다. 이는 산백향으로부터 감수분열을 통해 만들어진 단포자들로부터 기인한 특성으로 판단되며 형태적으로 더 우수한 특성을 지닌 버섯을 육성하기 위해서는 각각의 교배 모본의 특성을 평가할 수 있는 연구가 더 필요하다.